






高中化学人教版 (2019)必修 第一册第二节 离子反应图文课件ppt
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应图文课件ppt,共28页。PPT课件主要包含了学习目标,离子共存问题,物质的检验与推断,课堂小结,课堂达标等内容,欢迎下载使用。
1、从离子反应认识离子共存问题。2、从离子方程式书写原则认识离子方程式正误判断方法。3、从探究性实验设计认识电解质溶液导电能力。4、理解与“量” 有关的离子方程式书写方法。5、根据离子性质进行物质的鉴别和推断
课本P19 T4
此题型考查离子反应发生的条件
所谓几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若离子之间能发生离子反应,则不能大量共存。
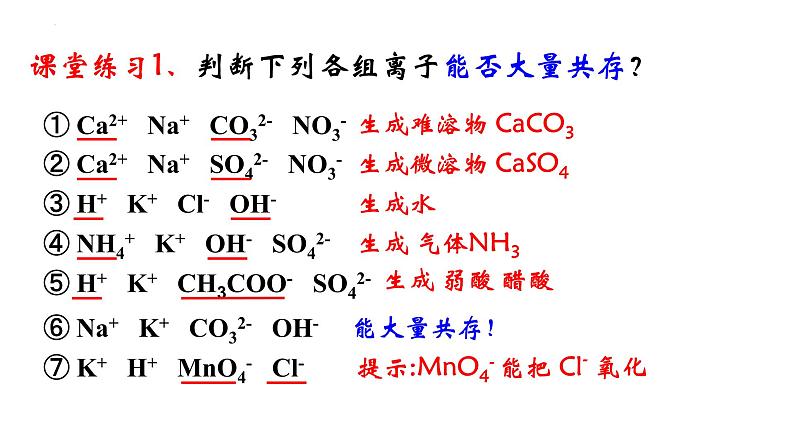
课堂练习1、判断下列各组离子能否大量共存?
① Ca2+ Na+ CO32- NO3-
② Ca2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ NH4+ K+ OH- SO42-
⑤ H+ K+ CH3COO- SO42-
⑥ Na+ K+ CO32- OH-
⑦ K+ H+ MnO4- Cl-
生成难溶物 CaCO3
生成微溶物 CaSO4
提示:MnO4- 能把 Cl- 氧化
1. 发生复分解反应的离子不能大量共存⑴生成难溶和微溶物:例如Ag+与Cl-,Ca2+和SO42-不能共存;⑵生成气体:例如CO32-、HCO3-、SO32-、HSO3-等易挥发的弱酸酸根不能跟H+大量共存;⑶生成难电离物质:如H+和OH-生成H2O,CH3COO-和H+生成CH3COOH,NH4+和OH-生成NH3·H2O。
(4)弱酸酸式根离子(如H2PO4-、HPO42-、 HCO3-、HS-、 HSO3- 等)在酸、碱性溶液中均不能大量共存!
2.离子共存问题审题技巧(1)注意判断离子共存的情况:“能、不能”,“一定、可能、一定不能”。(2)注意题干中提示的溶液酸碱性:酸性溶液(或pH﹤7)中隐含有H+,碱性溶液(或pH﹥7)中隐含有OH-(3)注意题干中提示的溶液颜色:溶液无色时,有色离子如Cu2+、Fe3+、Fe2+、MnO4-不能存在。(4)注意正确理解“透明溶液”,如:NaCl溶液、KOH溶液为无色透明溶液,CuSO4溶液、FeCl3溶液是有色透明溶液,不能认为“有色”就不透明。
课堂练习2、有离子:①Cl- ②SO42- ③H+ ④OH- ⑤CO32- ⑥HCO3- ⑦Na+ ⑧Cu2+ ⑨Ca2+ ⑩Ag+⑪Ba2+ ⑫K+ ⑬MnO4-(1)在酸性条件下,不能大量共存的有________(填序号,下同)。(2)在碱性条件下,不能大量共存的有________。(3)在无色溶液中,不能共存的有________。
课堂练习3、在水溶液中能大量共存的一组是( )A.0.1 ml·L-1的NaOH溶液中:K+、Na+、SO42-、CO32-B.K+、Cu2+、OH-、NO3-C.0.1 ml·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-D.K+、Mg2+、SO42-、OH-
二、离子方程式的正误判断
此题型考查离子方程式的书写注意:两易—易溶易电离两等—两边同元素原子个数相等、 两边的电荷总数相等两查—是否漏反应条件、是否有公约数
课本P18 T3
课堂练习4、判断下列离子方程式是否正确并说明理由 (1)铁与稀盐酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑(2)FeCl3与Fe反应:Fe3+ + Fe = 2Fe2+(3)硫酸和Ba(OH)2溶液反应: Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O(4)碳酸钡和稀硝酸反应: CO32-+2H+ = H2O + CO2↑(5)硫酸镁和Ba(OH)2溶液反应: Ba2+ + SO42- = BaSO4↓
离子反应是不符合客观事实
阴、阳离子的个数配比不符合化学式
离子方程式正误判断方法
(1)看是否符合客观事实如Fe加入硫酸铜溶液中:错误:2Fe+3Cu2+=2Fe3++3Cu错因:Fe和硫酸铜溶液反应生成FeSO4和Cu正确:Fe+Cu2+=Fe2++Cu
(4)看是否遵守电荷守恒如钠与稀硫酸反应:错误:Na+2H+=Na++H2↑错因:电荷不守恒正确:2Na+2H+=2Na++H2↑
课堂练习5、下列离子方程式正确的是( )
A:铝和稀硫酸 Al+2H+=Al3++H2↑B:石灰石和盐酸 CO32-+2H+=CO2↑+H2OC:氢氧化钡和稀硫酸 H++OH-=H2OD:铜和硝酸银溶液 Cu+Ag+=Cu2++AgE:澄清的石灰水和盐酸 H++OH-=H2OF:碳酸钡和稀硫酸 BaCO3+2H+=Ba2++CO2↑+H2O
课堂练习6、 能正确表示下列化学反应的离子方程式的是( )A.向ZnCl2溶液中加入Fe粉:Fe+Zn2+=Fe2++ZnB.向硫酸溶液中加入Cu(OH)2固体:OH-+H+=H2OC.向碳酸氢钠溶液中加入稀盐酸:CO32-+2H+=CO2↑+H2OD.向氯化钾溶液中滴加硝酸银溶液:Cl-+Ag+=AgCl↓
电解质溶液的导电能力与溶液中离子的浓度及离子所带电荷总数多少有关,离子浓度越大,离子所带电荷总数越多,溶液导电能力越强。
课本P19 T9
三、电解质溶液的导电能力
Ba(OH)2 ═ Ba2+ + 2OH‾
A-B导电能力减小几乎变为零
Ba2+ + 2OH‾ +2H+ + SO42- ═ BaSO4↓+ 2H2O
H2SO4 ═ 2H+ + SO42-
课堂练习7、已知:CO2+Ca(OH)2=CaCO3+H2OCaCO3+CO2+H20=Ca(HCO3)且Ca(HCO3)2易溶于水,试根据如图所示装置回答下列问题:(1)通入CO2前,灯泡____(填“亮”或“不亮”)。(2)开始通入CO2时,灯泡的亮度____________(3)继续通入过量的CO2,灯泡的亮度__________(4)下列四个图中,哪一个能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电力)( )
2、四项原则推断物质(1)肯定性原则:根据题干或实验现象确定物质。(2)否定性原则:根据已确定的物质结合反应排除不存在的物质。(3)引入性原则:注意实验过程中物质的引入对推断物质的干扰。(4)电中性原则:在溶液中一定为电中性,阴、阳离子带的电荷数相等。
1.物质检验的几个方面(1)沉淀法:如Ag+、Cl-、SO42-、Ca2+的检验。(2)气体法:如CO32-。
课本P30 T12
课本P30 T13
课堂练习8、某河道两旁有甲、乙两厂。它们排放的工业废水中,共含有K+、Ag+、Fe3+、Cl-、OH-、NO3—六种离子。(1)甲厂的废水明显呈碱性,故甲厂废水所含的三种离子是_______________;乙厂的废水中含有另外三种离子,如果加适当过量的________,可以回收其中的金属______ (填写元素符号),过滤可得到单一溶质的溶液,涉及的离子方程式为_____________________________________________。(2)另一种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的________________________(填写离子符号)转化为沉淀,经过滤后的废水主要含________,可用来浇灌农田。
Fe+2Ag+===2Ag+Fe2+、Fe+2Fe3+=3Fe2+
Ag+、Fe3+、Cl-、OH-
课堂练习9、有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。根据上述实验事实,回答下列问题:(1)原白色粉末中一定含有的物质是_______________(写化学式,下同),一定不含有的物质是_______,可能含有的物质是_____。(2)写出各步变化的离子方程式:①____________________;②________________________________
Ba(NO3)2、Na2CO3
Ba2++CO32-=== BaCO3↓
BaCO3+2H+=== Ba2++CO2↑+H2O
五、与“量”有关的离子方程式的书写
NaOH与Ca(HCO3)2反应:
NaOH + Ca(HCO3)2= CaCO3 ↓+ H2O + NaHCO3
2NaOH + Ca(HCO3)2= CaCO3 ↓+ 2H2O + Na2CO3
OH- + Ca2+ + HCO3- = CaCO3 ↓+ H2O
2OH- + Ca2+ + 2HCO3- = CaCO3 ↓+ 2H2O + CO32-
“少量定1法”:把少量物质的化学计量数定为“1”,其参加反应的离子个数比与化学式相符。
课堂练习10.写出下列反应的离子方程式。(1)向Ca(HCO3)2溶液中加入足量NaOH溶液__________。(2)向NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性______。(3)向NaOH溶液中充入过量CO2______________________。
与量有关离子方程式的书写
1. 下列各组离子能在溶液中大量共存的是( ) A.Fe3+ Na+ NO3- OH- B.NH4+ Fe3+ SO42- NO3- C.SO42- Cl- Ca2+ Mg2+ D.Ba2+ K+ CO32- Cl-
2、在无色透明强酸性溶液中,能大量共存的离子组是( ) A.Mg2+、NH4+、NO3-、SO42- B.Na+、K+、Cl-、CO32- C.K+、Al3+、OH-、NO3- D.Na+、Fe3+、SO42-、Cl-
3、下列离子方程式正确的是( )A.石灰石与盐酸反应: CO32- +2H+=CO2↑+H2OB.铜和硝酸银溶液反应:Cu+Ag+=Cu2++AgC.向Ba(OH)2溶液中逐滴滴加NaHSO4溶液至SO恰好沉淀完全:Ba2++2OH-+2H++ SO42- ===BaSO4↓+2H2OD.NH4HCO3溶液与过量稀盐酸混合:HCO3- +H+===CO2↑+H2O
4.(双选)下列离子方程式书写正确的是( )A.Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑B.MgCO3与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑C.往澄清石灰水中通入过量CO2气体:CO2+OH-=HCO3-D.向H2SO4溶液中加入Ba(OH)2溶液至中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
5、2gNaOH固体分别加入下列100mL液体中,溶液导电能力变化不大的是 ( )A.自来水B.含2.45gH2SO4的硫酸溶液 C.含2.925gNaCl的溶液D.含4.25gNaNO3的溶液
(1)氢氧化钠通入过量CO2:__________________________________(2)石灰水与过量碳酸氢钠溶液反应: _________________________________________ (3)Ba(OH)2溶液与NaHSO4溶液的反应①溶液呈中性时_____________________________________________________②溶液呈碱性时_____________________________________________________
6.书写下列反应的离子方程式
CO2+OH-===HCO3-
2HCO3−+Ca2++2OH−= CaCO3↓+CO32−+2H2O
Ba2++OH− + H++SO42- ==== H2O + BaSO4↓
Ba2++2OH− + 2H++SO42- ==== 2H2O + BaSO4↓
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教学ppt课件,共24页。PPT课件主要包含了学习目标,活动一,活动二,离子共存的审题思路,一看颜色,二看酸碱性,三看反应等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 离子反应教学ppt课件,共21页。PPT课件主要包含了学习目标,离子反应的条件,生成水弱电解质,生成沉淀,生成气体等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应完美版ppt课件,共28页。PPT课件主要包含了学习目标,情境思考,实验探究,出现白色沉淀,实验分析,离子反应,Na+Cl-,Na2SO4,BaCl2,Na+等内容,欢迎下载使用。









