






所属成套资源:新人教版化学必修第二册课件PPT+整理提升课件+综合测评课件整套
高中化学人教版 (2019)必修 第二册第三节 无机非金属材料获奖ppt课件
展开
这是一份高中化学人教版 (2019)必修 第二册第三节 无机非金属材料获奖ppt课件,共60页。PPT课件主要包含了硅酸盐材料,尝试解答,硅元素的存在,硅单质,问题探讨等内容,欢迎下载使用。
第三节 无机非金属材料
1.知道常见的硅酸盐材料玻璃、水泥、陶瓷及生产它们的主要原料。2.了解高纯硅的制备原理。知道硅和二氧化硅的用途。3.知道一些新型无机非金属材料如硅和二氧化硅、新型陶瓷和碳纳米材料等。
1.通过对硅酸盐结构的了解培养学生宏观辨识与微观探析的能力。2.通过对几种重要无机非金属材料生产及用途的学习,提高学生科学精神与社会责任。
课前篇
·
自主学习固基础
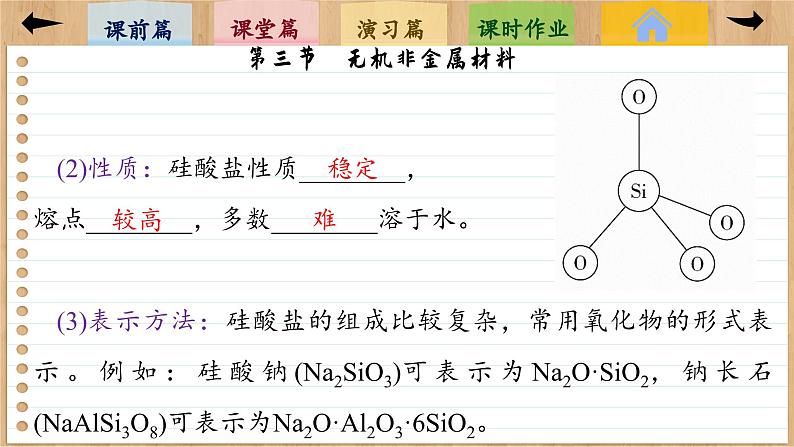
1.硅酸盐(1)结构:在硅酸盐中,Si和O构成了硅氧四面体,即以硅原子为中心,氧原子在四面体的4个顶角(如图所示),许多这样的四面体还可以通过顶角的O相连接,即每个Si与周围4个O结合,每个O与2个Si结合。硅氧四面体结构的特殊性,决定了硅酸盐材料的特殊性质。
(2)性质:硅酸盐性质________,熔点________,多数________溶于水。(3)表示方法:硅酸盐的组成比较复杂,常用氧化物的形式表示。例如:硅酸钠(Na2SiO3)可表示为Na2O·SiO2,钠长石(NaAlSi3O8)可表示为Na2O·Al2O3·6SiO2。
(4) 最简单的硅酸盐——Na2SiO3
SiO32-+2H+===H2SiO3↓
2CO2+SiO32-+2H2O ===2HCO3-+H2SiO3↓
2.传统的无机非金属材料——硅酸盐产品
SiO2+Na2CO3====Na2SiO3+CO2↑
硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
二、新型无机非金属材料
1.硅和二氧化硅(1)硅晶片是生产________的基础,属于________材料,是因为硅元素位于元素周期表第________周期,第________族,单质的导电性介于________和________之间。高纯硅广泛用于信息技术和新能源技术领域。
(2)工业上制备高纯硅①硅元素的存在:全部以化合态存在,主要以_________和氧化物(如水晶、玛瑙)形式存在。②生产流程:石英砂——————→粗硅———→SiHCl3———→高纯硅。
焦炭1 800~2 000 ℃
写出其中涉及的主要化学反应的化学方程式:___________________________________________________;___________________________________________________;___________________________________________________。(3)光导纤维的生产需要________,优点:通信容量大,抗干扰性能好,传输信号不易衰减。
1.单质硅在常温下化学性质稳定,所以硅在自然界中以游离态存在,这种说法是否正确?为什么?________________________________________________________________________________________________________________________________________________________
提示:不正确。硅属于亲氧元素,虽然在常温下稳定,但在漫长的地质年代中,硅元素和氧结合在一起,都以化合态存在,主要以二氧化硅及硅酸盐的形式存在。
2.实验室中盛放碱液的试剂瓶为什么用橡胶塞而不用磨口玻璃塞?________________________________________________________________________________________________________________________________________________
提示:玻璃中含有SiO2,SiO2与碱反应生成具有黏合作用的硅酸盐,使瓶口和瓶塞黏结在一起而难以开启
课堂篇
·
重点难点要突破
研习1 硅、二氧化硅、硅酸盐
硅酸盐由于组成比较复杂,通常用氧化物的形式表示其组成,改写时的规律为:(1)顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水;氧化物之间以“·”隔开。
一、硅酸盐氧化物形式的书写
(2)原则:各元素原子总个数比符合原来的组成,若出现分数应化为整数。例如:钠长石(NaAlSi3O8)不能写成12Na2O·12Al2O3·3SiO2,应写成Na2O·Al2O3·6SiO2。(3)各元素的化合价不能改变。
(1)物理性质:熔点高、硬度大、不溶于水。(2)化学性质①常温下能与氟气、氢氟酸、强碱等反应。Si+2F2===SiF4Si+4HF===SiF4↑+2H2↑Si+2NaOH+H2O===Na2SiO3+2H2↑(Si+2NaOH+4H4e-2O===Na2SiO3+3H2O+2H2↑)
能与NaOH溶液反应的单质:Al、Si、S(加热)、Cl2。
② 加热时能与氧气、氯气、碳等反应。
Si+O2=====SiO2 Si+2Cl2=====SiCl4 Si+C=====SiC
(3) 用途:半导体材料、芯片、太阳能电池。
3.二氧化硅(1)存在SiO2存在形态有结晶形和无定形两大类,统称硅石。石英、水晶、玛瑙、沙子、光导纤维的主要成分均是SiO2。(2)结构SiO2晶体是由Si和O按原子数之比为1∶2的比例组成的正四面体结构的晶体。每个硅原子周围结合4个O原子,每个O原子周围结合2个Si原子。
(3) 物理性质熔点高,硬度大,不溶于水。
(5)用途①沙子是基本的建筑材料。②纯净的SiO2是现代光学及光纤制品的基本材料,可以制作光导纤维。③水晶和玛瑙用来制作饰物和工艺品。④实验室中使用的石英坩埚。
4. 硅及其氧化物的特性
2018年3月5日,中国22岁的青年学者曹原在《自然》连刊两文介绍石墨烯超导重大发现,当将两层平行石墨烯堆成约1.1°的微妙角度,就会产生神奇的超导效应。2018年12月,《自然》杂志发布了2018年度影响世界的十大科学人物排行榜,曹原名列榜首。
石墨烯是一种由碳原子构成的六角型二维碳纳米材料,具有超高硬度、强度和导热系数等特性。
1.碳和硅的最外层电子数都是4,且碳元素的非金属性强于硅,但碳在自然界中有稳定的单质(如金刚石、石墨),而硅却没有,其原因是什么?
提示:硅是一种亲氧元素,硅与氧形成硅氧四面体的稳定结构,故自然界中无游离态的硅,而是以二氧化硅和硅酸盐的形式存在于自然界中。
2.工业上用焦炭和石英砂在高温下制备粗硅时,为什么要隔绝空气?写出工业上制备粗硅的化学方程式。
3.已知:SiO2+4HF===SiF4↑+2H2O,SiO2既能与NaOH溶液发生反应,又能与氢氟酸发生反应,因此,SiO2属于两性氧化物,这种说法正确吗?
提示:不正确;SiO2尽管能与氢氟酸反应,但与其他强酸(如HCl、HNO3等)不反应,故SiO2不属于两性氧化物,属于酸性氧化物。
4.你知道的碳纳米材料有哪些?碳化硅陶瓷是传统无机非金属材料还是新型无机非金属材料?
提示:碳纳米材料主要有富勒烯、碳纳米管、石墨烯等。碳化硅陶瓷属于新型无机非金属材料。
解析:A项,Ca(Al2Si3O10)·3H2O应改为CaO·Al2O3·3SiO2·3H2O(排序错);B项,Mg2SiO4应改为2MgO·SiO2(不能在化学计量数中出现分数);C项,K2Al6Si6H4O24应改为K2O·3Al2O3·6SiO2·2H2O(排序错)。
2.将过量的CO2分别通入:①CaCl2溶液;②浓Na2SiO3溶液;③Ca(OH)2溶液;④饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是( )A.①②③④ B.②④ C.①②③ D.②③
解析:CO2溶于水:CO2+H2O====H2CO3,H2CO3的酸性比盐酸弱,而比硅酸强。根据酸与盐反应的规律,CO2通入CaCl2溶液无明显现象;过量的CO2通入浓Na2SiO3溶液中有白色沉淀H2SiO3生成;CO2通入Ca(OH)2溶液中至过量,Ca(OH)2+CO2===CaCO3↓+H2O, CaCO3+H2O+CO2===Ca(HCO3)2,最终生成Ca(HCO3)2而无沉淀;过量CO2通入饱和Na2CO3溶液中:Na2CO3+H2O+CO2===2NaHCO3↓,生成的NaHCO3溶解度比Na2CO3溶解度小而析出结晶。
3.下列关于硅单质及其化合物的说法正确的是( )①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品③高纯度的硅单质广泛用于制作光导纤维④陶瓷是人类应用很早的硅酸盐材料A.①② B.②③ C.①④ D.③④
解析:许多岩石和矿物中含有硅元素,①正确;水晶的主要成分是二氧化硅,所以水晶不是硅酸盐制品,②错误;光导纤维是由高纯度的二氧化硅制成的,③错误;陶瓷属于硅酸盐制品,④正确。
4.(双选)用石英砂制取高纯硅的主要化学反应如下:①SiO2+2C=====Si(粗)+2CO↑②Si(粗)+2Cl2=====SiCl4③SiCl4+2H2=====Si(纯)+4HCl
关于上述反应的叙述不正确的是( ) A.①③是置换反应,②是化合反应B.高温下,焦炭与氢气的还原性均弱于硅C.任一反应中,每消耗或生成28 g硅,均转移4 ml电子D.高温下在炉子里将石英砂、焦炭、氯气、氢气按比例混合就能得到高纯硅
解析:在氧化还原反应中,还原剂的还原性比还原产物的还原性强,B错误;根据元素化合价的变化,每消耗或生成28 g(1 ml)硅,均转移4 ml电子,C正确;题中的三个反应是在三个不同的反应器中发生的,D错误。
5.矿泉水一般是由岩石风化后,被地下水溶解其中的可溶部分生成的,此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为2KAlSi3O8+2H2CO3+5H2O===2K++2HCO3-+4H2SiO3+Al2Si2O5(OH)4
(1) 将上述复杂硅酸盐改写成氧化物形式。①KAlSi3O8______________________________。②Al2Si2O5(OH)4______________________________。(2)上述反应能够发生的原因是___________________________________________。
2KAlSi3O8+2H2CO3+5H2O===2K++2HCO3-+4H2SiO3+Al2Si2O5(OH)4
K2O·Al2O3·6SiO2
Al2O3·2SiO2·2H2O
H2CO3的酸性比H2SiO3强
解析:(1)将硅酸盐化学式写成氧化物形式时,需将氧以外的元素写成同价态的氧化物,并按活动性顺序排列,用“·”将它们连接起来,各种元素原子个数比符合原来的组成。(2)此反应属于酸与盐发生的复分解反应,能发生的原因是酸性:H2CO3>H2SiO3。
演习篇
·
学业测试速达标
1.下列关于无机非金属材料的说法不正确的是( )A.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料B.新型无机非金属材料克服了传统无机非金属材料的缺点,具有极大强度C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
解析:新型无机非金属材料不但克服了传统无机非金属材料易碎、强度不够等缺点,并且具有特殊结构、特殊功能;新型无机非金属材料的主要成分并不一定是硅酸盐,如氮化硅陶瓷、碳化硅陶瓷等。
2.在①浓硝酸、②水、③盐酸、④氢氟酸、⑤氢氧化钾溶液中,常温时能与二氧化硅起化学反应的有( )A.①② B.②④ C.④⑤ D.③④
3.昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用二氧化硅和金属氧化物的形式可表示为( )A.CaO·MgO·SiO2·H2OB.2CaO·5MgO·8SiO2·H2OC.2CaO·MgO·SiO2·2H2OD.5CaO·2MgO·8SiO2·H2O
解析:根据昆仑玉的化学式,将Ca、Mg、Si、H分别写成氧化物的形式,按较活泼金属氧化物→较不活泼金属氧化物→SiO2→H2O的顺序排列,再调整各氧化物前的化学计量数并使其与昆仑玉化学式中一致,可得昆仑玉氧化物表示形式为2CaO·5MgO·8SiO2·H2O。
4.下列说法正确的是( )A.CO2+H2O+Na2SiO3===H2SiO3↓+Na2CO3,说明酸性:H2CO3>H2SiO3B.SiO2+Na2CO3=====Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3C.在复分解反应中必须是酸性强的生成酸性弱的D.已知酸性:H2CO3>HClO>HCO3-,则CO2+H2O+2NaClO===Na2CO3+2HClO
解析:由于H2CO3能与Na2SiO3反应生成H2SiO3,则说明H2CO3酸性大于H2SiO3,A正确;在B项中,由于在高温条件下反应,CO2为气体逸出,不能比较酸性强弱;在C项中,H2S+CuSO4===CuS↓+H2SO4,此反应为弱酸生成强酸;在D项中由于酸性:HClO>HCO3-,产物应为NaHCO3。
5.(双选)高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
下列说法正确的是( )A.步骤①的化学方程式为SiO2+2C ===== Si+2CO↑B.步骤①②③中每生成或反应1 ml Si,转移4 ml电子C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
解析:A项,产物为CO,正确;B项,第②、③步中转移2 ml电子,错误;C项,硅可与氢氟酸反应生成四氟化硅和氢气,错误;D项,根据物质的沸点不同可用蒸馏的方法进行分离,正确。
6.某研究性学习小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si;②Mg在点燃的条件下按质量比8∶5与SiO2反应生成一种白色固体化合物和另一种硅化物;③金属硅化物与稀硫酸反应生成硫酸盐与SiH4;④Si和SiO2均不能与稀H2SO4反应;⑤SiH4在空气中自燃。
他们的研究报告中记载着“……选用合适的物质在适合的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥,最后称量……用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期的63%左右。”请回答下列问题:(1) 该小组“实验室制Si”的化学反应方程式是____________________________________。(2) 写出②的反应方程式:_______________________________。
(3)该过程中产率比预期低的原因是_____________________________________________________________。(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是什么?请用必要的文字和化学方程式予以说明:_______________________________________________________________________________________。
部分硅与镁反应生成了硅化镁
SiH4能自燃,而有爆鸣声和火花就是由SiH4的自燃引起的,SiH4+2O2===SiO2+2H2O
解析:(1)碳可以在高温下还原SiO2制得Si。反应的化学方程式为2C+SiO2 ====== Si+2CO↑。(2)Mg与SiO2反应类似于Mg与CO2的反应,先生成MgO和Si,Si再和Mg反应生成Mg2Si,故可生成MgO和Mg2Si。
课时作业(七) 无机非金属材料
1.下列物质中,不含有硅酸盐的是( ) A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
解析:水玻璃是Na2SiO3的水溶液,黏土和普通水泥的主要成分都是硅酸盐,硅芯片的主要成分是硅单质。
2.下列说法错误的是( )A.二氧化硅是光导纤维的主要原料B.硅是信息技术的关键材料C.陶瓷餐具所用材料为硅酸盐D.水晶镜片所用原料为硅酸盐
解析:水晶、光导纤维的主要成分为SiO2。Si用于信息产业及太阳能电池。传统硅酸盐材料是陶瓷、水泥、玻璃。
3.下列有关硅及其化合物的说法正确的是( )A.陶瓷、玻璃、水泥容器都能贮存氢氟酸B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2D.由Na2CO3+SiO2=====CO2↑+Na2SiO3可知,硅酸的酸性强于碳酸
解析:陶瓷、玻璃、水泥的主要成分都是硅酸盐,其含有的SiO2能与氢氟酸反应,A项错误;硅酸钠是一种黏合剂,能将玻璃塞和瓶体粘在一起,不便于打开,B项错误;D项中的反应能发生是因为生成的CO2气体不断逸出,不能说明硅酸的酸性强于碳酸。
4.下列说法正确的是( )A.石英玻璃、玛瑙、水泥和餐桌上的瓷盘都是硅酸盐制品B.红宝石、珍珠、水晶、钻石等装饰品的主要成分都是硅酸盐C.氢氟酸能够雕刻玻璃D.硅酸具有酸的通性,能使石蕊溶液变红
解析:石英玻璃、玛瑙的成分是SiO2,不属于硅酸盐,A不正确;红宝石的主要成分为三氧化二铝、珍珠的主要成分为CaCO3、水晶的主要成分为SiO2、钻石为碳单质,均不属于硅酸盐,B不正确;氢氟酸能与玻璃的成分之一SiO2发生反应:4HF+SiO2===SiF4↑+2H2O,C正确;硅酸具有酸的通性,例如能与碱反应,但其难溶于水,不能使石蕊溶液变色,D错。
5.制取下列物质不需要用石灰石作原料的是( ) A.硅酸 B.水泥 C.玻璃 D.生石灰
解析:硅酸由可溶性硅酸盐与酸反应制得。
6.下列关于无机非金属材料的说法中,不正确的是( )A.高纯硅可用于制造半导体材料B.氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷C.氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面D.二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆
解析:光导纤维不具有导电性,D不正确。
7.下列关于SiO2和CO2的说法中,不正确的是( )A.CO2和SiO2都能与碱及碱性氧化物反应B.CO2和SiO2都能与水反应生成相应的酸C.CO2和SiO2都能与焦炭反应生成COD.SiO2可用于制光导纤维,干冰可用于人工降雨
解析:CO2能与水反应生成碳酸,但SiO2不能与水反应生成相应的酸,B错误。
8.二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行的判断,其中正确的是( )①SiO2+2NaOH===Na2SiO3+H2O ②SiO2+2C ===== Si+2CO↑ ③SiO2+4HF===SiF4↑+2H2O ④Na2CO3+SiO2======Na2SiO3+CO2↑
⑤SiO2+3C=======SiC+2CO↑a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃b.反应②中SiO2表现出氧化性c.反应③中SiO2表现了酸性氧化物的通性d.反应④符合用难挥发性的酸酐制取易挥发性的酸酐的道理e.反应⑤中SiO2未参加氧化还原反应 A.ace B.bde C.cde D.ab
解析:通常用氢氟酸来刻蚀玻璃,与之对应的反应是③,因此a、c判断错误;反应②是一个置换反应,其中二氧化硅被还原,表现出氧化性,b判断正确;反应④是一个复分解反应,用难挥发的二氧化硅制取易挥发的二氧化碳,d判断正确;反应⑤中碳的化合价由0价变为-4和+2价,硅的化合价和氧的化合价都没有改变,因此二氧化硅没有参加氧化还原反应,e判断也正确。
9.二氧化硅气凝胶是一种世界上最轻的固体,可以经受住1 kg炸药的爆炸威力。下列有关说法正确的是( )A.利用二氧化硅气凝胶能够开发导电材料B.激光照射二氧化硅气凝胶可产生丁达尔效应C.计算机芯片的主要成分是二氧化硅D.二氧化硅气凝胶能溶于水
解析:二氧化硅不导电,A错误;二氧化硅气凝胶属于胶体,能产生丁达尔效应,B正确;计算机芯片的主要成分是单晶硅,C错误;二氧化硅不溶于水,D错误。
10.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。(1)下列物质不属于硅酸盐的是________。A.陶瓷 B.玻璃C.水泥 D.生石灰
(2) SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_________________________________________,工艺师常用___________(填物质名称)来雕刻玻璃。
SiO2+2NaOH===Na2SiO3+H2O
(3) 用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作________。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。A.普通玻璃坩埚 B.石英玻璃坩埚C.氧化铝坩埚 D.铁坩埚
解析:(1)生石灰是CaO,为碱性氧化物且不含Si,不属于硅酸盐。(2) SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH===Na2SiO3+H2O。由于SiO2能溶于氢氟酸,因此工艺师常用氢氟酸来雕刻玻璃。
(3)Na2SiO3水溶液又称“水玻璃”,具有阻燃的功能,因此可用作防火剂。SiO2和Na2CO3在高温下反应生成Na2SiO3和CO2,故含SiO2的材料(普通玻璃、石英玻璃)以及Al2O3等都能与Na2CO3在高温下反应,故不能用以上材质的坩埚熔融纯碱。(4)该反应中C被氧化,SiO2中+4价的硅被还原,因此SiO2作氧化剂。
11.化学在生产生活和科学研究中具有重要的作用。下列说法正确的是( )①石英的主要成分是二氧化硅 ②三峡大坝使用了大量水泥,水泥是硅酸盐材料 ③太阳能电池的主要成分是硅,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,所以可用来制造电子部件和光学器件 ⑤水晶项链和餐桌上的瓷盘都是硅酸盐制品 A.①②③ B.②④⑤ C.③④⑤ D.①②③④
解析:石英的主要成分是二氧化硅;水泥属于传统硅酸盐产品;太阳能电池的主要成分是硅;水晶项链的主要成分是SiO2,餐桌上的瓷盘是硅酸盐制品;硅是半导体材料,可制造电子部件,二氧化硅光学性能优良,可制光学器件。综上所述,选A。
12.已知滑石粉的化学式为Mg3Si4O10(OH)2,色白、滑爽、柔软、耐火。下列有关说法不正确的是( )A.滑石粉属于无机硅酸盐类物质B.滑石粉组成可表示为3MgO·4SiO2·H2OC.爽身粉中添加滑石粉是利用它的滑爽、柔软、耐火性D.滑石粉可能会与氢氟酸、NaOH溶液发生反应
解析:硅酸盐是由硅、氧元素与其他元素组成的一类无机物的总称,故滑石粉属于无机硅酸盐类物质,A正确;可以将硅酸盐改写成氧化物的形式,B正确;爽身粉中添加滑石粉,主要是利用它的滑爽、柔软、干燥的特点,与耐火性无关,C错误;滑石粉中可能含有SiO2,可以与氢氟酸、NaOH溶液发生反应,D正确。
13.证明生石灰中既混有石英,又混有石灰石的正确方法是 ( )A.加入过量盐酸,观察是否有气泡冒出B.加入过量烧碱溶液,观察是否有固体溶解C.加热至高温,观察是否有气体冒出,是否有硅酸钙生成D.加入过量盐酸搅拌,观察是否有不溶物剩余及气泡出现
解析:SiO2不溶于除氢氟酸以外的任何酸,CaO、CaCO3均可溶于盐酸,且CaCO3溶于盐酸有气泡生成。
14.(双选)下列说法正确的是( )A.普通玻璃的主要成分可以表示为Na2O·CaO·6SiO2B.制玻璃的过程中发生反应Na2CO3+SiO2=====Na2SiO3+CO2↑,说明酸性H2SiO3>H2CO3C.水晶玻璃、普通玻璃均属于硅酸盐产品D.青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],用氧化物形式可表示为Al2O3·2SiO2·2H2O
解析:普通玻璃的主要成分可以表示为Na2O·CaO·6SiO2,A项正确;反应Na2CO3+SiO2=====Na2SiO3+CO2↑能发生是因为生成的CO2不断逸出,且该反应不是在溶液中发生的,不能作为判断碳酸和硅酸酸性强弱的依据,事实上碳酸的酸性强于硅酸的酸性,B项错误;水晶玻璃的主要成分是二氧化硅,不属于硅酸盐产品,C项错误。
15.(双选)下列说法正确的是( )A.硅胶作袋装食品的干燥剂的过程中没有发生化学变化B.酸性溶液中可能大量存在Na+、NH4+、SiO32-C.向Na2SiO3溶液中滴加稀盐酸的离子方程式:SiO32-+2H+===H2SiO3↓D.向Na2SiO3溶液中通入过量SO2的离子方程式:SiO32-+SO2+H2O===H2SiO3↓+SO32-
解析:B项,酸性条件下,SiO32-不能大量存在;D项,应生成HSO3-。
16.硅铝合金具有熔点低、凝固时收缩率小等优点,适合铸造。现取试样10.0 g,放在纯净氧气中完全燃烧,燃烧后的固体经称量发现比原来试样增重9.23 g,由此计算硅铝合金中硅的质量分数约为( ) A.12.3% B.15.4% C.13.4% D.17.0%
解析:铝、硅燃烧反应的化学方程式分别为4Al+3O2=====2Al2O3,Si+O2======SiO2。固体增重质量就是参加反应的氧气的质量。设Si的质量为x g,则Al的质量为(10-x) g,根据化学反应方程式知,铝消耗的氧气的质量为96(10-x) g÷108,硅消耗的氧气的质量为32x g÷28,96(10-x) g÷108+32x g÷28=9.23 g,解得x≈1.34,硅铝合金中硅的质量分数为1.34 g÷10.0 g×100%=13.4%。
17.A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:(1)组成A单质的元素的最高化合价为________。(2)B的化学式为________,B和碳反应生成A和E的化学方程式为_______________________________________________。
(3) C的化学式为___________,D的化学式为____________。
解析:由本题题眼“A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似”,推知A为硅;根据框图B+碳―→Si+E,B既能与氧化钙反应又能与氢氧化钠反应,推知B为二氧化硅,进一步推知C为硅酸钙,D为硅酸钠,E为一氧化碳。
18.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅。②粗硅与干燥的Cl2反应制得SiCl4:Si+2Cl2=====SiCl4。③SiCl4被过量的H2在1 000~1 100 ℃时还原制得纯硅。
某同学从资料中查知:SiCl4的熔点为-70 ℃,沸点为57.6 ℃,其在潮湿的空气中能与水发生反应而变质。该同学设计了以下制取纯硅的实验装置(热源及夹持装置略去)。
请回答下列问题:(1)为使SiCl4从装置B中逸出与氢气混合,应采取的措施是__________________________________。
(2)盛放稀硫酸的仪器名称为________,装置A中发生反应的离子方程式为__________________________________________。
Zn+2H+===Zn2++H2↑
(3)装置C能否采用普通玻璃管?________(选填“能”或“不能”),原因是_______________________________________。
在1 000~1 100 ℃时普通玻璃管会软化
(4) 已知SiCl4在潮湿的空气中能与水发生反应生成氯化氢,为防止空气污染,含有SiCl4的尾气要通入盛有___________溶液的烧杯中。
(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是_______________________________________________________________________________________________________。
在装置A与装置B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管)
解析:(1)SiCl4的沸点较低(57.6 ℃),欲使其逸出烧瓶与装置C中的H2反应,需对装置B进行水浴加热。(3)由于H2与SiCl4在1 000~1 100 ℃时反应制得纯硅,反应温度高,普通玻璃管在此温度下会软化,因此需要用石英管。(5)为了防止装置A中的水蒸气进入装置B中,应在装置A、B之间加一干燥装置。
相关课件
这是一份必修 第二册第三节 无机非金属材料评课课件ppt,共1页。
这是一份高中化学第五章 化工生产中的重要非金属元素第三节 无机非金属材料获奖ppt课件,文件包含新人教版必修2化学53《无机非金属材料》课件pptx、53无机非金属材料教案doc等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第三节 无机非金属材料优秀课件ppt,共29页。PPT课件主要包含了新课讲授,无机非金属材料,阅读P19页内容,新型无机非金属材料,硅和二氧化硅,新型陶瓷,碳纳米材料,半导体材料,硅的原子结构,思考交流等内容,欢迎下载使用。










