


还剩6页未读,
继续阅读
成套系列资料,整套一键下载
- 2.2.1 分子空间结构(课件PPT) 课件 3 次下载
- 2.2.2 杂化轨道理论(课件PPT) 课件 3 次下载
- 2.3 分子结构与物质的性质(课件PPT) 课件 1 次下载
- 人教版化学选修2 第二章第三节整理提升(课件PPT) 课件 1 次下载
- 人教版化学选修2 第二章复习提纲(课件PPT) 课件 1 次下载
人教版化学选修2 第二章第二节整理提升(课件PPT)
展开
这是一份人教版化学选修2 第二章第二节整理提升(课件PPT),共11页。
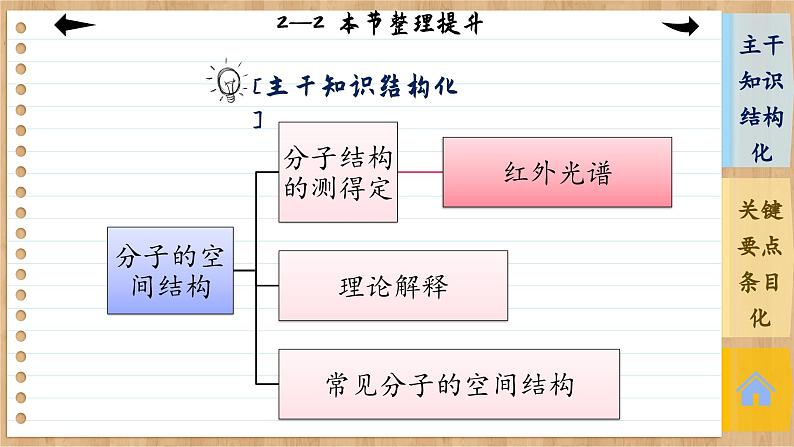
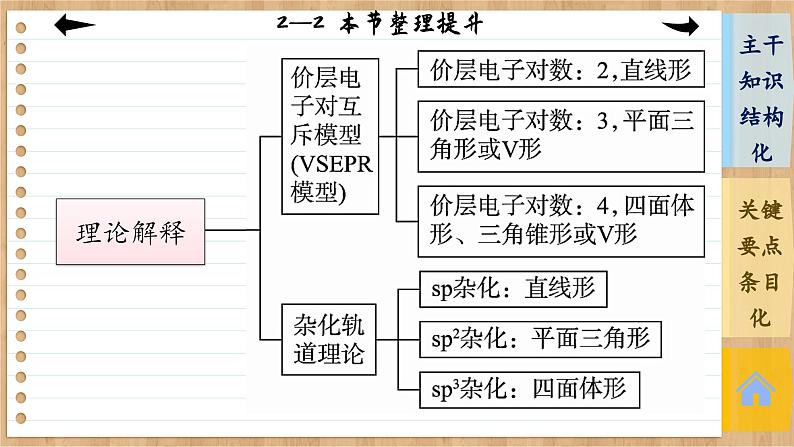
第二章 分子结构与性质 第二节 分子的空间结构 本节整理提升1.常见分子的空间结构:CO2呈直线形,H2O呈V形,HCHO呈平面三角形,NH3呈三角锥形,CH4呈正四面体形。 3.杂化轨道理论是为了解释分子的空间结构提出的一种价键理论。常见的杂化类型有sp杂化、sp2杂化、sp3杂化。4.sp杂化得到两个夹角为180°的直线形杂化轨道,sp2杂化得到三个夹角为120°的平面三角形杂化轨道,sp3杂化得到四个夹角为109°28′的四面体形杂化轨道。5.价层电子对数为2时,中心原子采用sp杂化,空间结构为直线形。6.价层电子对数为3时,中心原子采用sp2杂化,若孤电子对数为0,则为平面三角形,若孤电子对数为1,则为V形。7.价层电子对数为4时,中心原子采用sp3杂化,若孤电子对数为0,则为正四面体形,若孤电子对数为1,则为三角锥形,若孤电子对为2,则为V形。本课结束This lesson is overTHANKS!
第二章 分子结构与性质 第二节 分子的空间结构 本节整理提升1.常见分子的空间结构:CO2呈直线形,H2O呈V形,HCHO呈平面三角形,NH3呈三角锥形,CH4呈正四面体形。 3.杂化轨道理论是为了解释分子的空间结构提出的一种价键理论。常见的杂化类型有sp杂化、sp2杂化、sp3杂化。4.sp杂化得到两个夹角为180°的直线形杂化轨道,sp2杂化得到三个夹角为120°的平面三角形杂化轨道,sp3杂化得到四个夹角为109°28′的四面体形杂化轨道。5.价层电子对数为2时,中心原子采用sp杂化,空间结构为直线形。6.价层电子对数为3时,中心原子采用sp2杂化,若孤电子对数为0,则为平面三角形,若孤电子对数为1,则为V形。7.价层电子对数为4时,中心原子采用sp3杂化,若孤电子对数为0,则为正四面体形,若孤电子对数为1,则为三角锥形,若孤电子对为2,则为V形。本课结束This lesson is overTHANKS!
相关资料
更多









