




- 3.1 物质的聚集状态与晶体的常识(练习课件PPT) 课件 1 次下载
- 3.2.1 分子晶体(练习课件PPT) 课件 1 次下载
- 3.2.2 共价晶体(练习课件PPT) 课件 1 次下载
- 3.3.1 金属晶体、离子晶体(练习课件PPT) 课件 1 次下载
- 3.4 配合物与超分子(练习课件PPT) 课件 1 次下载
人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教案配套ppt课件
展开1.下列能说明石墨具有分子晶体的性质的是( )A.晶体能导电 B.熔点高C.硬度小 D.燃烧产物是CO2
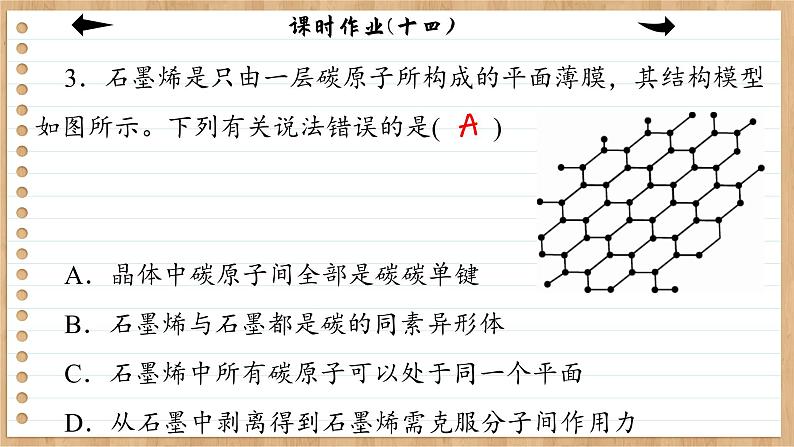
3.石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型如图所示。下列有关说法错误的是( ) A.晶体中碳原子间全部是碳碳单键B.石墨烯与石墨都是碳的同素异形体C.石墨烯中所有碳原子可以处于同一个平面D.从石墨中剥离得到石墨烯需克服分子间作用力
解析:C原子间除了碳碳单键外还有π键,故A错误;石墨烯和石墨是碳元素的不同单质,属于同素异形体,故B正确;石墨烯分子中所有原子处于同一平面,故C正确;石墨结构中,石墨层与层之间存在分子间作用力,所以从石墨中剥离得到石墨烯需克服石墨层与层之间的分子间作用力,故D正确。
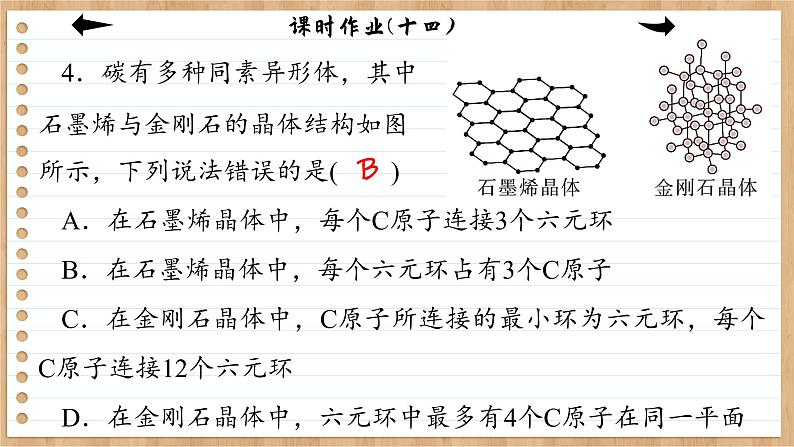
4.碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是( )A.在石墨烯晶体中,每个C原子连接3个六元环B.在石墨烯晶体中,每个六元环占有3个C原子C.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环D.在金刚石晶体中,六元环中最多有4个C原子在同一平面
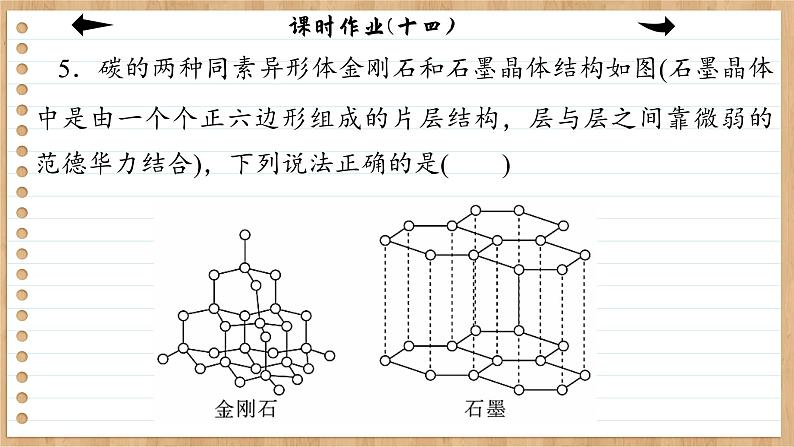
5.碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合),下列说法正确的是( )
A.根据:C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·ml-1,C(石墨,s)+O2(g)===CO2(g)ΔH=-393.5 kJ·ml-1,说明金刚石比石墨稳定,石墨转变为金刚石为放热反应B.相同质量的金刚石与石墨晶体中,所含共价键数相同C.估计金刚石与石墨的熔、沸点均较高,硬度均较大D.现代科技已经实现了石墨制取金刚石,该过程属于化学变化
解析:由石墨、金刚石燃烧的热化学方程式①C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·ml-1,②C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·ml-1,利用盖斯定律将①-②可得:C(石墨,s)===C(金刚石,s) ΔH=+1.91 kJ·ml-1,则由石墨制备金刚石是吸热反应,石墨的能量低于金刚石,所以石墨比金刚石更稳定,故A错误;金刚石中每个C原子与相邻的4个C成键,因此1 ml C形成2 ml共价键,石墨中每个C原子与相邻的3个C成键,1 ml C形成1.5 ml共价键,等质量时二者
含有的共价键数之比为4∶3,故B错误;石墨的硬度小,金刚石的硬度大,故C错误;石墨和金刚石是不同物质,两者之间的转化有新物质生成,是化学变化,故D正确。
6.C元素有多种同素异形体。而石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子。将氢气加入石墨烯中可得石墨烷。根据下列四图,以下描述合理的是( )
7.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( ) A.8 B.12 C.24 D.60
8.在理解概念的基础上,理清概念之间的相互关系,构建完整的知识体系是学习化学的重要方法,下图是中学化学常见的化学概念之间的相互关系。
(1)完成下表,且按以下要求填写实例。①只能由H、O、N、Si、S元素中的一种或几种元素组成物质;②每种元素只能出现一次;③所填物质必须能够回答问题(2)和问题(3)。
(NH4)2S或NH4HS
(2)取上述(1)表中A、B、C三种晶体实例中某一晶体溶解在水中得W溶液,写出等物质的量硫酸氢钠与W溶液反应的离子方程式_______________________________________________。(3)工业上制备(1)表中熔点最高的实例物质的化学方程式 ___________________________________________________。
H++S2-===HS-(或H++HS-===H2S↑)
解析:常见的晶体类型分别是离子晶体、分子晶体、共价晶体和金属晶体,由给定的元素组成实例时就需要考虑问题(2)和(3)的要求,几种元素中没有金属元素,则组成的离子晶体只能是铵盐,并且每种元素只能出现一次,故铵盐只能是(NH4)2S或NH4HS,不能是NH4NO3,共价晶体只能是Si,分子晶体是O2或O3,上述晶体中能溶于水的是(NH4)2S或NH4HS。上述实例中熔点最高的是晶体Si,工业上制取Si的方法是高温下用碳还原二氧化硅。
9.现有几组物质的熔点(℃)数据:
据此回答下列问题:(1)A组属于________晶体,其熔化时克服的微粒间作用力是__________。
(2)B组晶体共同的物理性质是__________(填序号)。 ①有金属光泽 ②易导电 ③易导热 ④有延展性(3)C组中HF的熔点反常是由于_________________________。(4)D组晶体可能具有的性质是________(填序号)。 ①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5) D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______________________________________________________________________________________________________________。
D组晶体都为离子晶体,且r(Na+)
10.碳材料产品丰富,应用广泛,让人感到“碳为观止”。下列有关说法正确的是( )
A.金刚石与石墨晶体类型完全相同B.石墨烯是一种有发展前途的导电材料C.碳纤维、合成纤维、光导纤维都属于高分子材料D.足球烯是由60个碳原子以碳碳单键构成的分子
解析:金刚石是共价晶体,石墨属于混合型晶体,A错误;石墨烯相当于单层石墨,石墨是一种优良的导体,因此石墨烯也可以导电,B正确;光导纤维的主要成分为SiO2,属于新型无机非金属材料,C错误;由题图中可以看出每个碳原子和另外3个碳原子相连,每个碳原子能形成4个共价键,因此足球烯不可能是由60个碳原子以碳碳单键构成的分子,D错误。
11.已知NaCl的摩尔质量为58.5 g·ml-1,其晶体密度为d g·cm-3,若图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )A.117a3d B.58.5/(2a3d)C.234/(a3d) D.58.5/(4a3d)
12.石墨是一种混合型晶体,具有多种晶体结构,其中一种晶胞的结构如图所示。回答下列问题:
(1)基态碳原子的轨道表示式为____________。(2)碳、氮、氧三种元素的第一电离能由大到小的顺序为________。(3)CH3-是有机反应中重要的中间体,其空间结构为____________。
(4)石墨晶体中碳原子的杂化方式为________,晶体中微粒间的作用力有________(填字母),石墨熔点高于金刚石是因为存在________(填字母)。A.离子键 B.共价键 C.π键 D.氢键 E.范德华力 (5)该晶胞中的碳原子有________种原子坐标;若该晶胞底面边长为a pm,高为c pm,则石墨晶体中碳碳键的键长为________ pm,密度为___________ g·cm-3(设阿伏加德罗常数的值为NA)。
(4)石墨晶体为平面层状结构,层内每个碳原子与周围三个碳原子形成共价键,键角为120°,则碳原子为sp2杂化。层内相邻碳原子间以共价键结合,未杂化的p轨道形成大π键,层间以范
德华力结合,故选BCE。金刚石中碳原子间以单键结合,而石墨中碳原子间还有大π键,使其键能增大,故石墨熔点高于金刚石。
13.(1)FeCl3的熔点为306 ℃,沸点为315 ℃,则FeCl3的晶体类型是____________。(2)C可与CO形成羰基配合物C2(CO)8,是有机合成的重要催化剂,不溶于水,溶于乙醇、乙醚、苯,熔点为51~52 ℃,在45 ℃(1.33 kPa)时升华。①C2(CO)8为________晶体。②C2(CO)8晶体中存在的作用力有____________________________________________________。
共价键、配位键、范德华力
(3)实验测得铝与氯元素形成化合物的实际组成为Al2Cl6,其球棍模型如图所示。已知Al2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[Al(OH)4]。①Al2Cl6属于________晶体,其中Al原子的杂化轨道类型为________。②[Al(OH)4]-中存在的化学键有_______________。
解析:(1)FeCl3的熔、沸点较低,属于分子晶体。(2)①羰基配合物C2(CO)8溶于有机溶剂,熔点低、能升华,应为分子晶体。 ②C2(CO)8是由C原子和CO形成的配合物,C原子提供空轨道,CO中C原子提供孤电子对,形成配位键;CO分子内存在共价键,C2(CO)8分子之间存在范德华力。
(3)①Al2Cl6在加热时易升华,说明其沸点较低,故Al2Cl6属于分子晶体。每个Al原子与周围4个Cl原子形成3个共价键和1个配位键,则Al原子价层电子对数为4,Al原子采取sp3杂化。②[Al(OH)4]-是Al(OH)3与OH-通过配位键形成的离子,故[Al(OH)4]-中存在的化学键有共价键、配位键。
人教版 (2019)选择性必修2第三节 金属晶体与离子晶体作业课件ppt: 这是一份人教版 (2019)选择性必修2第三节 金属晶体与离子晶体作业课件ppt,共25页。
人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体多媒体教学课件ppt: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体多媒体教学课件ppt,共51页。PPT课件主要包含了问题探讨等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体说课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体说课ppt课件,共14页。PPT课件主要包含了学习目标等内容,欢迎下载使用。













