













所属成套资源:2024年高考化学一轮复习课件(新人教新高考版)
2024年高考化学一轮复习(新高考版) 第5章 第22讲 硫及其氧化物
展开
这是一份2024年高考化学一轮复习(新高考版) 第5章 第22讲 硫及其氧化物,文件包含2024年高考化学一轮复习新高考版第5章第22讲硫及其氧化物pptx、2024年高考化学一轮复习新高考版第5章第22讲硫及其氧化物docx、第5章第22讲硫及其氧化物docx、第5章第22练硫及其氧化物docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1.了解硫的存在及其单质的性质和用途。2.掌握硫的氧化物的主要性质及应用。
考点一 硫单质的性质
考点二 二氧化硫和三氧化硫
真题演练 明确考向
思考 (1)硫有S2、S4、S6、S8等多种单质,它们的关系是什么?加热时,S8转化为S6、S4、S2属于什么变化?
提示 S2、S4、S6、S8属于同一元素的不同种单质,它们互为同素异形体,S8转化为S6、S4、S2属于化学变化。
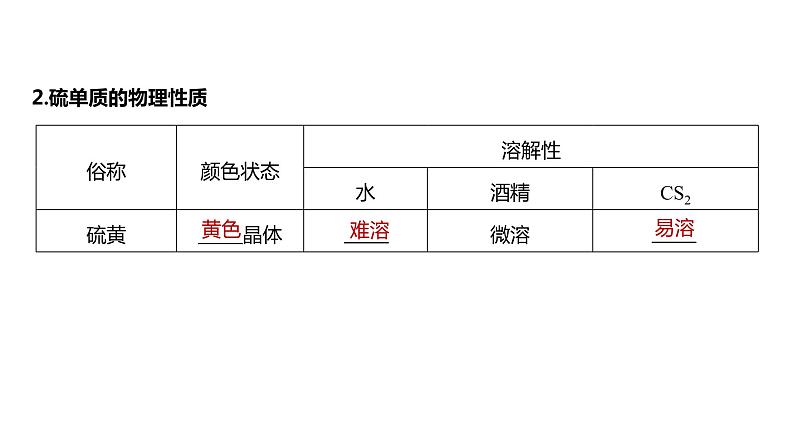
(2)硫单质难溶于水,易溶于CS2,其原因是什么?
提示 硫单质、CS2均属于非极性分子,而H2O属于极性分子,根据“相似相溶”规律,非极性分子易溶于非极性分子形成的溶剂中。
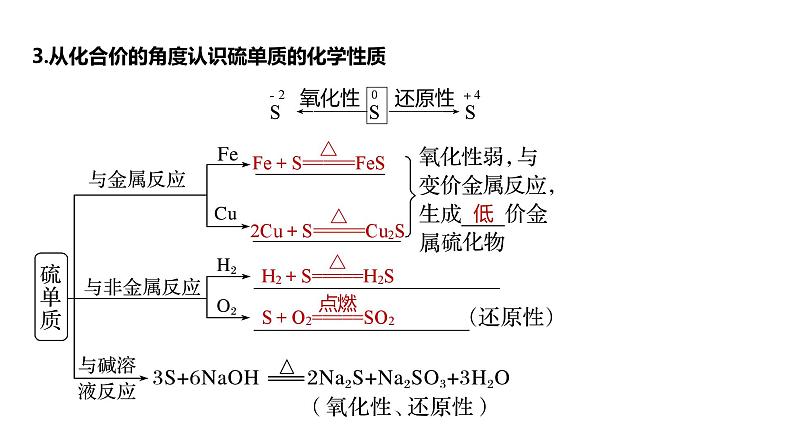
3.从化合价的角度认识硫单质的化学性质
1.硫在空气中燃烧的产物是SO2,在纯氧中燃烧的产物是SO3( )2.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物( )3.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同( )
1.在下列反应中硫元素只表现氧化性的是
A项,该反应中S的化合价由0价变为-2价,S只体现氧化性,正确;B项,该反应中S的化合价由0价、+6价变为+4价,S体现还原性和氧化性,错误;C项,该反应中S的化合价由-2价变为0价,S只体现还原性,错误;D项,该反应中S的化合价由0价变为-2价、+4价,S体现氧化性和还原性,错误。
2.加热装有硫粉的试管,硫粉很快熔化为液体,继而有淡黄色气体产生。将光亮细铜丝伸入气体中,铜丝发光发热且有黑色物质生成。由上述现象不能得出的结论是A.硫的熔、沸点较低B.硫晶体属于分子晶体C.铜丝能在硫蒸气中燃烧D.黑色固体是Cu2S
加热装有硫粉的试管,硫粉很快熔化为液体,继而有淡黄色气体产生,说明硫的熔、沸点较低,因此硫晶体属于分子晶体,A、B正确;将光亮细铜丝伸入气体中,铜丝发光发热且有黑色物质生成,说明发生了化学反应,则铜丝能在硫蒸气中燃烧,C正确;根据实验现象不能得出黑色固体是Cu2S,因为CuS也是黑色的,D错误。
1.二氧化硫(1)物理性质
按要求完成下列化学方程式:
与H2O反应:___________________与NaOH(足量)反应: ____________________________
氧化性:SO2+2H2S===3S+2H2O
与O2反应:_______________________与Cl2和H2O反应:_______________________________
漂白性:可使 溶液等有机色质褪色生成不稳定的无色物质
2NaOH+SO2===Na2SO3+H2O
Cl2+SO2+2H2O===2HCl+H2SO4
(3)实验室制法①固体Na2SO3与较浓H2SO4反应,化学方程式为______________________________________。②铜与浓H2SO4混合加热,化学方程式为_______________________________________。
Na2SO3+H2SO4===Na2SO4+SO2↑
2.三氧化硫(1)物理性质熔点:16.8 ℃,沸点:44.8 ℃,常温下为 态,标准状况下为 态。(2)化学性质三氧化硫具有酸性氧化物的通性,主要反应如下:
SO3+H2O===H2SO4
CaO+SO3===CaSO4
SO3+Ca(OH)2===CaSO4+H2O
1.标准状况下,2.24 L SO3中含有硫原子数为NA( )2.将SO2通入紫色石蕊溶液中,紫色石蕊溶液先变红后褪色( )3.SO2使滴有酚酞的NaOH溶液褪色,体现了SO2的漂白性( )4.SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好( )5.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同( )
1.将SO2气体分别通入下列五种溶液中:
一、SO2化学性质的多重性
回答下列问题:(1)试管①中的实验现象:酸性KMnO4溶液________,证明SO2具有_______性。(2)试管②中的实验现象:品红溶液________,证明SO2具有_______性。
(3)试管③中能否观察到沉淀______(填“能”或“否”)。(4)试管④中能产生白色沉淀,该沉淀是_______(填化学式,下同)。(5)试管⑤中能产生白色沉淀,该沉淀是________,用离子方程式表示产生沉淀的过程:________________________________________________。
2.探究SO2还原Fe3+、I2可使用的药品和装置如图所示。
(1)实验室常用亚硫酸钠与70%硫酸加热制备二氧化硫,写出该反应的化学方程式:_______________________________________。(2)B中可观察到的现象是_______________________。(3)C的作用是____________________________。(4)设计实验检验A中SO2与Fe3+反应所得还原产物: _____________________________________________________________________________________________。
吸收SO2尾气,防止污染空气
取少量实验后的A中溶液于
试管中,加入铁氰化钾溶液,若生成蓝色沉淀,说明反应所得还原产物为Fe2+
3.下图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题:
(1)B中加入的试剂是___________,作用是__________。(2)C中加入的试剂是________________,作用是____________________________。(3)D中加入的试剂是____________,作用是__________。(4)实验时,C中应观察到的现象是_______________________________________。
除去SO2并检验SO2是否除尽
酸性KMnO4溶液的颜色变浅但不褪成无色
检验二氧化硫用品红溶液,吸收二氧化硫用酸性KMnO4溶液,检验二氧化碳用澄清石灰水;在检验二氧化碳之前,必须除尽二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊。C装置的作用是除去SO2并检验SO2是否除尽,所以酸性高锰酸钾溶液颜色变浅,但不能褪成无色,若褪成无色则不能证明二氧化硫已除尽。
检验SO2和CO2同时存在的一般流程
注意 有时为简化装置,可将除去SO2和检验SO2是否除尽合并为一个装置,用较浓的酸性KMnO4溶液,现象是酸性KMnO4溶液颜色变浅,但不褪成无色。
1.正误判断,正确的打“√”,错误的打“×”。(1)向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,通过观察溶液颜色变化,来探究SO2具有漂白性(2022·江苏,11B)( )(2)SO2可漂白纸浆,不可用于杀菌、消毒(2021·湖南,2C)( )(3)可用澄清石灰水检验SO2气体(2020·天津,6B)( )
2.(2022·江苏,4)实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
A.用装置甲制取SO2气体B.用装置乙制取SO2水溶液C.用装置丙吸收尾气中的SO2D.用干燥pH试纸检验SO2水溶液的酸性
60%硫酸和NaHSO3(s)可发生反应:H2SO4+2NaHSO3===Na2SO4+2SO2↑+2H2O,因此装置甲可以制取SO2气体,A正确;气体通入液体时“长进短出”,装置乙可以制取SO2水溶液,B正确;SO2不与饱和NaHSO3溶液发生反应,因此装置丙不能吸收尾气中的SO2,C错误;SO2水溶液显酸性,可用干燥的pH试纸检验其酸性,D正确。
3.(2021·山东,8)工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是
A.吸收过程中有气体生成B.结晶后母液中含有NaHCO3C.气流干燥湿料时温度不宜过高D.中和后溶液中含Na2SO3和NaHCO3
根据流程图分析可知,吸收过程中有二氧化碳生成,A正确;结晶后母液中含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,没有NaHCO3,假设产物中存在NaHCO3,则其会与生成的NaHSO3发生反应,且NaHCO3溶解度较低,若其残留于母液中,会使晶体不纯,假设不成立,B错误;NaHSO3高温时易分解变质,所以气流干燥过程中温度不宜过高,C正确;结合上述分析可知,中和后溶液中含Na2SO3和NaHCO3,D正确。
4.(2018·浙江11月选考,28)某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
(1)下列说法正确的是________(填字母)。A.反应后,将试管Ⅰ中的白色固体加入水中, 溶液呈蓝色B.取下试管Ⅲ并不断振荡,试管中出现浑浊, 是因为生成了BaSO4C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性D.试管Ⅴ中的NaOH溶液可用Na2CO3溶液代替
根据装置图可以判断,Ⅰ生成SO2,Ⅱ验证SO2,Ⅲ验证SO2是否和BaCl2反应,Ⅳ验证SO2的还原性,Ⅴ吸收剩余的SO2,防止污染。A项,白色固体应为CuSO4,加水,溶液呈蓝色;B项,由于在Ⅲ中生成了H2SO3,H2SO3很容易被O2氧化生成H2SO4,所以生成BaSO4沉淀;D项,由于Na2CO3水解呈碱性,所以也可以吸收SO2气体。
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因________________________________________________________________________________________________________________。
SO2遇品红生成不稳定无色物质,受热释放SO2,溶液恢复红色;温度降低,SO2在品红溶液中溶解度增大,溶液颜色变浅
1.下列关于硫的说法不正确的是A.游离态的硫存在于火山口附近或地壳的岩层里B.单质硫既有氧化性,又有还原性C.试管内壁附着的硫可用二硫化碳溶解除去D.硫与铁、铜反应,生成FeS、CuS
2.下列关于硫的叙述正确的是A.硫的非金属性较强,在自然界中只以化合态存在B.可用水溶解过滤分离硝酸钾和硫黄的混合物C.硫与金属或非金属反应时都做氧化剂D.硫的氧化性比氯气强
硫的非金属性虽然较强,但在自然界中的存在形态既有化合态又有游离态,故A错误;硝酸钾易溶于水,而硫难溶于水,所以可用水溶解过滤分离硝酸钾和硫黄的混合物,故B正确;硫与金属反应时做氧化剂,与非金属反应时既可做氧化剂,也可做还原剂,故C错误;硫的非金属性比氯弱,所以硫的氧化性比氯气弱,故D错误。
3.下列关于硫及其化合物的叙述正确的是A.硫黄是一种易溶于水的黄色晶体B.二氧化硫的水溶液显酸性C.二氧化硫是黄色易溶于水的有毒气体D.二氧化硫不稳定,极易转化为三氧化硫
4.下列说法错误的是A.残留在试管内壁上的硫可用热的NaOH溶液除去B.硫单质与变价金属反应时一般生成低价态的金属硫化物C.汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理D.单质硫或含硫物质燃烧时,氧气少量时生成SO2,氧气足量时生成SO3
硫在氧气中燃烧只生成SO2,D项错误。
5.我国晋代《抱朴子》中描述了“丹砂(HgS)烧之成水银,积变又还成丹砂”。下列有关叙述正确的是A.“丹砂”和“水银”都是化合物B.该描述中的反应是可逆反应C.水银有恒定的体积膨胀系数,被用于制作温度计D.“积变又还成丹砂”中的“还”可理解为“被还原”
水银(Hg)是单质,A错误;“丹砂(HgS)烧之成水银,积变又还成丹砂”,前者需要加热,后者常温下反应,不是同一条件,故不是可逆反应,B错误;体积膨胀系数是表征物体热膨胀性质的物理量,水银有恒定的体积膨胀系数,受热时体积变化均匀,可用于制作温度计,C正确;“积变又还成丹砂”发生的反应是Hg+S===HgS,Hg发生了氧化反应,D错误。
6.如图是硫元素在自然界中的循环示意图,下列说法不正确的是
A.海水中的硫元素主要以S2-形式存在B.煤中含有硫元素,燃煤中加入生石灰可脱硫C.硫具有弱氧化性,和变价金属反应,通常将 金属氧化成低价态D.硫化氢溶于水得到氢硫酸,氢硫酸是弱酸, 能与碱、碱性氧化物反应
7.食品、大气、工业尾气中的SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称 重以测定大气中SO2的浓度C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循 环使用D.石灰石—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用 于生产石膏
A项,葡萄酒中的乙醇能被酸性高锰酸钾溶液氧化,对SO2的检测有干扰;B项,大气中的CO2能与Ba(OH)2溶液形成沉淀,对SO2的检测有干扰,部分BaSO3也会被空气中的O2氧化;C项,氨水吸收SO2生成(NH4)2SO3或NH4HSO3,(NH4)2SO3或NH4HSO3与硫酸反应能产生SO2,SO2可以循环使用;D项,石灰石吸收SO2需要在高温下才能进行。
8.SO2属于大气污染物,可用H2与SO2在加热条件下反应消除SO2的污染,其反应原理可分为两步,过程如图所示。
下列说法正确的是A.SO2排放到空气中会形成pH≈5.6的酸雨B.可用CuSO4溶液检验是否有气体X生成C.在100~200 ℃时发生的是置换反应D.工业上可用浓硝酸处理尾气中的SO2
酸雨的pHB>CD.加氧化亚铁可以使溶液C转化为溶液A
SO2与Fe3+发生氧化还原反应生成Fe2+,若二氧化硫足量,则溶液中无Fe3+,加入KSCN溶液,溶液不变红色;若二氧化硫不足,则溶液中有Fe3+,加入KSCN溶液,溶液变红色,A正确;离子方程式中电荷不守恒,B错误;溶液A转化为溶液B后溶液酸性增强,C错误;FeO与H+反应生成Fe2+,故溶液C不能转化为溶液A,D错误。
12.利用如图所示装置测定空气中SO2的含量,A溶液最好选用
A.NaOH溶液(滴有2~3滴酚酞溶液)B.KMnO4溶液(滴有一定量硫酸溶液)C.HNO3溶液[滴有2~3滴Ba(NO3)2溶液]D.I2溶液(滴有2~3滴淀粉溶液)
空气中含有二氧化碳,NaOH溶液也能吸收二氧化碳,会影响二氧化硫含量的测定,故A错误;空气的成分复杂,含有较多的还原性物质,其也可能被强氧化剂KMnO4氧化,影响二氧化硫含量的测定,故B错误;二氧化硫被强氧化剂HNO3氧化生成硫酸根离子,硫酸根离子和钡离子结合生成硫酸钡白色沉淀,但不能判断反应终点,故C错误;二氧化硫能够被弱氧化剂I2氧化,可以通过溶液蓝色褪去时通入空气的量和消耗I2的量测定空气中二氧化硫的含量,故D正确。
13.葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性: >I->Cl-)。
下列说法不正确的是A.若试剂A选择氯水,则试剂B可选择NaOH标准液B.通入N2和煮沸的目的是将产生的气体从溶液中全部赶出C.葡萄酒中加亚硫酸盐的主要目的是防止葡萄酒氧化,利用了亚硫酸盐的还原性D.若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
二氧化硫具有还原性,可以被氯水氧化为硫酸,但是氯水也可以和氢氧化钠反应,所以试剂B不能选择NaOH标准液,A错误;若试剂A选择碱液,可以和二氧化硫反应得到亚硫酸盐或亚硫酸氢盐,该盐可以被碘单质氧化为硫酸盐,试剂B可选择I2标准液,D正确。
14.某研究性学习小组在学习SO2 的性质时,通过查阅文献、理性分析、实验验证与CO2 的性质进行了比较。试根据研究主题和过程,回答下列问题。(1)水溶液的酸性查阅文献知: 常温下,H2SO3 的电离常数Ka1 =1.2×10-2 ,Ka2=6.3×10-3 ,H2CO3的电离常数 Ka1=4.4×10-7 ,Ka2 =4.7×10-11 。选用下面的药品和装置验证 H2SO3 和H2CO3 的酸性强弱,其连接顺序:A→_____________(按气流方向用大写字母表示即可)。D装置的主要作用是_______________________________________。
验证B装置中反应后的产物中是否含有SO2
A中盐酸和亚硫酸钠反应制取二氧化硫,用饱和NaHSO3溶液除去二氧化硫中的氯化氢气体,把二氧化硫通入NaHCO3溶液制取二氧化碳,用品红溶液检验二氧化碳中是否含有SO2,再把二氧化碳气体通入澄清石灰水中检验,可验证 H2SO3 和H2CO3 的酸性强弱,其连接顺序:A→C→B→D→E。D装置的主要作用是验证B装置中反应后的产物中是否含有SO2。
(2)二氧化硫的还原性若按图示装置进行实验(部分固定装置未画出)。请你在实验前根据预设的操作,推测可能的实验现象及其对应的原因。
SO2+Na2O2===Na2SO4
15.碳、硫的含量对钢铁性能影响很大,其含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。实验流程如图:
(1)煅烧装置中采用纯氧,目的是_________________________________________。气体a的主要成分有______、CO2和未反应的O2。
避免引入空气中的杂质,同时使煅烧更充分
(2)为充分吸收气体a,下列吸收装置合适的是________(填字母)。
为了防倒吸和安全起见,选择C或D装置。
(3)气体a被H2O2溶液吸收转化为硫酸(溶液b),用已知浓度的NaOH溶液滴定生成的溶液b,根据消耗NaOH溶液的体积可确定钢样中硫的质量分数。①滴定时NaOH溶液置于____________(填仪器名称)中,若以酚酞为指示剂,滴定终点时的现象为_____________________________________________________________。
滴入最后半滴NaOH溶液后,溶液由无色变为浅红色并保持30 s不褪色
NaOH溶液应置于碱式滴定管中,酚酞遇碱变红,当达到滴定终点时,硫酸被消耗完,故滴定终点的现象为滴入最后半滴NaOH溶液后,溶液由无色变为浅红色并保持30 s不褪色。
②若称取1 g钢样进行实验,滴定消耗0.01 ml·L-1 NaOH溶液2.0 mL,则该钢样中硫的质量分数为________。
(4)将气体a通入测碳装置中(如图),采用重量法测定碳的含量。
①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是________。
MnO2和K2Cr2O7都是强氧化剂,由此可知该法利用了SO2的还原性。
相关课件
这是一份第20讲 硫及其氧化物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共32页。PPT课件主要包含了目标导航,硫单质的性质,考点一,必备知识,易错辨析,专项突破,二氧化硫和三氧化硫,考点二,归纳提升,真题演练等内容,欢迎下载使用。
这是一份2024年高考化学一轮复习课件(鲁科版)第4章 第22讲 氮及其氧化物 硝酸,文件包含第4章第22讲氮及其氧化物硝酸pptx、第4章第22练氮及其氧化物硝酸docx、第4章第22讲氮及其氧化物硝酸docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2024年高考化学一轮复习课件(鲁科版)第4章 第19讲 硫及其氧化物,文件包含第4章第19讲硫及其氧化物pptx、第4章第19练硫及其氧化物docx、第4章第19讲硫及其氧化物docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。









