










2024年高考化学一轮复习(新高考版) 第9章 第53讲 酸碱中和滴定及拓展应用
展开1.了解酸碱中和滴定的原理和滴定终点的判断方法,知道指示剂选择的方法。2.掌握酸碱中和滴定的操作和数据处理误差分析的方法。3.掌握滴定法在定量测定中的应用。
考点一 酸碱中和滴定的原理与操作
考点二 氧化还原滴定
答题规范(6) 滴定终点判断
真题演练 明确考向
酸碱中和滴定的原理与操作
1.原理利用酸碱中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。以标准HCl溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=______________。
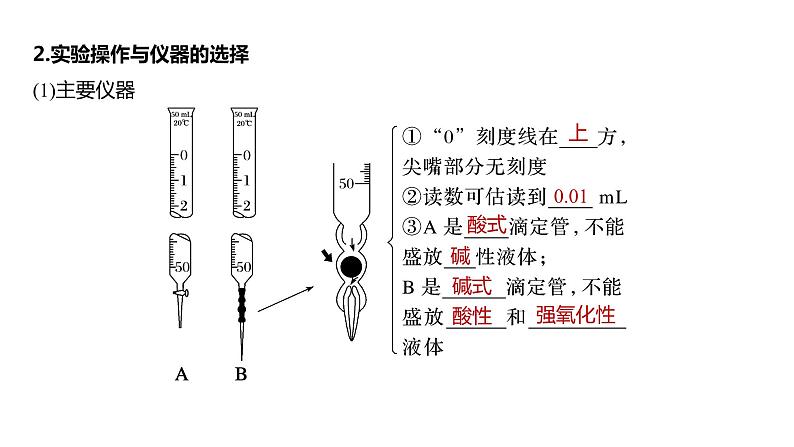
2.实验操作与仪器的选择(1)主要仪器
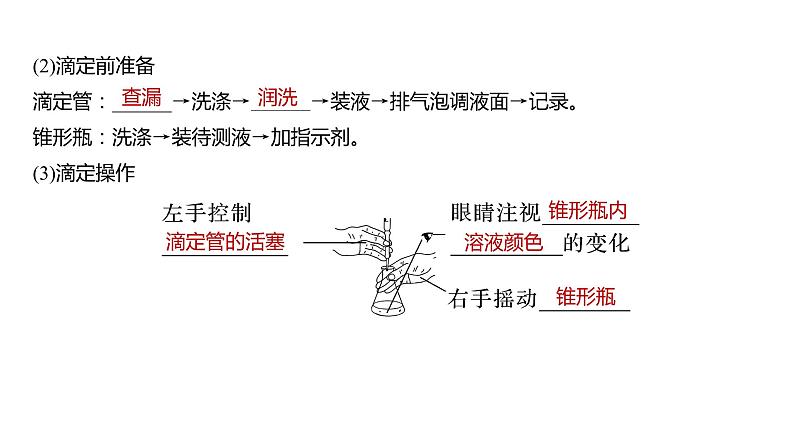
(2)滴定前准备滴定管:______→洗涤→______→装液→排气泡调液面→记录。锥形瓶:洗涤→装待测液→加指示剂。(3)滴定操作
(4)滴定终点滴入最后半滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,停止滴定,并记录标准溶液的体积。(5)数据处理按上述操作重复_______次,根据每次所用标准液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的________。
3.关键(1)准确测定参加反应的酸、碱溶液的______。(2)选取适当的指示剂,准确判断__________。熟记:常见酸碱指示剂的变色范围
4.滴定曲线以0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1盐酸为例
若VA偏大⇒cB_______;若VA偏小⇒cB_______。
1.将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL( )2.滴定终点就是酸碱恰好中和的点( )3.滴定管和锥形瓶在滴定前都应该用待装溶液润洗( )4.酸碱指示剂越多变色越明显,指示剂至少加入2~3 mL ( )
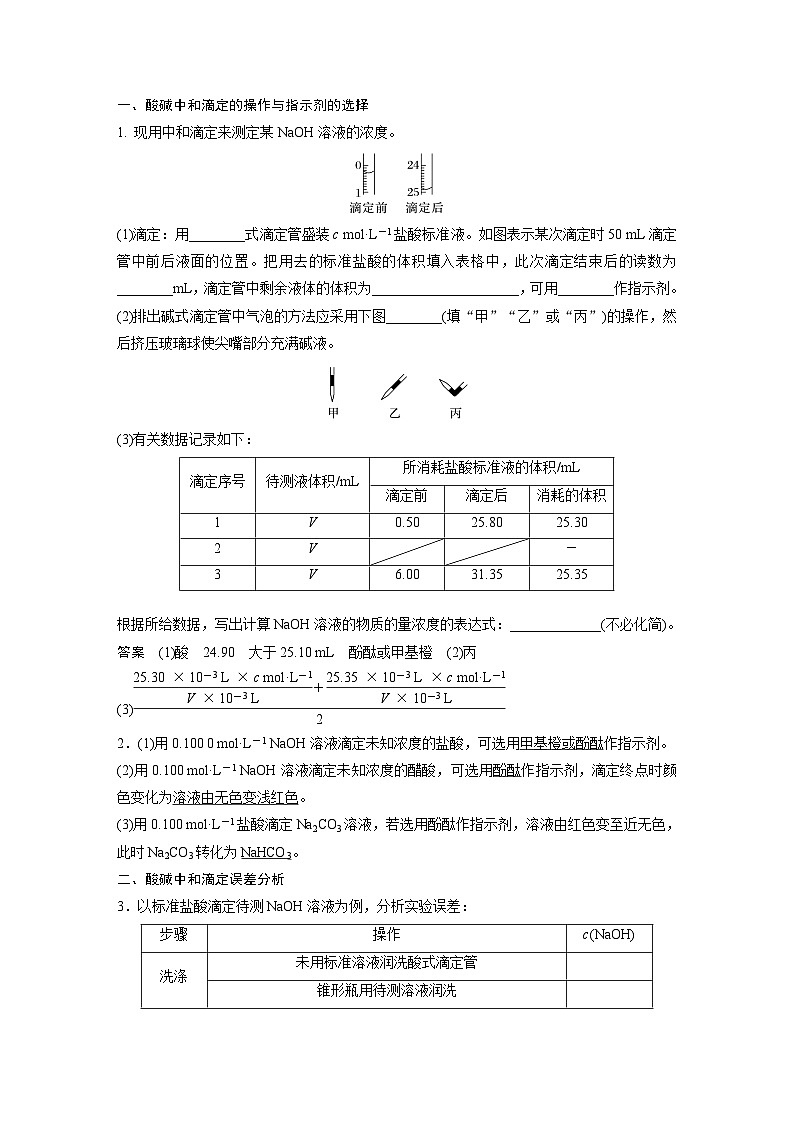
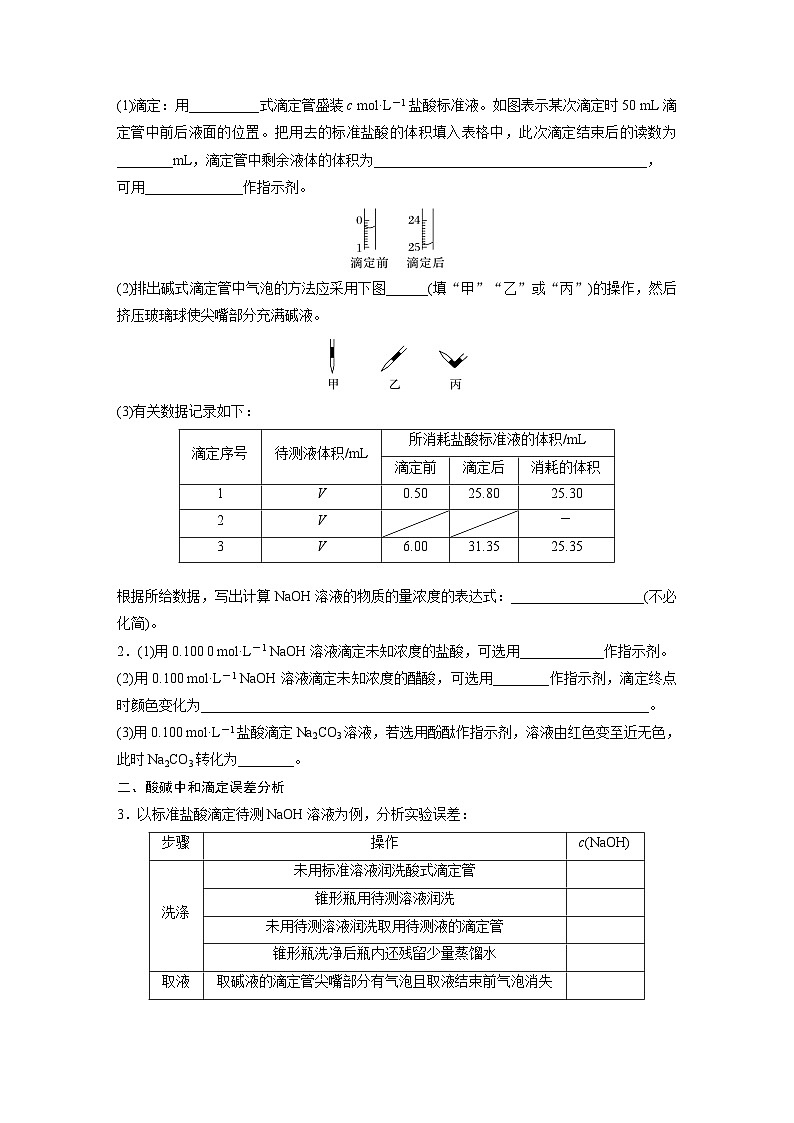
一、酸碱中和滴定的操作与指示剂的选择1.现用中和滴定来测定某NaOH溶液的浓度。(1)滴定:用____式滴定管盛装c ml·L-1盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。把用去的标准盐酸的体积填入表格中,此次滴定结束后的读数为________mL,滴定管中剩余液体的体积为_____________,可用______________作指示剂。(2)排出碱式滴定管中气泡的方法应采用下图_____(填“甲”“乙”或“丙”)的操作,然后挤压玻璃球使尖嘴部分充满碱液。
(3)有关数据记录如下:
根据所给数据,写出计算NaOH溶液的物质的量浓度的表达式:_________________________________________________(不必化简)。
2.(1)用0.100 0 ml·L-1 NaOH溶液滴定未知浓度的盐酸,可选用______________作指示剂。(2)用0.100 ml·L-1 NaOH溶液滴定未知浓度的醋酸,可选用______作指示剂,滴定终点时颜色变化为____________________。(3)用0.100 ml·L-1盐酸滴定Na2CO3溶液,若选用酚酞作指示剂,溶液由红色变至近无色,此时Na2CO3转化为__________。
二、酸碱中和滴定误差分析3.以标准盐酸滴定待测NaOH溶液为例,分析实验误差:
三、滴定曲线的分析4.室温条件下,将0.1 ml·L-1的NaOH溶液逐滴滴入10 mL 0.1 ml·L-1HB溶液中,所得溶液pH随NaOH溶液体积的变化如图。下列说法正确的是A.Ka(HB)的数量级为10-4B.该中和滴定可采用酚酞作为指示剂C.V1=10D.b点时,NaOH与HB恰好完全反应
V1时混合溶液恰好为中性,由于NaB为强碱弱酸盐,故此时酸有剩余,V1<10,C错误;c点时,NaOH与HB恰好完全反应,D错误。
5.一元酸HX和HY都是20 mL,分别用0.1 ml·L-1 NaOH溶液滴定,滴定曲线如图,下列说法正确的是A.用0.1 ml·L-1 NaOH溶液滴定HX时, 选用甲基橙作指示剂,测定结果偏低B.HX可能是HCl,HY可能是CH3COOHC.HX和HY的物质的量浓度可能都为1 ml·L-1D.a点和b点对应溶液的导电性相同
NaOH溶液滴定HX,恰好完全反应时溶液显碱性,甲基橙在酸性时就变色,故NaOH消耗量会减小,测定结果偏低,故A正确;0.1 ml·L-1 NaOH与20 mL酸恰好反应时消耗的碱的体积为20.00 mL,所以酸的浓度都是0.1 ml·L-1,根据图像纵坐标可知,HX为弱酸,HY为强酸,故B、C错误;a点对应溶质是NaX和HX,HX为弱电解质;b点对应溶质是NaY和HY,HY是强电解质,虽然各物质的浓度都相同,但是溶液中离子浓度不相同,故导电性不同,故D错误。
1.原理以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定本身并没有还原性或氧化性但能与某些还原剂或氧化剂反应的物质。2.试剂(1)常见用于滴定的氧化剂:KMnO4、K2Cr2O7、I2等。(2)常见用于滴定的还原剂:亚铁盐、草酸、维生素C等。3.指示剂(1)氧化还原指示剂。(2)专用指示剂,如淀粉可用作碘量法的指示剂。(3)自身指示剂,如KMnO4溶液可自身指示滴定终点。
一、直接滴定型1.为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.020 0 ml·L-1 KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。(1)滴定过程中发生反应的离子方程式是______________________________________________;测得该样品中NaNO2的质量分数为________。
根据得失电子守恒,5NaNO2 ~ 2KMnO45 ml 2 ml0.010 0×10-3V×4×5 0.020 0×10-3V×4
(2)若滴定过程中刚出现颜色变化就停止滴定,则测定结果________(填“偏大”“偏小”或“无影响”)。
若滴定过程中刚出现颜色变化就停止滴定,则KMnO4的用量偏少,测定结果偏小。
二、连续反应型2.(2022·上海金山区二模)称取0.500 g CuCl成品置于过量FeCl3(aq)中,待固体完全溶解后,用0.200 0 ml·L-1的Ce(SO4)2标准液滴定至终点,消耗Ce(SO4)2标准液24.60 mL。相关反应如下:Fe3++CuCl===Fe2++Cu2++Cl-;Ce4++Fe2+===Fe3++Ce3+。则CuCl的质量分数是________(保留四位有效数字),若滴定操作耗时过长可能会使测定的CuCl质量分数________(填“偏大”或“偏小”)。
三、试剂过量型3.烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。
回答下列问题:(1)滴定过程中发生下列反应:
则气样中NOx折合成NO2的含量为____________________ mg·m-3。
(2)若FeSO4标准溶液部分变质,会使测定结果________(填“偏高”“偏低”或“无影响”)。
当滴入最后半滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。解答此类题目注意三个关键点:(1)最后半滴:必须说明是滴入“最后半滴”溶液。(2)颜色变化:必须说明滴入“最后半滴”溶液后溶液“颜色的变化”。(3)半分钟:必须说明溶液颜色变化后“半分钟内不再恢复原来的颜色”。
(1)用a ml·L-1的盐酸滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是________________________________________________________________;若用甲基橙作指示剂,滴定终点现象是____________________________________________________________________。(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用_________作指示剂,达到滴定终点的现象是________________________________________________________________。
当滴入最后半滴标准液后,溶液由红色变为无色,且半分钟内不恢复红色
当滴入最后半滴标准液后,溶液由黄色变
为橙色,且半分钟内不恢复黄色
当滴入最后半滴标准液后,溶液由无色变为蓝
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂______(填“是”或“否”),达到滴定终点的现象是__________________________________________________________________________。(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为_________________________,达到滴定终点的现象是_________________________________________________________。(5)用标准KI溶液滴定含有Fe3+的溶液,应选用___________作指示剂,滴定终点现象是__________________________________________________________________。
酸性KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色
Ti3++Fe3+===Ti4++Fe2+
当滴入最后半滴标准液后,溶液变成红色,且半分钟内不褪色
当滴入最后半滴标准KI溶液后,溶液的红色褪去,且半分钟内不恢复红色
1.(2021·广东,7)测定浓硫酸试剂中H2SO4含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00 mL待测液,用0.100 0 ml·L-1的NaOH溶液滴定。上述操作中,不需要用到的仪器为
实验过程中,①量取一定量的浓硫酸并稀释,所需仪器为量筒、烧杯、玻璃棒;②转移定容得待测液,所需仪器为烧杯、玻璃棒、容量瓶、胶头滴管;③移取20.00 mL待测液,用0.100 0 ml·L-1的NaOH溶液滴定,所需仪器为酸式滴定管、碱式滴定管、锥形瓶。选项中A为容量瓶,B为分液漏斗,C为锥形瓶,D为碱式滴定管,上述操作中,不需要用到的仪器为分液漏斗。
2.正误判断,正确的打“√”,错误的打“×”。(1)可用“图1”测定醋酸浓度(2021·河北,3A)( )(2)可用“图2”量取一定体积的KMnO4溶液(2021·天津,6B)( )(3)碱式滴定管排气泡的操作如“图3”(2022·湖南,4A)( )(4)用标准液润洗滴定管后,应将润洗液从滴定管上口倒出(2022·浙江6月选考,11A)( )
3.(2022·浙江6月选考,23)25 ℃时,向20 mL浓度均为0.1 ml·L-1的盐酸和醋酸的混合溶液中逐滴加入0.1 ml·L-1的NaOH溶液(醋酸的Ka=1.8×10-5;用0.1 ml·L-1的NaOH溶液滴定20 mL等浓度的盐酸,滴定终点的pH突跃范围4.3~9.7)。下列说法不正确的是A.恰好中和时,溶液呈碱性B.滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式为H++OH-===H2OC.滴定过程中,c(Cl-)=c(CH3COO-)+c(CH3COOH)D.pH=7时,c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
恰好中和时,生成氯化钠溶液和醋酸钠溶液,其中醋酸根离子会水解,溶液显碱性,A正确;
滴定前盐酸和醋酸的浓度相同,故滴定过程中,氯离子浓度等于醋酸分子的浓度和醋酸根离子的浓度和,C正确;
向20 mL浓度均为0.1 ml·L-1的盐酸和醋酸的混合溶液中逐滴加入0.1 ml·L-1的NaOH溶液,当NaOH溶液的体积为20 mL时,溶液为氯化钠和醋酸的混合溶液,显酸性,需要再滴加适量的氢氧化钠,故c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH),D正确。
4.[2022·江苏,16(4)]实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用准确浓度的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为Fe2++Ce4+===Fe3++Ce3+。请补充完整实验方案:①准确量取25.00 mL Ce3+溶液[c(Ce3+)约为0.2 ml·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将0.020 00 ml·L-1(NH4)2Fe(SO4)2和待测Ce4+溶液装入如图所示的滴定管中:③______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
从左侧滴定管中放出一定体积的待测Ce4+溶液,加入指示剂苯代邻氨基苯
甲酸,用0.020 00 ml·L-1(NH4)2Fe(SO4)2溶液来滴定,当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,且半分钟内不变色,即达到滴定终点,重复上述操作2~3次,记录标准液的体积
5.[2022·辽宁,17(7)]测定氢醌法制取H2O2样品含量的方法如下:取2.50 g产品,加蒸馏水定容至100 mL摇匀,取20.00 mL于锥形瓶中,用0.050 0 ml·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。
1.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作正确的是A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸B.锥形瓶用蒸馏水洗净,必须干燥后才能加入一定体积未知浓度的NaOH溶液C.滴定时没有排出滴定管中的气泡D.读数时视线与滴定管内液体凹液面保持水平
A项,滴定管在装液之前必须要用标准液润洗,否则会稀释标准液,错误;B项,锥形瓶用蒸馏水洗净,不必干燥就能加入一定体积未知浓度的NaOH溶液,瓶中残留的蒸馏水对测定结果无影响,错误;C项,在滴定之前必须排出滴定管下端的气泡,然后记录读数,进行滴定,错误。
2.某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液(浓度有0.100 0 ml·L-1和0.010 0 ml·L-1两种)对其进行滴定。下列说法正确的是A.该实验应选用甲基橙作指示剂B.用0.100 0 ml·L-1标准NaOH溶液滴定时误差更小C.准确量取一定体积的白醋放入洗浄的锥形瓶中后,可以再加少量蒸馏水后开始滴定D.滴定时,眼睛一直注视着刻度线,以防止液面下降到滴定管最大刻度以下
该实验滴定终点生成醋酸钠,醋酸钠水解使溶液呈碱性,应选用酚酞作指示剂,故A错误;由于白醋中醋酸溶液浓度较小,用浓度较小的氢氧化钠溶液滴定误差较小,故B错误;准确量取一定体积的白醋放入洗净的锥形瓶中后,可以再加少量蒸馏水,不影响实验结果,故C正确;滴定时,眼睛要注视锥形瓶中溶液颜色的变化,故D错误。
3.NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4·2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是A.图甲:转移NaOH溶液到250 mL容量瓶中B.图乙:准确称得0.157 5 g H2C2O4·2H2O 固体C.用图丙所示操作排除碱式滴定管中的 气泡D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液
向容量瓶中转移溶液时需要用玻璃棒引流,故A错误;托盘天平的精确度为0.1 g,故B错误;NaOH溶液应装在碱式滴定管中,故D错误。
4.实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0酚酞:8.2~10.0用0.100 0 ml·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应时,下列叙述中正确的是A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂
NaOH溶液和CH3COOH溶液恰好完全反应时生成CH3COONa,CH3COO-水解使溶液显碱性,而酚酞的变色范围为8.2~10.0,比较接近。
5.H2S2O3是一种弱酸,实验室欲用0.01 ml·L-1的Na2S2O3溶液滴定碘水,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是A.该滴定反应可用甲基橙作指示剂B.Na2S2O3是该反应的还原剂C.该滴定反应可选用如图所示的装置D.该反应中每消耗2 ml Na2S2O3,转移电子的物质的量为4 ml
溶液中有单质碘,应加入淀粉溶液作指示剂,碘与硫代硫酸钠发生氧化还原反应,当反应达到终点时,单质碘消失,蓝色褪去,故A错误;Na2S2O3中S元素化合价升高被氧化,作还原剂,故B正确;Na2S2O3溶液显碱性,应该用碱式滴定管,故C错误;反应中每消耗2 ml Na2S2O3,转移2 ml电子,故D错误。
6.室温下,向20.00 mL 0.100 0 ml·L-1盐酸中滴加0.100 0 ml·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg 5≈0.7。下列说法不正确的是A.NaOH与盐酸恰好完全反应时,pH=7B.选择变色范围在pH突变范围内的指示剂,可减 小实验误差C.选择甲基红指示反应终点,误差比甲基橙的大D.V(NaOH)=30.00 mL时,pH≈12.3
NaOH与盐酸恰好完全反应时溶液中溶质为NaCl,呈中性,室温下pH=7,故A正确;甲基橙的变色范围在pH突变范围外,误差更大,故C错误;
7.(2022·上海模拟)测定鸡蛋壳中碳酸钙含量的方法如下:将一定质量鸡蛋壳粉碎后用已知浓度与体积的足量盐酸充分溶解(假设其他成分不反应),直到不再有气泡产生。再加入2滴酚酞溶液,用标准NaOH溶液滴定至终点,记录消耗NaOH溶液体积。若某次测定的碳酸钙含量偏高,可能的原因是A.所用的盐酸浓度过高,有一定挥发B.终点时溶液呈较深的红色C.滴定管清洗后直接盛装标准NaOH溶液D.滴定前未通过加热赶走溶解的CO2
若所用的盐酸浓度过高,有一定挥发,则过量盐酸消耗NaOH的体积减小,由此计算CaCO3消耗盐酸的体积偏大,CaCO3的含量偏高,A正确;终点时溶液呈较深的红色,则过量盐酸消耗NaOH溶液体积偏大,CaCO3消耗盐酸的体积偏小,由此计算CaCO3的含量偏低,B错误;滴定管清洗后直接盛装标准NaOH溶液,则过量盐酸消耗NaOH的体积偏大,由此计算CaCO3消耗盐酸的体积偏小,CaCO3的含量偏低,C错误;滴定前未通过加热赶走溶解的CO2,则消耗NaOH的体积偏大,由此计算CaCO3消耗盐酸的体积偏小,CaCO3的含量偏低,D错误。
8.常温下,用1.0 ml·L-1的NaOH溶液中和某浓度的H2SO4溶液,所得溶液的pH和所用NaOH溶液体积的关系如图所示,则原H2SO4溶液的物质的量浓度及完全反应后溶液的体积(忽略反应前后溶液体积的变化)分别是A.1.0 ml·L-1,20 mLB.0.5 ml·L-1,40 mLC.0.5 ml·L-1,80 mLD.1.0 ml·L-1,80 mL
滴定前H2SO4溶液的pH=0,则c(H2SO4)=0.5 ml·L-1,当pH=7时V(NaOH)=40 mL,通过计算可知原H2SO4溶液的体积为80 mL。
9.(2022·南京模拟)室温下,向a点(pH=a)的20.00 mL 1.000 ml·L-1氨水中滴入1.000 ml·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是A.将此氨水稀释,溶液的导电能力减弱B.b点溶液中离子浓度大小可能存在:c( )> c(Cl-)>c(OH-)>c(H+)C.c点时消耗盐酸体积小于20.00 mLD.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
由图知,b点溶液显碱性,氨水有剩余,B项正确;c点溶液呈中性,因而V(盐酸)略小于20.00 mL,C项正确;d点对应的温度较高,其水的离子积常数较大,D项错误。
①甲醛中常含有微量甲酸,应先除去。取甲醛a mL于锥形瓶中,加入1~2滴指示剂,用浓度为b ml·L-1的NaOH溶液滴定,滴定管的初始读数为V1 mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2 mL。②向锥形瓶中加入饱和食盐水试样c mL,静置1分钟。③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3 mL。下列说法不正确的是
A.步骤①中的指示剂可以选用酚酞溶液
步骤①中用NaOH溶液滴定甲酸,滴定终点时生成甲酸钠,溶液呈碱性,所以指示剂可选用酚酞溶液,故A正确;
11.(2022·银川质检)25 ℃时,用0.100 0 ml·L-1的NaOH溶液滴定20.00 mL 0.100 0 ml·L-1的一元强酸甲和一元弱酸乙,滴定曲线如图所示。下列有关判断正确的是A.曲线Ⅰ代表的滴定最好选用甲基橙作指示剂B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙C.电离常数Ka(乙)=1.01×10-5D.图像中的x>20.00
根据两种酸的浓度均为0.100 0 ml·L-1以及曲线Ⅰ、Ⅱ的起点对应的pH可知,曲线Ⅰ为NaOH滴定一元弱酸乙,曲线Ⅱ为NaOH滴定一元强酸甲,B项错误;分析曲线Ⅰ可知,滴定终点时溶液为碱性,故应选取酚酞作指示剂,A项错误;
由曲线Ⅱ可知,强碱滴定强酸达到滴定终点时,pH=7,x=20.00,D项错误。
12.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。(1)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中反应的化学方程式为____________________。(2)除去C中过量的H2O2,然后用0.090 0 ml·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______(填序号);简述排气泡的操作:_____________________________________________________________________________________________。
SO2+H2O2===H2SO4
向上倾斜,用两指捏住胶管,轻轻挤压玻璃珠的中上部,使液体从尖嘴流出
(3)①若滴定终点时溶液的pH=8.8,则选择的指示剂为_______;描述达到滴定终点的现象:__________________________________________________________________。②若滴定终点时溶液的pH=4.2,则选择的指示剂为________;描述达到滴定终点的现象:__________________________________________________________________。
滴入最后半滴标准液,溶液由无
色变为浅红色,且半分钟内不恢复原色
当滴入最后半滴标准液,溶液由红色变为橙色,且半分钟内不恢复原色
(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积_____(填序号)。①=10 mL ②=40 mL ③<10 mL ④>40 mL(5)滴定至终点时,消耗NaOH溶液25.00 mL,列式计算该葡萄酒中SO2含量: _______________________________________________________________________________________________________________________________________________________________________。
0.090 0 ml·L-1×0.025 L=0.002 25 ml。根据
(6)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:____________________________________________________________________________________________________________。
盐酸具有挥发性,反应过程中挥发出的盐酸滴定时消耗了NaOH标准液。改进措施:用非挥发性的强酸硫酸代替盐酸
13.水溶液中的离子反应与离子平衡在化学工业上有着重要的应用。回答下列问题:(1)常温下,将V1 mL 0.3 ml·L-1稀盐酸与V2 mL 0.1 ml·L-1 NaOH溶液混合,所得溶液的pH为1,则V1∶V2=______(溶液体积变化忽略不计)。
(2)常温下,将V1 mL pH=3的酸HA溶液与V2 mL pH=11的NaOH溶液混合。下列说法正确的是______(填字母)。A.若V1=V2,反应后溶液pH一定等于7B.若反应后溶液呈中性,则混合液中c(H+)+c(OH-)=2×10-7 ml·L-1C.若反应后溶液呈酸性,则V1一定大于V2D.若反应后溶液呈碱性,则V1一定小于V2
当V1=V2,酸碱恰好完全反应,如果HA是弱酸,则生成的NaA溶液呈碱性,A错误;若反应后溶液呈中性,则常温下,氢离子浓度等于氢氧根离子浓度等于1×10-7 ml·L-1,则混合液中c(H+)+c(OH-)=2×10-7 ml·L-1,B正确;若HA为弱酸,HA部分电离,c(HA)>c(NaOH),反应后HA有剩余,则V1小于或等于V2也可使溶液呈酸性,C错误;由C分析可知:溶液要想呈碱性,则一定V1
甲基橙变色不明显,故选择酚酞为指示剂。
②C点溶液中离子浓度由大到小的顺序为_____________________________________。
c(CH3COO-)>c(OH-)>c(H+)
C点溶液呈碱性,故氢氧根离子浓度大于氢离子浓度,根据电荷守恒,则钠离子浓度大于醋酸根离子浓度,则溶液离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
③下列操作会使测定结果偏小的是_____(填字母)。a.未用标准溶液润洗滴定管b.标准溶液滴在锥形瓶外一滴c.滴定前平视,滴定后俯视读数d.待测液溅出锥形瓶外一滴
新高考化学一轮复习精品课件 第9章 第53讲 酸碱中和滴定及拓展应用 (含解析): 这是一份新高考化学一轮复习精品课件 第9章 第53讲 酸碱中和滴定及拓展应用 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,氧化还原滴定,滴定终点判断,规范精炼,真题演练明确考向,课时精练等内容,欢迎下载使用。
第54讲 酸碱中和滴定及拓展应用-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第54讲 酸碱中和滴定及拓展应用-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共48页。PPT课件主要包含了复习目标,考点一,必备知识,易错辨析,专项突破,氧化还原滴定,考点二,滴定终点判断,真题演练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第8章 第48讲 酸碱中和滴定及拓展应用: 这是一份2024年高考化学一轮复习课件(鲁科版)第8章 第48讲 酸碱中和滴定及拓展应用,文件包含第8章第48讲酸碱中和滴定及拓展应用pptx、第8章第48练酸碱中和滴定及拓展应用docx、第8章第48讲酸碱中和滴定及拓展应用docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












