














所属成套资源:2024年高考化学一轮复习课件(新人教新高考版)
2024年高考化学一轮复习(新高考版) 第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析
展开
这是一份2024年高考化学一轮复习(新高考版) 第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析,文件包含2024年高考化学一轮复习新高考版第9章第56讲反应过程中溶液粒子浓度变化的图像分析pptx、2024年高考化学一轮复习新高考版第9章第56讲反应过程中溶液粒子浓度变化的图像分析docx、第9章第56讲反应过程中溶液粒子浓度变化的图像分析docx、第9章第56练反应过程中溶液粒子浓度变化的图像分析docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1.能正确识别图像,能从图像中找到曲线指代、趋势、关键点。2.利用溶液中的平衡关系,学会分析不同类型图像中各粒子浓度之间的关系。
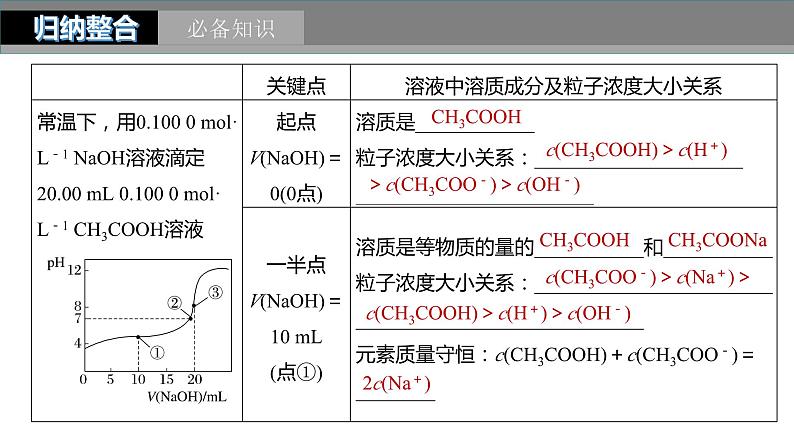
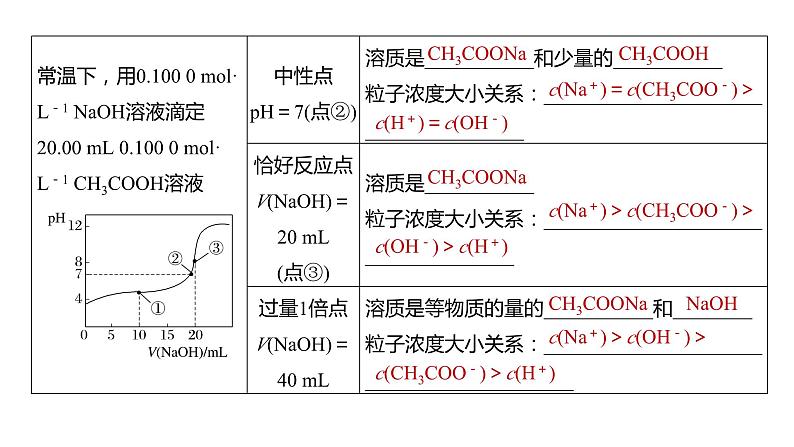
类型一 滴定过程pH变化曲线
类型二 分布系数曲线
类型三 对数图像中的粒子浓度关系
真题演练 明确考向
c(CH3COOH)>c(H+)
>c(CH3COO-)>c(OH-)
c(CH3COO-)>c(Na+)>
c(CH3COOH)>c(H+)>c(OH-)
c(Na+)=c(CH3COO-)>
c(H+)=c(OH-)
c(Na+)>c(CH3COO-)>
c(OH-)>c(H+)
c(Na+)>c(OH-)>
c(CH3COO-)>c(H+)
一、一元弱电解质的滴定曲线1.常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 ml·L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)B.点③和点④所示溶液中:c(Na+)>c(OH-)> c(CH3COO-)>c(H+)C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)= c(HCN)-c(CH3COOH)D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-) =c(CH3COOH)+c(H+)
A项,点①的溶液中存在电荷守恒:c(OH-)+c(CN-)=c(Na+)+c(H+),且c(OH-)>c(H+),点②溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),错误;B项,点③溶液pH=7,则c(OH-)=c(H+),则点③溶液中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),错误;
C项,点①所示的溶液中存在元素质量守恒:c(HCN)+c(CN-)=2c(Na+),点②所示的溶液中存在元素质量守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),正确。
2.(2022·辽宁高三联考)用0.100 0 ml·L-1的盐酸标准液分别滴定20.00 mL浓度均为0.100 0 ml·L-1的氨水和NaOH溶液,滴定曲线如图。下列说法错误的是A.滴加10.00 mL盐酸时,氨水中存在c(NH3·H2O)+c(OH-) =c(Cl-)+c(H+)B.分别滴加20.00 mL盐酸时,NaOH溶液中水的电离程度 大于氨水C.若用甲基橙作指示剂,滴定终点时NaOH溶液消耗盐酸 的量略大于氨水D.滴加10.00 mL盐酸时,氨水中存在c( )>c(Cl-)>c(OH-)>c(H+)
分别滴加20.00 mL盐酸时,恰好反应生成氯化钠和氯化铵,铵根离子能够水解,所以NaOH溶液中水的电离程度小于氨水,故B说法错误;若用甲基橙作指示剂,滴定终点时pH为3.1~4.4,若不考虑铵根离子水解,两份溶液消耗盐酸的量相等,铵根离子水解呈酸性,所以NaOH溶液消耗盐酸的量略大于氨水,故C说法正确;
二、二元弱电解质的滴定曲线3.已知pKa=-lg Ka,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 ml·L-1NaOH溶液滴定20 mL 0.1 ml·L-1H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
b点加入20 mL NaOH溶液,NaOH和H2SO3恰好完全反应生成NaHSO3,即溶质为NaHSO3,根据质子守恒得c(H2SO3)+c(H+)=c( )+c(OH-),故B说法正确;
4.常温下向100 mL 0.1 ml·L-1 Na2C2O4溶液中滴加0.1 ml·L-1的盐酸,溶液中pOH与加入盐酸的体积关系如图所示。已知:pOH=-lg c(OH-),Ka1(H2C2O4)=1×10-2,Ka2(H2C2O4)=1×10-5。下列说法不正确的是A.m的值约为5B.若V1=100,则n>7
V1=100时,Na2C2O4与盐酸按照1∶1恰好反应,生成NaHC2O4和NaCl, 的电离程度大于其水解程度,溶液呈酸性,pH7,B正确;
抓两点突破二元弱电解质滴定曲线
1.透析分布曲线 确定思维方向分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
2.明确解题要领 快速准确作答(1)读“曲线”——每条曲线所代表的粒子及变化趋势;(2)读“浓度”——通过横坐标的垂线,可读出某pH时的粒子浓度;(3)“用交点”——交点是某两种粒子浓度相等的点,可计算电离常数K;(4)“可替换”——根据溶液中的元素质量守恒进行替换,分析得出结论。
1.(2020·海南,12)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是A.该酸-lg Ka ≈的水解平衡常数Kh=C.当该溶液的pH=7.0时,c(HA)Ka(HY)>Ka(HZ)C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)- c(OH-)
NaX为强碱弱酸盐,在溶液中水解使溶液呈碱性,则溶液中离子浓度的大小顺序为c(Na+)>c(X-)>c(OH-)>c(H+),故A正确;弱酸的酸性越弱,电离常数越小,由题图分析可知,HX、HY、HZ三种一元弱酸的酸性依次减弱,则三种一元弱酸的电离常数的大小顺序为Ka(HX)>Ka (HY)>Ka(HZ),故B正确;当溶液pH为7时,酸越弱,向盐溶液中加入盐酸的体积越大,酸根离子的浓度越小,则三种盐溶液中酸根离子的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故C错误;
向三种盐溶液中分别滴加20.00 mL盐酸,三种盐都完全反应,溶液中钠离子浓度等于氯离子浓度,将三种溶液混合后溶液中存在电荷守恒:c(Na+)+c(H+)=c(X-)+c(Y-)+c(Z-)+c(Cl-)+c(OH-),由c(Na+)=c(Cl-)可得:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),故D正确。
3.(2021·海南,13改编)25 ℃时,向10.00 mL 0.100 0 ml·L-1的NaHCO3溶液中滴加0.100 0 ml·L-1的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法正确的是
c点溶质为碳酸氢钠、氯化钠、碳酸,溶液中的H+主要来自H2CO3的电离,故C错误;d点,碳酸氢钠和盐酸恰好反应,c(Na+)=c(Cl-)=0.050 0 ml·L-1,故D错误。
A.甘氨酸具有两性B.曲线c代表NH2CH2COO-
5.(2020·山东,15改编)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 ml·L-1,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和lg c(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是A.O点时,c(CH3COOH)=c(CH3COO-)B.N点时,pH=lg Ka
D.pH由7到14的变化过程中,CH3COO-的水解程 度始终增大
随着溶液碱性的增强,c(CH3COOH)减小,c(CH3COO-)增大,故MN线表示lg c(CH3COO-),NP线表示lg c(CH3COOH),MO线表示lg c(H+),OP线表示lg c(OH-)。O点时,c(H+)=c(OH-),A项错误;
溶液pH增大,碱性增强,CH3COO-的水解程度减小,D项错误。
1.20 ℃时,用0.1 ml·L-1盐酸滴定20 mL 0.1 ml·L-1氨水的图像如图所示,下列说法正确的是
a点时加入的盐酸为10 mL,所得溶液的溶质为等物质的量浓度的氯化铵和一水合氨,根据元素质量守恒:2c(Cl-)=c(NH3·H2O)+c( ),故A错误;c点时加入的盐酸为20 mL,表示酸碱恰好完全反应,b点表示碱过量,盐酸完全反应,故B错误;
2.(2022·甘肃民乐一中模拟)次氯酸为一元弱酸,具有强氧化性,能杀菌、消毒。其溶液中HClO、ClO-所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列说法错误的是
次氯酸为一元弱酸,电离方程式为HClO H++ClO-,B正确;次氯酸具有强氧化性,能漂白酸碱指示剂,故滴加甲基橙溶液后溶液最终变为无色,C错误;
3.(2022·北京西城区模拟)在常温下,向30 mL 0.1 ml·L-1 NH4Cl溶液中加入0.1 ml·L-1 CH3COONH4溶液,溶液的pH随加入CH3COONH4溶液的体积的变化如图。已知:CH3COONH4溶液的pH约为7。下列说法正确的是
铵根离子在溶液中水解使溶液呈酸性,溶液中离子浓度的大小顺序为c(Cl-)>c( )>c(H+)>c(OH-),故A错误;氯化铵中铵根离子在溶液中水解使溶液呈酸性,醋酸铵中醋酸根离子在溶液中水解促进铵根离子水解,所以醋酸铵溶液中铵根离子浓度小于等浓度的氯化铵溶液,故B错误;未加入醋酸铵溶液时,0.1 ml·L-1氯化铵溶液的pH为6说明铵根离子在溶液中水解使溶液呈酸性,溶液中存在水解平衡,故C正确;
醋酸铵中醋酸根离子和铵根离子在溶液中都发生水解反应,向氯化铵溶液中加入醋酸铵溶液时,溶液的pH变化是铵根离子浓度和醋酸根离子浓度的相对大小发生改变造成的,故D错误。
4.(2022·山东青岛模拟)常温时,向20.00 mL 0.1 ml·L-1 C6H5COOH(苯甲酸)溶液中滴加0.1 ml·L-1 NaOH溶液,混合溶液的pH与微粒浓度变化的关系如图所示。下列说法错误的是A.a点溶液对应的pH为3.2B.b点对应的NaOH溶液体积为10.00 mLC.c点溶液中:c(C6H5COO-)>c(Na+)>c(H+)>c(OH-)D.常温时,C6H5COO-的水解常数Kh=10-9.8
c点溶液中氢离子为10—6.2 ml·L-1,溶液中c(H+)>c(OH—),由电荷守恒c(H+)+c(Na+)=c(C6H5COO—)+c(OH—)可得c(C6H5COO—)>c(Na+),则溶液中离子浓度的大小顺序为c(C6H5COO—)>c(Na+)>c(H+)>c(OH—),故C正确。
5.(2022·深圳模拟)甘氨酸盐酸盐(HOOCCH2NH3Cl)的水溶液呈酸性,溶液中存在以下平衡:
常温时,向10 mL一定浓度的HOOCCH2NH3Cl的水溶液中滴入同浓度的NaOH溶液。混合溶液pH随加入NaOH溶液体积的变化如图所示。下列说法不正确的是
当V(NaOH)=20 mL时,即甘氨酸盐酸盐(HOOCCH2NH3Cl)和NaOH的物质的量之比为1∶2,反应的化学方程式为HOOCCH2NH3Cl+2NaOH===NaOOCCH2NH2+NaCl+2H2O,故此时混合溶液中的溶质主要为NaOOCCH2NH2和NaCl,D正确。
6.(2022·海南学业水平诊断)已知亚磷酸(H3PO3)是二元弱酸,298 K时的电离常数分别为Ka1=10-1.4,Ka2=10-6.1。298 K时,向1 L 0.2 ml·L-1 NaH2PO3溶液中通入HCl气体,溶液的pH与通入HCl物质的量的关系如图所示。下列说法正确的是
b点溶液中的溶质为NaH2PO3和H3PO3、NaCl,所以溶液显酸性,故pHb>c,d点溶液呈中性,不影响水的电离,因此水的电离程度:d>c>b>a,故A正确;c点c(HA-)最大,说明溶质为NaHA,向c点溶液通入HCl,则c→b之间发生反应的离子方程式:HA-+H+===H2A,故B错误;
c点溶液显酸性,说明HA-的电离程度大于其水解程度,存在:c(HA-)>c(A2-)>c(H2A),故C错误;d点溶液呈中性,再根据电荷守恒得到:c(HA-)+2c(A2-)=c(Na+) +c(K+),故D错误。
8.在某温度时,将n ml·L-1氨水滴入 10 mL 1.0 ml·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法错误的是
C.水的电离程度:b>c>a>dD.25 ℃时 ,NH4Cl 水解平衡常数为(n-1)×10-7 (用n表示)
b点溶液铵根离子水解促进水的电离,而a、d两点都抑制水的电离,所以b点水的电离程度最大;由于d点混合液的pH未知,则无法判断a、d两点水的电离程度大小,C错误;
9.(2023·广州质检)某浓度的二元弱酸H2B溶液在不同pH下,测得pC(M)变化如图所示[已知: pC(M)=-lg c(M),M代指H2B或HB-或B2-],下列说法正确的是A.曲线Ⅱ表示pC(HB-)与pH关系B.pH=5时,c(HB-)
相关课件
这是一份新高考化学一轮复习精品课件 第9章 第56讲 反应过程中溶液粒子浓度变化的图像分析 (含解析),共60页。PPT课件主要包含了内容索引,滴定过程pH变化曲线,必备知识,CH3COOH,CH3COONa,cNa+,NaOH,关键能力,分布系数曲线,真题演练明确考向等内容,欢迎下载使用。
这是一份第57讲 溶液中粒子浓度变化的图像分析-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共56页。PPT课件主要包含了复习目标,滴定过程pH变化曲线,类型一,典例分析,专项突破,分布系数曲线,类型二,必备知识,类型三,真题演练等内容,欢迎下载使用。
这是一份第56讲 溶液中“粒子”浓度关系-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共54页。PPT课件主要包含了复习目标,必备知识,专项突破等内容,欢迎下载使用。









