












2024年高考化学一轮复习(新高考版) 第9章 第59讲 无机化工流程题的解题策略
展开第59讲 无机化工流程题的解题策略
[复习目标] 1.培养从试题提供的新信息中准确地提取实质性内容,并与已有知识块整合重组为新知识块的能力。2.培养将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。3.培养将分析和解决问题的过程及成果用正确的化学术语及文字、图表、模型、图形等表达并做出解释的能力。
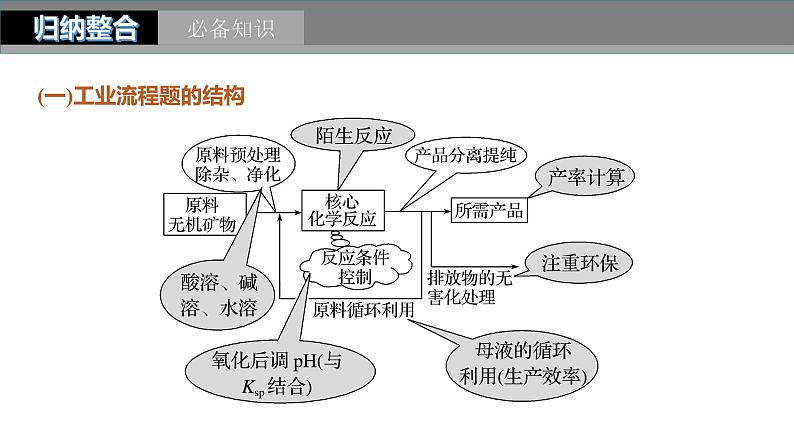
(一)工业流程题的结构
(二)流程图中主要环节的分析
1.核心反应——陌生方程式的书写
关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原规律判断产物,并根据化合价升降相等配平。
(2)非氧化还原反应:结合物质性质和实际反应判断产物。
2.原料的预处理
(1)溶解:通常用酸溶,如用硫酸、盐酸等。
水浸 | 与水接触发生反应或溶解 |
浸出 | 固体加水(酸)溶解得到离子 |
酸浸 | 在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去 |
浸出率 | 固体溶解后,离子在溶液中的含量的多少 |
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
(3)审题时要“瞻前顾后”,注意物质性质及反应原理的前后联系。
3.常用的控制反应条件的方法
(1)调节溶液的pH。常用于使某些金属离子形成氢氧化物沉淀。调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH增大;
②不引入新杂质。
例如:若要除去Cu2+中混有的Fe3+,可加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。
(2)控制温度。根据需要升温或降温,改变反应速率或使平衡向需要的方向移动。
(3)趁热过滤。防止某些物质降温时析出。
(4)冰水洗涤。洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
4.常用的分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如从溶液中提取NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气。
一、条件控制与Ksp的计算
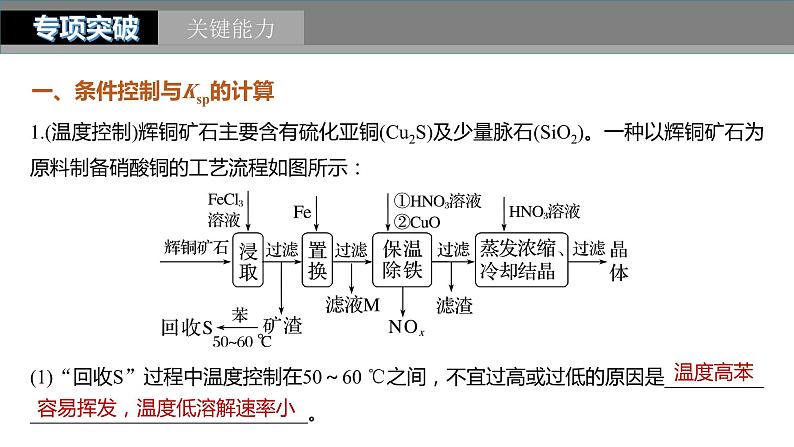
1.(温度控制)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如图所示:
(1)“回收S”过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是_______。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________
________________________________________________________________________;
“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是______
________________________________________________________________________。
2.(酸碱度控制——调pH)利用某钴矿石(主要成分为Co2O3)制取Co(OH)2粗品及其他工业产品的工艺流程如图1所示。
已知:浸出液中含有的阳离子主要有H+、Cu2+、Co2+、Fe2+、Mg2+。
回答下列问题:
(1)钴矿石浸出时加入Na2SO3的目的为________________________________。
(2)溶液中lg c(X)(X表示Fe3+、Cu2+、Fe2+、Co2+、Mg2+、Ca2+)与pH的变化关系如图2所示(离子浓度小于10-5 mol·L-1时可认为已除尽),在萃取余液中通入空气的目的是
________________________________________________________________________,
用熟石灰调pH至3.2,过滤1所得滤渣的主要成分为________,萃取和反萃取的目的是________________________________________________________________________。
(3)用氧化镁调滤液1的pH为9.1时,得到的氢氧化钴粗品中含有的主要杂质为____________,多次洗涤可提高粗产品中钴含量。“过滤2”后所得滤液直接排放会造成水体污染,须进行处理,用熟石灰调节pH使c(Mg2+)≤10-5 mol·L-1,则Ksp[Mg(OH)2]=________。
3.(调pH与Ksp计算)某废钒渣(主要成分为V2O3,含有少量Al2O3、CaO)为原料生产V2O5的工艺流程如图:
已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO | VO | V2O | VO |
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为__________
________________________________________________________________________。
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为________________________________________________________。
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是_______________
________________________________________________________________________。
(4)反应Ca3(VO4)2(s)+3CO(aq)2VO(aq)+3CaCO3(s)的平衡常数为______________(用含m、n的代数式表示),已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n。
(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是____________________________________________________。
二、化工流程分析滤液、滤渣成分的确定
4.(2022·湖南岳阳模拟)锰常用于制造合金锰钢。某化工厂以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3、CaO等少量杂质)为主要原料制取金属锰的工艺流程如图1所示。
(1)“浸锰”步骤中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图2所示。为减少MnS2O6的生成,“浸锰”的适宜温度是________,“滤渣 Ⅰ”的成分是____________(填化学式)。该步骤中可以再加入MnSO4以促进“滤渣 Ⅰ”析出,结合平衡移动原理分析其原因:____________________________________________________
________________________________________________________________________。
(2)“滤液 Ⅰ”中需要先加入MnO2充分反应后再调pH,写出加入MnO2时发生反应的离子方程式:________________________________________________________________。
(3)“滤液Ⅱ”中加入MnF2的目的是除去溶液中的Ca2+,已知25 ℃时,Ksp(CaF2)=3.2×
10-11,则常温下CaF2在纯水中的溶解度为________g。
5.以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如图:
(1)“酸溶”中加快溶解的方法为________________(任意写出一种)。
(2)“还原”过程中的离子方程式为__________________________________________
________________________________________________________________________。
(3)写出“滤渣”中主要成分的化学式:______________________________________。
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为____________________________
________________________________________________________________________。
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中=____________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是________________________________________________________________________
________________________________________________________________________。
6.钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如图:
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是__________________________________________
________________________________________________________________________。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是____________;再向滤液中加入氨水调节pH=6,滤液中Sc3+的浓度为__________。(已知:25 ℃时,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中 =____________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式:_______________________________。[已知:25 ℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
新高考化学一轮复习精品课件 第9章 第59讲 无机化工流程题的解题策略 (含解析): 这是一份新高考化学一轮复习精品课件 第9章 第59讲 无机化工流程题的解题策略 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,温度高苯,FeOH3沉淀,抑制Cu2+的水解,FeOH3,除去Cu2+,-108,流程分析,CaO+O2+等内容,欢迎下载使用。
第60讲 无机化工流程题的解题策略-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第60讲 无机化工流程题的解题策略-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共37页。PPT课件主要包含了复习目标,必备知识,温度高苯,专项突破,FeOH3沉淀,抑制Cu2+的水解,FeOH3,除去Cu2+,-108,流程分析等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第8章 第53讲 无机化工流程题的解题策略: 这是一份2024年高考化学一轮复习课件(鲁科版)第8章 第53讲 无机化工流程题的解题策略,文件包含第8章第53讲无机化工流程题的解题策略pptx、第8章第53讲无机化工流程题的解题策略docx、第8章第53练无机化工流程题的解题策略docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












