
所属成套资源:2024届高三化学一轮复习小题训练
2024届高三化学一轮复习(小题训练)--盐类水解
展开
这是一份2024届高三化学一轮复习(小题训练)--盐类水解,共20页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
2024届高三化学一轮复习(小题训练)--盐类水解
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列化学用语表达正确的是
A.NH3·H2O=NH+OH- B.S2−+H2O=HS-+OH-
C.Fe3++3H2OFe(OH)3+3H+ D.H2CO32H++CO
2.按照生活经验,判断下列物质:①苏打水 ②鲜橙汁 ③食醋 ④肥皂液,其中呈酸性的是
A.②③ B.①④ C.②③④ D.①③④
3.升高温度,下列数据不一定增大的是
A.化学反应速率 B.化学平衡常数 C.水的离子积常数 D.水解平衡常数
4.下列离子反应方程式中,不属于水解反应的是
A.NH+H2O⇌NH3·H2O+H+
B.HSO+H2O⇌H2SO3+OH-
C.HCO+H2O⇌H3O++CO
D.AlO+2H2O⇌Al(OH)3+OH-
5.在常温下,用的盐酸滴定溶液,所得滴定曲线如图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
A.点:c(CO)>c(Cl-)> c(HCO)
B.点:
C.点:
D.点:c(Cl-)= c(Na+)
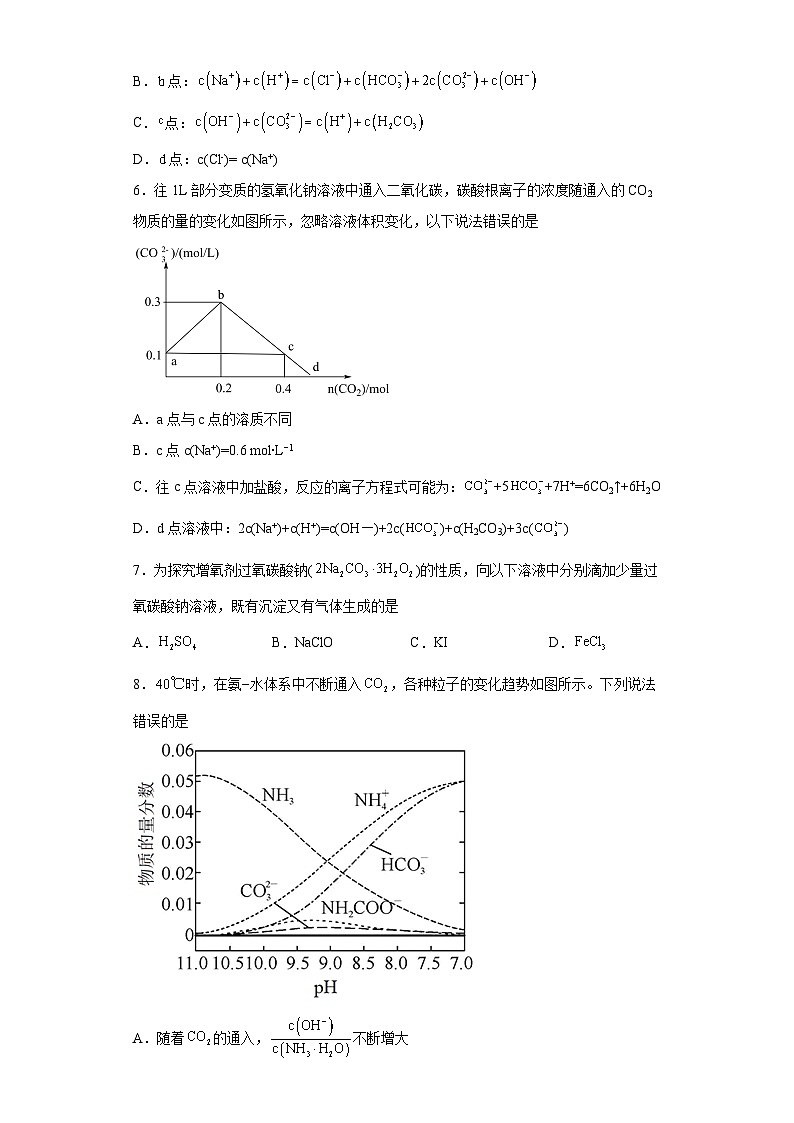
6.往1L部分变质的氢氧化钠溶液中通入二氧化碳,碳酸根离子的浓度随通入的CO2物质的量的变化如图所示,忽略溶液体积变化,以下说法错误的是
A.a点与c点的溶质不同
B.c点c(Na+)=0.6 mol∙L−1
C.往c点溶液中加盐酸,反应的离子方程式可能为:+5+7H+=6CO2↑+6H2O
D.d点溶液中:2c(Na+)+c(H+)=c(OH-)+2c()+c(H2CO3)+3c()
7.为探究增氧剂过氧碳酸钠()的性质,向以下溶液中分别滴加少量过氧碳酸钠溶液,既有沉淀又有气体生成的是
A. B.NaClO C.KI D.
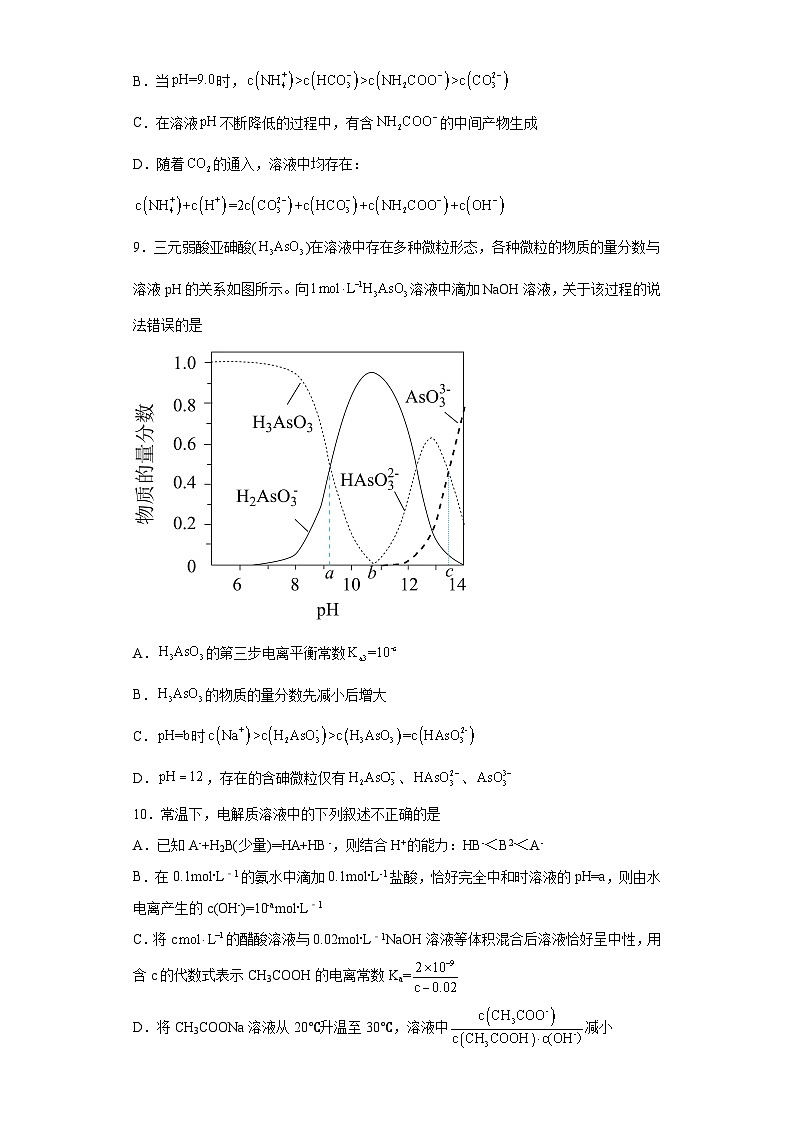
8.时,在氨−水体系中不断通入,各种粒子的变化趋势如图所示。下列说法错误的是
A.随着的通入,不断增大
B.当时,
C.在溶液不断降低的过程中,有含的中间产物生成
D.随着的通入,溶液中均存在:
9.三元弱酸亚砷酸()在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。向溶液中滴加NaOH溶液,关于该过程的说法错误的是
A.的第三步电离平衡常数
B.的物质的量分数先减小后增大
C.时
D.,存在的含砷微粒仅有、、
10.常温下,电解质溶液中的下列叙述不正确的是
A.已知A-+H2B(少量)═HA+HB-,则结合H+的能力:HB-<B2-<A-
B.在0.1mol·L﹣1的氨水中滴加0.1mol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-amol·L﹣1
C.将c的醋酸溶液与0.02mol·L﹣1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=
D.将CH3COONa溶液从20℃升温至30℃,溶液中减小
11.常温下,物质的量浓度相同的三种盐溶液的依次为7、9、10,下列说法不正确的是
A.是强酸 B.离子浓度
C.三种盐溶液中水的电离度都比纯水大 D.
12.下列现象不能用盐类水解知识解释的是
A.明矾能用于净水 B.NH4Cl溶液可作焊接金属时的除锈剂
C.铜绿的生成 D.制备Fe(OH)3胶体
13.下列溶液一定显中性的是
A.c(H+)=10-7mol•L-1或pH=7的溶液
B.酸和碱恰好反应完全的溶液
C.lg=0的溶液
D.不发生水解的盐溶液
14.下列叙述正确的是
A.100℃纯水的pH=6,所以水在100℃时呈酸性
B.pH=3的盐酸,稀释至10倍后pH>4
C.用干燥的广泛pH试纸可测得氯水的pH为4
D.室温下,将pH=13的NaOH溶液与pH=10的溶液等体积混合,所得溶液的pH=12.7
15.室温下,下列有关溶液的物质的量浓度关系正确的是
A.物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH)由大到小的顺序为:③>②>①
B.0.1mol⋅L-1的Na2CO3溶液:c(OH-)=c(H+)+c(HCO)+c(H2CO3)
C.0.1mol⋅L-1的CH3COOH与0.05mol⋅L-1的NaOH溶液等体积混合(pHc(Na+)>c(CH3COO-)>c(H+)
D.0.1mol⋅L-1的Na2CO3与0.05mol⋅L-1的NaHCO3溶液等体积混合:3c(Na+)=5c(CO)+5c(HCO)+5c(H2CO3)
二、实验题
16.为探究盐类水解是一个吸热过程,请用溶液和其他必要试剂,设计一个简单的实验方案:_______。
17.已知常温下的水解常数。
(1)溶液呈_______性,请用离子方程式表达原因_______。
(2)常温下,用溶液滴定溶液,当达到滴定终点时溶液的_______(填“>”“<”或“=”)7,溶液中各离子浓度从大到小的顺序为_______;若滴定三次平均用去标准液则该溶液的浓度为_______。实验过程中,下列操作可能使测定结果偏低的是_______(填写标号)。
A.酸式滴定管在装液前未用标准溶液润洗2次~3次。
B.开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中,气泡消失。
C.达到滴定终点时,俯视溶液凹面最低点读数。
(3)常温下,含等物质的量浓度的与的混合溶液显_______ (填“酸”“碱”或“中”)性,_______(填“>”“c(Na+)>c(CH3COOH)>c(H+),C项错误;
D.溶液中存在物料守恒3n(Na)=5n(C),则3c(Na+)=3c(Na+)=5c(CO)+5c(HCO)+5c(H2CO3),D项正确;
答案选D。
16.取溶液,滴加酚酞,溶液呈红色,然后分成两份,加热其中一份,若红色变深,则盐类水解吸热
【详解】碳酸钠水解生成氢氧根离子,加热水解程度变大,碱性增强,能使酚酞溶液变色更明显;故实验设计为:取溶液,滴加酚酞,溶液呈红色,然后分成两份,加热其中一份,若红色变深,则盐类水解吸热。
17.(1) 碱 CH3COO-+ H2OCH3COOH+ OH-
(2) > c(Na+)>c(CH3COO-)>c( OH-)>c( H+ ) 0.0800 C
(3) 酸 >
【详解】(1)溶液中醋酸根水解生成醋酸和氢氧根,因此溶液呈碱性,用离子方程式表达原因CH3COO-+ H2OCH3COOH+ OH-;故答案为:碱;CH3COO-+ H2OCH3COOH+ OH-。
(2)常温下,用溶液滴定溶液,用酚酞作指示剂,当溶液由浅红色变为无色,则达到滴定终点,因此当达到滴定终点时溶液的>7,由于醋酸根水解,因此钠离子浓度大于醋酸根浓度,溶液显碱性,氢氧根浓度大于氢离子浓度,因此溶液中各离子浓度从大到小的顺序为c(Na+)>c(CH3COO-)>c( OH-)>c( H+ );若滴定三次平均用去标准液则该溶液的浓度为;实验过程中:
A.酸式滴定管在装液前未用标准溶液润洗2次~3次,标液浓度降低,中和等量的碱液,消耗标液体积变大,测定浓度偏高,故A不符合题意;
B.开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中,气泡消失,读数偏大,测定结果偏高,故B不符合题意;
C.达到滴定终点时,俯视溶液凹面最低点读数,读数偏小,测定结果偏低,故C符合题意;
故答案为:>;c(Na+)>c(CH3COO-)>c( OH-)>c( H+ );0.0800;C。
(3)常温下,含等物质的量浓度的与的混合溶液,即醋酸电离程度大于醋酸根水解程度,因此混合溶液显酸性,醋酸电离生成醋酸根的量大于醋酸根水解消耗的量,因此醋酸根浓度比原来增多,而醋酸浓度比原来减少即>;故答案为:酸;>。
18.(1)④>②>①>③
(2) Ⅰ 溶液由无色变为浅红色,且半分钟内不褪色
(3) c(R-)>c(K+)>c(H+)>c(OH-) >
(4)acd
(5)22.60
【解析】(1)
已知H2S能定量完成下列反应:R-(足量)+H2S=HR+HS-,得出酸性:H2S>HR>HS-,根据2Z-+H2S(少量)=2HZ+S2−,得出酸性:H2S>HS->HZ,所以酸性:H2S>HR>HS->HZ,根据越弱越水解原理,碱性越强,相同温度下,相同物质的量浓度的①NaR②Na2S③NaHS④NaZ四种溶液的pH由大到小的顺序为:④>②>①>③;故答案为:④>②>①>③。
(2)
用0.10mol/L KOH溶液分别滴定20.00mL 0.10mol/L的盐酸和HR溶液,说明盐酸未滴定之前溶液pH为1,因此曲线II为滴定盐酸,而表示滴定的HR溶液曲线是I。若此实验选用酚酞为指示剂,开始溶液是无色,后来酸反应完,因此滴定到达终点的现象是溶液由无色变为浅红色,且半分钟内不褪色;故答案为:I;溶液由无色变为浅红色,且半分钟内不褪色。
(3)
在滴定HR溶液的过程中:V(KOH)=10.00mL时,此时溶质为KR和HR且物质的量浓度相等,根据图中信息溶液显酸性,因此溶液中离子浓度由大到小的顺序为:c(R-)>c(K+)>c(H+)>c(OH-)。当c(K+)=c(R-)+c(HR)时,即溶液中溶质为KR,由于R-水解,溶液显碱性即溶液pH>7;故答案为:c(R-)>c(K+)>c(H+)>c(OH-);>。
(4)
a.配制标准溶液的KOH固体中混有杂质NaOH,导致碱的浓度偏大,消耗标液体积减少,得到HR的浓度偏低,故a符合题意;b.锥形瓶用待测液润洗后再注入待测液,消耗标液体积偏大,测定浓度偏高,故b不符合题意;c.选用甲基橙为指示剂,所消耗标液体积偏小就达到滴定终点,所得浓度偏低,故c符合题意;d.碱式滴定管滴定前无气泡,滴定后有气泡,所得的体积偏小,计算所得浓度偏低,故d符合题意;e.锥形瓶用蒸馏水洗过后未烘干,对结果没有影响,故e不符合题意;综上所述,答案为:acd。
(5)
滴定管读数要估读,其读数为22.60mL;故答案为:22.60。
19.(1) Cu、Cl CuCl2∙2H2O
(2) NH4NO3、Ag(NH3)2NO3、Cu(NH3)4(NO3)2 H+
(3)2CuCl2Cl2↑+2CuCl
(4)取少量H溶液,滴加酚酞,若变红,则含有OH-;另取少量H溶液,加入硝酸酸化,再加硝酸银溶液,若有白色沉淀生成,则含有Cl-
【分析】由实验Ⅰ可知,溶液C中加入过量氨水,生成蓝色沉淀D,则D中含有[Cu(NH3)4]2+,X中含有铜元素;白色沉淀B为AgCl,n(AgCl)=,20mL1.0mol/L盐酸中所含Cl-的物质的量为0.02mol,则X中所含Cl-的物质的量为0.04mol-0.02mol=0.02mol,从而得出X中含有CuCl2,其物质的量为0.01mol。
由实验Ⅱ可知,结晶水的质量为1.71g-1.35g=0.36g,物质的量为,CuCl2的物质的量为0.01mol,生成Cl2的物质的量为,则固体G为CuCl。综合实验Ⅰ、Ⅱ,X的化学式为CuCl2∙2H2O。
(1)
由以上分析可知,组成X的元素除H、O外还有Cu、Cl,X的化学式为CuCl2∙2H2O。答案为:Cu、Cl;CuCl2∙2H2O;
(2)
由分析可知,溶液C中含有过量的AgNO3、Cu(NO3)2、HNO3等,加入过量氨水,AgNO3最终生成Ag(NH3)2NO3,Cu(NO3)2最终生成Cu(NH3)4(NO3)2,另外还有NH4NO3生成,则溶液D中属于盐的成分是NH4NO3、Ag(NH3)2NO3、Cu(NH3)4(NO3)2;若溶液C中滴入少量氨水,则首先与HNO3反应,所以首先参与反应的微粒是H+。答案为:NH4NO3、Ag(NH3)2NO3、Cu(NH3)4(NO3)2;H+;
(3)
由分析知,E为CuCl2、F为Cl2,则E →F化学方程式为2CuCl2Cl2↑+2CuCl。答案为:2CuCl2Cl2↑+2CuCl;
(4)
固体G为CuCl,加入过量氨水,则溶液H中所含阴离子可能为Cl-、OH-,确定溶液H中的阴离子的方法是:取少量H溶液,滴加酚酞,若变红,则含有OH-;另取少量H溶液,加入硝酸酸化,再加硝酸银溶液,若有白色沉淀生成,则含有Cl-。答案为:取少量H溶液,滴加酚酞,若变红,则含有OH-;另取少量H溶液,加入硝酸酸化,再加硝酸银溶液,若有白色沉淀生成,则含有Cl-。
【点睛】AgOH、Cu(OH)2都能溶于过量的氨水,生成[Ag(NH3)2]+、[Cu(NH3)4]2+。
20.(1) ① ad
(2)18.00
(3) BC cba
【解析】(1)
在①操作装液时,用蒸馏水洗涤碱式滴定管后要先用NaOH标准溶液润洗滴定管2-3次,并使润洗滴定管尖嘴处流出润洗滴定管尖嘴,然后再注入NaOH溶液至“0”刻度线以上,防止蒸馏水将标准溶液稀释;其余步骤操作无误,故合理选项是①;
a.配制标准溶液的固体NaOH中若混有KOH杂质,由于KOH的摩尔质量大于NaOH,则等质量的碱配制的等体积标准溶液中含有OH-的物质的量偏少,滴定相同物质的量的H2A溶液消耗标准溶液体积偏大,以此为标准计算的待测H2A的浓度偏高,a符合题意;
b.中和滴定到达终点时俯视滴定管内液面读数,则消耗标准溶液体积偏小,以此为标准计算的待测H2A的浓度偏低,b不符合题意;
c.振荡时锥形瓶中溶液飞溅出来,消耗标准溶液体积偏少,以此为标准计算的待测H2A的浓度偏低,c不符合题意;
d.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,消耗标准溶液体积偏大,以此为标准计算的待测H2A的浓度偏高,d符合题意;
故合理选项是ad;
(2)
根据图示可知在滴定前读数是2.50 mL,滴定结束时液面读数是20.50 mL,则消耗NaOH标准溶液的体积V=20.50 mL-2.50 mL=18.00 mL;
(3)
①A.甲基橙变色范围是3.1-4.4,而根据滴定曲线可知:H2A前后完全被中和变为Na2A时溶液pH=8,此时甲基橙尚未变色,因此不能使用甲基橙作指示剂,A错误;
B.当V(NaOH)=V(H2A)时,二者恰好反应产生NaHA,根据质子守恒可得c(H+)+c(H2A)=c(A2-)+c(OH-),B正确;
C.当溶液pH=6.27时,溶液为Na2A、NaHA等浓度的混合溶液,c(HA-)=c(A2-),溶液显酸性,c(H+)>c(OH-),盐电离产生的离子浓度远大于弱电解质电离产生的离子浓度,所以c(HA-)=c(A2-)>c(H+)>c(OH-),C正确;
②常温下当c(HA-)=c(H2A)时,溶液pH=3.29,c(H+)=10-3.29,H2A的电离平衡常数Ka1=;
③当溶液pH=6时,c(H+)=10-6 mol/L,c(OH-)=;根据电荷守恒可得c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),所以2c(A2-)+c(HA-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=(10-6 -10-8) mol/L =9.9×10-7 mol/L;
④随着NaOH的加入,溶液中酸电离的氢离子逐渐减少,水的电离程度逐渐增大,所以水的电离程度大小:a点<b点<c点,则水电离程度由大到小的顺序为:c>b>a。
相关试卷
这是一份2024届高三化学一轮复习培优--盐类水解训练,共21页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习培优--盐类水解的应用训练,共22页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学高考备考一轮复习训练--盐类的水解,共21页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。








