

2023届四川省内江市高三零模理综化学试题含解析
展开
这是一份2023届四川省内江市高三零模理综化学试题含解析,共22页。试卷主要包含了单选题,工业流程题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
四川省内江市2023届高三零模理综化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与生产、生活密切相关。下列说法错误的是( )
A.以CO2为原料合成聚碳酸酯可降解塑料有助于实现“碳中和”
B.煤的液化是获得清洁燃料的一种方式,发生的是物理变化
C.2022年冬奥会首次使用了氢能作为火炬燃料,践行了绿色、环保理念
D.将以铁粉、生石灰为主要成分的双吸剂放入食品包装袋中,可以延长食物的保质期
【答案】B
【详解】A.以CO2为原料合成聚碳酸酯可降解塑料,可降低二氧化碳的排放量,有助于实现“碳中和”,A正确;
B.煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料,发生的是化学变化,B错误;
C.氢能作为火炬燃料燃烧产物为水,不会污染环境,践行了绿色、环保理念,C正确;
D.铁粉具有还原性,能吸收包装袋内的氧气,防止食品氧化,生石灰具有吸水性,能吸收包装袋内的水蒸气,防止食品潮解,则以铁粉、生石灰为主要成分的双吸剂放入食品包装袋中,可以延长食物的保质期,D正确;
故答案为B。
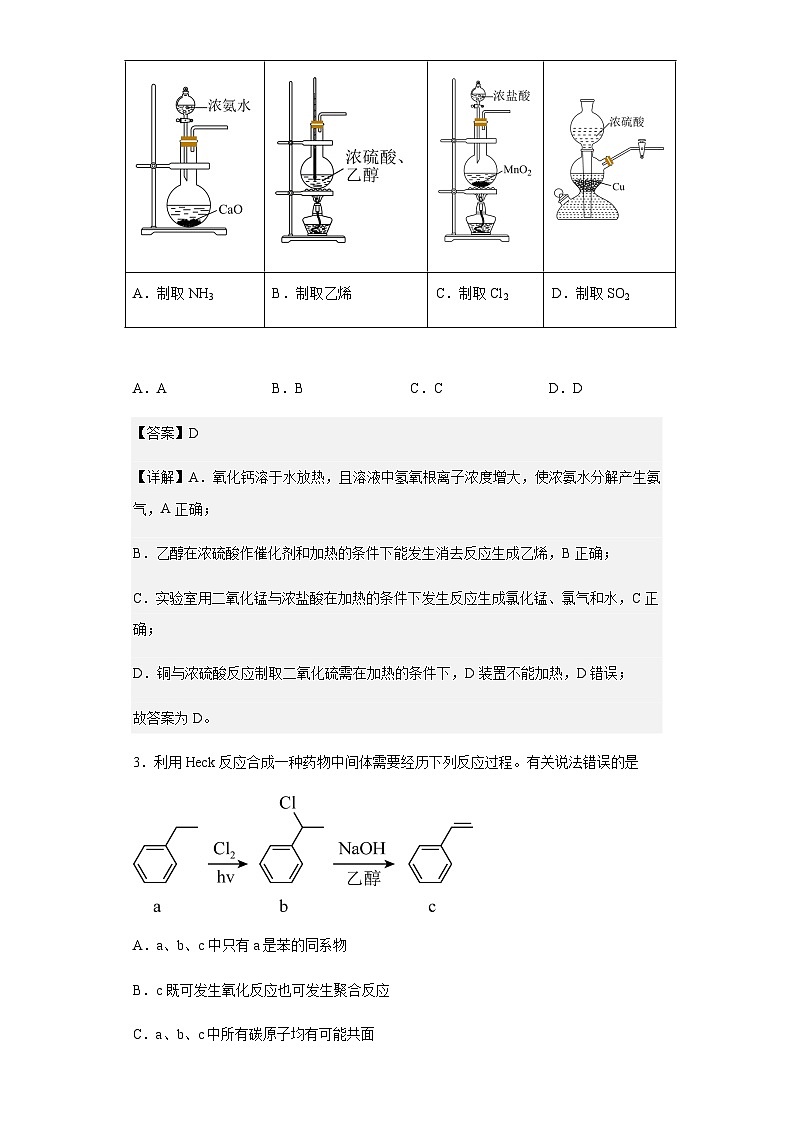
2.用下图所示装置及药品制备相应的气体,其中不能实现的是( )
A.制取NH3
B.制取乙烯
C.制取Cl2
D.制取SO2
A.A B.B C.C D.D
【答案】D
【详解】A.氧化钙溶于水放热,且溶液中氢氧根离子浓度增大,使浓氨水分解产生氨气,A正确;
B.乙醇在浓硫酸作催化剂和加热的条件下能发生消去反应生成乙烯,B正确;
C.实验室用二氧化锰与浓盐酸在加热的条件下发生反应生成氯化锰、氯气和水,C正确;
D.铜与浓硫酸反应制取二氧化硫需在加热的条件下,D装置不能加热,D错误;
故答案为D。
3.利用Heck反应合成一种药物中间体需要经历下列反应过程。有关说法错误的是
A.a、b、c中只有a是苯的同系物
B.c既可发生氧化反应也可发生聚合反应
C.a、b、c中所有碳原子均有可能共面
D.b的同分异构体中属于芳香族化合物的有12种
【答案】D
【详解】A.a是乙苯,b中含有氯原子,c中含有碳碳双键,b、c结构与苯均不相似,因此三种物质中只有a是苯的同系物,A正确;
B.c中含有碳碳双键,所以c既可发生氧化反应也可发生聚合反应,B正确;
C.苯环和碳碳双键均是平面形结构,且单键可以旋转,所以a、b、c中所有碳原子均有可能共面,C正确;
D.b的同分异构体中属于芳香族化合物的,如果只有一个取代基,该取代基是-CH2CH2Cl,如果有两个取代基,可以是-CH3和-CH2Cl或-CH2CH3和-Cl,均有邻间对三种,如果含有3个取代基,分别是2个甲基和1个氯原子,有6种不同结构,因此共计是13种,D错误;
答案选D。
4.NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下1L1mol·L-1Na2CO3溶液中含CO的数目小于NA
B.标准状况下,22.4LHF含NA个分子
C.17g-OH与17gOH-所含电子的数目均为10NA
D.0.05mol·L-1NaHSO4溶液中,阳离子的数目之和为0.1NA
【答案】A
【详解】A.Na2CO3溶液中CO水解后离子数目减少,故含0.1molNa2CO3溶液中CO的数目小于NA,故A正确;
B.标准状况下,HF不是气体,故无法计算其物质的量,故B错误;
C.1个-OH中含有9个电子,故17g-OH所含电子的数目均为9NA,故C错误;
D.NaHSO4溶液的体积未知,故无法计算其物质的量,故D错误;
故选A。
5.一种离子液体的结构如图所示,其中Z、X、Y、W为原子序数依次增大的短周期元素,W的最外层电子数是内层电子数的3倍。下列说法正确的是( )
A.原子半径:X> Y>Z> W
B.简单气态氢化物的还原性: Y > X
C.Z、Y、W可形成盐
D.该物质中所有原子均满足8电子稳定结构
【答案】C
【分析】已知Z、X、Y、W为原子序数依次增大的短周期元素,W的最外层电子数是内层电子数的3倍,W只能含有2个电子层,最外层含有6个电子,则W为O;Z形成1个共价键,X形成4个共价键,其原子序数均小于O,则Z为H,X为C,Y原子序数小于O大于C,则Y为N,综上所述Z、X、Y、W分别为H、C、N、O;
【详解】A.同一周期从左到右原子半径减小,电子层越多,半径越大,则原子半径:C>N>O>H,即X>Y>W>Z,A错误;
B.同一周期从左到右元素非金属性增强,其简单气态氢化物的还原性减弱,则简单气态氢化物的还原性C>N即X> Y,B错误;
C.Z、Y、W可形成盐,如NH4NO3,C正确;
D.该物质中含有氢原子,氢原子满足2电子稳定结构,该物质中不是所有原子均满足8电子稳定结构,D错误;
故答案为C。
6.常温下,向一元弱碱BOH溶液中滴加一元强酸稀溶液,已知在一元弱碱BOH溶液中存在: c(BOH) +c(B+) =0.1 mol·L-1,溶液中c( BOH)和c(B+)的负对数pc的大小与pOH[ pOH= - lge( OH-)]的关系如图所示。下列有关叙述错误的是( )
A.常温下,当溶液的pOH =5.75时,溶液的pH =8.25
B.常温下,一元弱碱BOH的电离平衡常数约为10-5
C.a点对应的溶液中,一元弱碱BOH的电离程度大于B+的水解程度
D.当溶液的pOH =5.75时,c(OH-) c(BOH),且溶液呈碱性,c(OH-)> c(H+),所以c (H+) MnO。在稀硫酸酸化的MnSO4溶液中滴加1滴催化剂AgNO3溶液,再滴加K2S2O8溶液,实验现象是_______,该反应的离子方程式为_______。
实验(二)探究过二硫酸钾的不稳定性。
已知几种物质的熔、沸点如下表所示:
物质
SO3
SO2
O2
熔点/℃
16.8
-72.7
-218.4
沸点/℃
44.8
10
-182.9
取适量的K2S2O8装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(3)加热前,先通入一段时间N2,当观察到D装置中_______(填实验现象)时点燃酒精灯。
(4)B装置的U形管中收集到的物质是_______(填化学式)。
(5)当A装置的硬质玻璃管中固体完全分解时,停止加热。冷却至室温,然后取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8发生分解的化学方程式_______。
【答案】(1) 单位时间内有效碰撞的次数较少 2Fe3++2I-=I2+2Fe2+ 取实验Ⅱ反应后的溶液于试管中,向其中滴入KSCN溶液,若溶液变为血红色,则证明实验Ⅱ反应后的溶液中含有Fe3+;
(2) 无色溶液变为紫红色 5S2O+2Mn2++8H20= 2MnO+10SO+16H+
(3)出现连续气泡
(4)SO3
(5)2 K2S2O82K2SO4+2SO3+O2
【分析】实验(一)探究过二硫酸钾的强氧化性
实验I在10mL0.1mol/L含淀粉的KI溶液中滴加4mL0.1mol/LK2S2O8溶液,一段时间后,溶液缓慢变蓝色,说明K2S2O8将碘离子氧化为碘单质;在10mL0.1mol/L含淀粉的KI溶液中先滴几滴0.1mol/LFeSO4溶液,再滴加4mL0.1 mol/LK2S2O8溶液,溶液迅速变蓝色,说明FeSO4溶液加快了K2S2O8溶液与KI溶液反应,起催化作用。
实验(二)探究过二硫酸钾的不稳定性
取适量的K2S2O8装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体说明产物含SO3,C中溶液颜色无明显变化,说明没有SO2生成,D中溶液逐渐变蓝色即碘离子变为碘单质,说明产物含有氧化性物质,K2S2O8中存在1个过氧键,O元素从-1价降至-2价,则另一O元素化合价升高,由元素组成可知氧化性物质为O2;
(1)
实验Ⅰ中K2S2O8和KI反应很慢的主要原因是根据碰撞理论分析,单位时间内有效碰撞的次数较少,导致化学反应速率较慢;
故答案为:单位时间内有效碰撞的次数较少;
S2O中含有过氧键,,作氧化剂时-1价的两个氧原子变为-2价,1mol S2O会得到2mol电子,所以总反应为S2O+2I-=I2+ 2SO,由已知(i)2Fe2+ +S2O=2Fe3++2SO,反应( ii )=总反应-反应( i ),得到反应( ii )为2Fe3++2I-=I2+2Fe2+;设计实验为取实验Ⅱ反应后的溶液与试管中,向其中滴入KSCN溶液,若溶液变为血红色,则证明实验Ⅱ反应后的溶液中含有Fe3+;
故答案为:2Fe3++2I-=I2+2Fe2+;取实验Ⅱ反应后的溶液于试管中,向其中滴入KSCN溶液,若溶液变为血红色,则证明实验Ⅱ反应后的溶液中含有Fe3+;
(2)
因为氧化性:S2O> MnO,所以在稀硫酸酸化的MnSO4溶液中滴加1滴催化剂AgNO3溶液,再滴加K2S2O8溶液,K2S2O8溶液会与MnSO4溶液反应生成KMnO4,则实验现象是无色溶液变为紫红色;根据题意可知该反应的反应物为S2O与Mn2+,产物为MnO和SO,利用氧化还原反应原理配平,得到该反应的离子方程式为5S2O+2Mn2++8H20= 2MnO+10SO+16H+;
故答案为:无色溶液变为紫红色;5S2O+2Mn2++8H20= 2MnO+10SO+16H+;
(3)
加热前,先通入一段时间N2,当观察到D装置中出现连续气泡时,说明装置中空气排尽,则开始点燃酒精灯。
故答案为:出现连续气泡;
(4)
实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,说明产物为SO3,则B装置的U形管中收集到的物质是SO3;
故答案为:SO3;
(5)
残留固体溶解后滴加BaCl2溶液和盐酸,产生白色沉淀,说明含有硫酸根,根据分析知分解产物为硫酸钾、三氧化硫和氧气,其分解的化学方程式为2 K2S2O82K2SO4+2SO3+O2;
故答案为:2 K2S2O82K2SO4+2SO3+O2。
四、原理综合题
10.我国科学家研制出催化剂将CO2转化为烃的效率提高1000倍。已知:在某催化剂作用下,CO2和H2发生反应如下:4CO2(g) +13H2(g)C4H10(g) +8H2O(g) △H
(1)已知C4H10(g)、H2(g)的燃烧热△H分别为-2900 kJ·mol-1、-285.8 kJ·mol-1,H2O(I)=H2O(g) △H3= +44 kJ·mol-1.则△H=_______kJ·mol-1。
(2)在恒容恒温条件下,向密闭容器中充入CO2、H2,加入合适催化剂发生上述反应,下列情况表明反应达到平衡状态的是_______(填字母)。
A.混合气体密度保持不变 B.气体总压强保持不变
C.气体平均摩尔质量保持不变 D.混合气体中C4H10体积分数保持不变
(3)在密闭容器中充入适量CO2和H2,发生上述反应,单位时间内CO2的转化率与温度、催化剂的关系如图1所示。
①催化效率,Cat2_______(填“>”、“”、 “ 未达到 该反应为放热反应,但是a点随着反应的进行,二氧化碳的转化率在增大,则a未达到平衡 b点温度之后CO2转化率降低可能的原因为若b点反应未达平衡,温度升高可能可能导致催化剂失去活性;若b点反应达到平衡,正反应放热,温度升高平衡逆向移动使得CO2平衡转化率降低
(4) Cat1;②由第一问可知,该反应为放热反应,但是a点随着反应的进行,二氧化碳的转化率在增大,则a未达到平衡;b点温度之后CO2转化率降低可能的原因为若b点反应未达平衡,温度升高可能可能导致催化剂失去活性;若b点反应达到平衡,正反应放热,温度升高平衡逆向移动使得CO2平衡转化率降低;
(4)①该可逆反应的正反应是气体分子数减小的反应,相同温度下,增大压强,CO2平衡转化率增大,所以p2
相关试卷
这是一份四川省内江市2022-2023学年高二下学期期末检测理综化学试题(含解析),共17页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
这是一份四川省南充市2023届高三下学期三模理综化学试题(含解析),共17页。试卷主要包含了单选题,原理综合题,工业流程题,结构与性质,有机推断题等内容,欢迎下载使用。
这是一份2023届陕西省安康市高三二模理综化学试题含解析,共16页。试卷主要包含了单选题,工业流程题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。









