所属成套资源:2024届高三化学一轮复习培优训练题(67份)
2024届高三化学一轮复习培优--原子结构与元素周期表训练
展开
这是一份2024届高三化学一轮复习培优--原子结构与元素周期表训练,共13页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
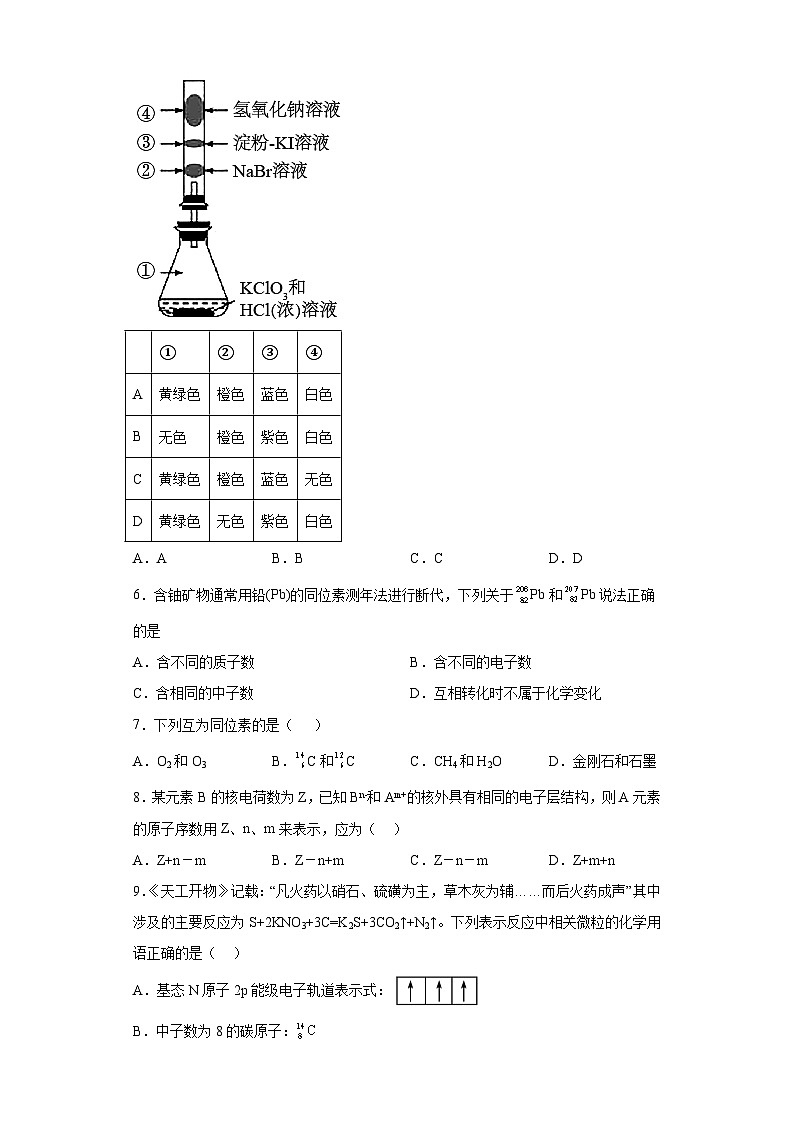
2024届高三化学一轮复习培优--原子结构与元素周期表训练学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.下列有关元素周期表的说法正确的是( )A.元素周期表有18个族B.元素周期表有七个周期C.IA族的元素全部是金属元素D.短周期是指第一、二、三、四周期2.下列关于微观粒子的说法正确的是A.只有离子能构成物质B.分子之间有间隔,原子之间没有间隔C.分子和原子都在不停运动D.分子和原子在化学变化中都能够再分3.全国科学技术名词审定委员会于2007年3月21日宣布:111号元素(符号为Rg)的中文名称为“錀”(读音为伦)。下列说法正确的是A.111号元素的质量数为111 B.111号元素是过渡元素C.111号元素是非金属元素 D.111号元素位于第六周期、第IVA族4.下列实验现象与实验操作不相匹配的是 实验操作实验现象A向淀粉碘化钾溶液中通入氯气溶液变蓝B将新打磨的铝丝放入浓硝酸中浸泡后,插入CuSO4溶液中铝丝上析出大量红色固体C向漂白粉中加入适量较浓硫酸产生黄绿色气体D向Fe(NO3)2和KSCN的混合溶液中滴入几滴稀硫酸溶液变红A.A B.B C.C D.D5.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是 ①②③④A黄绿色橙色蓝色白色B无色橙色紫色白色C黄绿色橙色蓝色无色D黄绿色无色紫色白色A.A B.B C.C D.D6.含铀矿物通常用铅(Pb)的同位素测年法进行断代,下列关于Pb和Pb说法正确的是A.含不同的质子数 B.含不同的电子数C.含相同的中子数 D.互相转化时不属于化学变化7.下列互为同位素的是( )A.O2和O3 B.C和C C.CH4和H2O D.金刚石和石墨8.某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )A.Z+n-m B.Z-n+m C.Z-n-m D.Z+m+n9.《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅……而后火药成声”其中涉及的主要反应为S+2KNO3+3C=K2S+3CO2↑+N2↑。下列表示反应中相关微粒的化学用语正确的是( )A.基态N原子2p能级电子轨道表示式:B.中子数为8的碳原子:C.S2-的结构示意图:D.CO2的电子式:10.下列说法正确的是A.和互为同位素B.和的相互转化是物理变化C.金刚石、石墨、互为同素异形体D.和两种核素的中子数相等 二、实验题11.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性和强挥发性。他们参观生产过程后,绘制了如图装置简图。请你参与分析讨论:(1)图中仪器B的名称:_____,冷却水从_____进,_____出。(2)烧杯A的作用_____________,C中冰的作用是_____。12.碘化钠可用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等,实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼易被空气氧化。回答下列问题:(1)水合肼的制备①制取次氯酸钠和氢氧化钠的混合液。盛装氢氧化钠溶液的仪器名称是__,正确的连接顺序为__(按气流方向,用小写字母表示)。②将尿素滴入次氯酸钠和氢氧化钠的混合液中,发生反应CO(NH2)2+NaClO+2NaOH=N2H4·H2O+NaCl+Na2CO3,反应中作氧化剂的是__[填“NaClO”或“CO(NH2)2”]。(2)碘化钠的制备I.向锥形瓶中加入40mL6mol·L-1NaOH溶液,搅拌、冷却,加入25.4g单质碘,打开恒温磁力搅拌器,保持60~70℃至反应完全;II.继续加入稍过量的N2H4·H2O,还原生成的NaIO和NaIO3,得到NaI溶液,同时释放出一种空气中主要成分的气体;III.将溶液蒸发浓缩、冷却结晶过滤、洗涤、干燥,得产品25.5g。①步骤I反应完全的现象是__。②步骤II中IO-参与反应的离子方程式为__。③实验发现,水合肼实际用量比理论值偏高,可能的原因是__。④测定产品中NaI含量的实验步骤如下:a.称取10.00g产品并溶解,在500mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中,然后加入足量FeCl3溶液,充分反应后,再加入M溶液作指示剂;c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(化学方程式为2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次.测得平均消耗Na2S2O3标准溶液的体积为15.00mL。则M为__(写名称);该产品中NI的质量分数为__。⑤工业上也可用硫化钠或铁屑还原碘酸钠来制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因__。13.按下面的实验过程填空:浅绿色FeBr2溶液黄色液体a.________色,b. ________色,c. ________色,写出上述第1、2步反应的化学方程式:________________________,________________________。14.指出下列仪器使用或实验的第一步操作(1)气体的制取与性质探究实验_________________。(2)用淀粉碘化钾试纸检验氯气__________________。(3)使用时第一步操作必须检查是否漏水的常见仪器有________________。15.海水中有丰富的资源,多种多样的海洋动植物,丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、SO、Ca2+、Mg2+、Na+等,都是重要资源。开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:请根据以上信息回答下列问题:(1)图中A是粗盐,初步提纯后的粗盐中含有Ca2+、Mg2+、SO等杂质,精制时所用的试剂为①盐酸②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,下列试剂添加顺序合理的是_______。A.②③④① B.③④②① C.④③②① D.③②④①(2)得到的精盐溶于水通电能得到氯气,氯气溶于水后能得到氯水,新制氯水中含有多种微粒,其中存在的分子是_______,_______,_______(写化学式)。(3)将制备得到的氯气通入紫色石蕊试液中:实验现象导致变色的物质石蕊试液从紫色逐渐变为_______色HCl随后溶液逐渐变为无色_______继续通Cl2,溶液从无色逐渐变为_______色_______(4)图中B是苦卤,写出I中发生的离子方程式_______。(5)II中通入空气,吹出Br2,从水溶液中分离出来是基于溴单质具有_______性。用二氧化硫的水溶液吸收Br2的反应中体现了二氧化硫的_______性。(6)蒸馏原理主要依据是各组分的以下哪点不同_______。A.原子量 B.凝固点 C.沸点 D.溶解度(7)图是具体的蒸馏装置,指出图中的两处错误:_______、_______。单质碘从海产品海带中提取,流程如下图。(8)实验室里进行过滤、蒸发时,都要用到的仪器是_______。A.烧杯 B.玻璃棒 C.蒸发皿 D.酒精灯(9)检验滤液中是否含有I-,所用试剂不合理的是_______。A.淀粉溶液和氯水 B.硝酸酸化的硝酸银溶液C.氯水和四氯化碳 D.溴水和酒精(10)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是_______(阴影部分表示溶有碘)
参考答案:1.B【分析】元素周期表有七个横行,分属七个周期,18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,短周期包含一、二、三周期,ⅠA族包含氢元素与碱金属元素.【详解】A.元素周期表有18个纵行,其中包括七个主族、七个副族、一个0族和VIII族共16个族,故A错误;B.元素周期表有七个横行,即七个周期,故B正确;C.ⅠA族的元素除H元素外都是金属元素,故C错误;D.短周期是指第一、二、三周期,故D错误;答案选B。2.C【详解】A.不是只有离子能构成物质,分子、原子均能构成物质,故A法错误;B.分子之间有间隔,原子之间也有间隔,故B错误;C.分子和原子均是在不断的运动的,故C正确;D.化学变化中,分子可分,而原子不能再分,故D错误;故选C。3.B【详解】A. 111号元素的质子数为111,故A错误;B. 111号元素位于第七周期、第IB族,是过渡元素,故B正确;C. 111号元素是过渡元素,是金属元素,故C错误; D. 111号元素位于第七周期、第IB族,故D错误;故答案为:B4.B【详解】A.氯气与碘化钾溶液反应生成碘单质,碘遇淀粉变蓝,A不符题意;B.铝遇浓硝酸在常温下发生钝化,再插入CuSO4溶液中无明显变化,B符合题意;C.漂白粉的主要成分是次氯酸钙和氯化钙,在酸性条件下ClO-和Cl-发生氧化还原反应生成黄绿色的氯气,C不符题意;D.溶液中H+和存在时具有较强氧化性,可将Fe2+氧化为Fe3+,由于溶液中还有KSCN,所以溶液变红,D不符题意。答案选B。5.A【详解】常温下氯酸钾与浓盐酸反应放出 Cl2 , Cl2 的颜色是黄绿色,①处充满黄绿色的 Cl2 ;Cl2 进入玻璃管后与②处 NaBr 溶液发生置换反应生成 Br2 ,溴的水溶液颜色为橙色,所以②处的白色棉球变为橙色;Cl2 和③处 KI 溶液反应置换出 I2 ,淀粉溶液遇 I2 变蓝,③处棉球变为蓝色;④处 Cl2 与 NaOH 溶液反应生成 NaCl 、 NaClO ,棉球本身是白色的,所以④处的颜色为白色;故①②③④的颜色分别为:黄绿色;橙色;蓝色;白色;答案选A。6.D【详解】A.Pb和Pb的质子数都为82,故A错误;B.Pb和Pb的质子数都为82,质子数=核外电子数,核外电子数也都为82,故B错误;C.Pb的中子数为206-82=124,Pb的中子数为207-82=125,中子数不同,故C错误;D.Pb和Pb的互相转化不属于化学变化,化学变化过程中原子核不发生变化,故D正确;故选D。【点睛】本题的易错点为D,要注意同位素间的转化,不属于化学变化,属于核变化。7.B【详解】A项、O2和O3都是氧元素组成的单质,互为同素异形体,故A错误;B项、质子数相同,中子数不同的原子互为同位素,C和C的质子数都为6,中子数分别为8和6,两者互为同位素,故B正确;C项、同位素是原子的互称,CH4和H2O为两种不同的分子,故C错误;D项、金刚石和石墨都是碳元素组成的单质,互为同素异形体,故D错误;故选B。【点睛】质子数相同,中子数不同的原子互为同位素,同位素是原子的互称,不是分子或离子的互称是正确理解同位素的关键,也是解答的关键。8.D【详解】原素的原子序数=质子数=核外电子数,设A元素的原子序数为x,Bn-和Am+的核外具有相同的电子层结构,说明两种离子的核外电子数目相等,所以,Z+n=x-m,由此可以得出x= Z+m+n,D正确。答案选D。 9.A【详解】A.N是7号元素,根据构造原理可知N原子核外电子排布是1s22s22p3,原子核外电子总是尽可能成单排列,而且自旋方向相同,这种排布使原子的能量最低,处于稳定状态,p能级有3个轨道,故基态N原子2p能级电子轨道表示式:,A正确;B.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和,所以中子数为8的碳原子质量数是14,可表示为:,B错误;C.S是16号元素,原子核内有16个质子,S原子得到2个电子变为S2-,其结构示意图为:,C错误;D.CO2分子中,C原子与2个O原子分别形成2对共用电子对,从而使分子中各个原子都达到最外层8个电子的稳定结构,其电子式为 ,D错误;故合理选项是A。10.C【详解】A.和是由氯元素的两种不同核素组成的氯气分子,故A错误;B.和是两种不同分子,相互转化是化学变化,故B错误;C.金刚石、石墨、都是由C元素组成的不同单质,互为同素异形体,故C正确;D.的中子数是8、的中子数是7,两种核素的中子数不相等,故D错误;选C。11. 冷凝管 m n 水浴加热,使液体受热均匀 冷凝溴蒸汽【分析】溴具有强挥发性,工业溴利用热水浴加热形成溴蒸汽,再利用冷凝管冷凝,冷凝水的通入方向与溴蒸汽的流动方向相反,则冷凝水从m口进水n口流出,为防止溴挥发,用冰进行冷却收集,Br2有毒性,用氢氧化钠溶液进行尾气处理,据此分析结合溴单质的性质解答。【详解】(1)根据图示,仪器B的名称是冷凝管;冷却水通入的方向与蒸汽流动的方向相反,则从m进,n口出;(2)根据分析,烧杯A的作用水浴加热,使液体受热均匀;由于溴沸点低、具有强挥发性,则C中冰的作用是冷凝溴蒸汽。12. 三颈烧瓶 ecdabf NaClO 无固体残留且溶液呈无色 N2H4•H2O+2IO-=2I-+N2↑+3H2O 水合肼能与水中溶解的氧气反应 淀粉 94.5% 水合肼还原法中N2H4•H2O被氧化后生成N2和H2O,不会引入杂质【分析】利用如下装置制备碘化钠,首先制取次氯酸钠和氢氧化钠的混合液,将尿素滴入次氯酸钠和氢氧化钠的混合液中,发生反应CO(NH2)2+NaClO+2NaOH=N2H4·H2O+NaCl+Na2CO3,制备了水合肼,然后向锥形瓶中加入NaOH溶液,搅拌、冷却,加入25.4g单质碘,打开恒温磁力搅拌器,保持60~70℃至反应完全;继续加入稍过量的N2H4·H2O,还原生成的NaIO和NaIO3,得到NaI溶液,将溶液蒸发浓缩、冷却结晶过滤、洗涤、干燥,得NaI。【详解】(1) ①根据仪器的特征,盛装NaOH溶液的仪器名称是三颈烧瓶,用装置C制备氯气,用装置B中的饱和食盐水除去其中的HCl气体,为保证除杂充分,导气管长进短出,氯气和NaOH在装置A中反应,由装置D吸收未反应的氯气,防止污染空气,由此导气管连接顺序为ecdabf,故答案为:三颈烧瓶;ecdabf;②由②发生的反应方程式可看出: NaClO中的Cl从+1价降低成NaCl中的-1价,而CO(NH2)2中的N从-3价升高到了N2H4·H2O中的-2价,所以NaClO得电子发生还原反应,NaClO作氧化剂,故答案为: NaClO;(2) ①步骤Ⅰ发生反应:6NaOH +3I2= 5NaI +NaIO3+3H2O,反应完全时固体全部反应完,且生成物均为无色,故答案为:无固体残留且溶液呈无色;②根据流程可知,副产物IO-与水合肼发生反应生成碘离子和氮气,反应的离子方程式为N2H4•H2O+2IO-=2I-+N2↑+3H2O,故答案为:N2H4•H2O+2IO-=2I-+N2↑+3H2O;③水中含有溶解氧,而水合肼会与水中的溶解氧反应,所以水合肼实际用量会比理论值偏高,故答案为:水合肼能与水中溶解的氧气反应;④实验中滴定单质碘,用淀粉作指示剂,即M为淀粉;根据碘元素守恒,2I-~I2~2Na2S2O3,则n(NaI) =n(Na2S2O3),故样品中NaI的质量为,所以其质量分数为,故答案为:淀粉;94.5%;⑤由题可知,N2H4•H2O被氧化后的产物为N2和H2O,未引入杂质,所以水合肼还原法制得的产品纯度更高,故答案为:水合肼还原法中N2H4•H2O被氧化后生成N2和H2O,不会引入杂质。13. 棕黄 橙红 蓝 2FeBr2+3Cl2═2FeCl3+2Br2 2FeCl3+2KI═2FeCl2+2KCl+I2【详解】FeBr2溶液中通入足量氯气,反应生成FeCl3、Br2,加四氯化碳萃取后,溴溶解在四氯化碳中,且分层后在下层,而上层为氯化铁溶液,氯化铁与KI发生氧化还原反应生成碘,淀粉遇碘变蓝,由上述分析可知,上层a(氯化铁溶液)为棕黄色,下层b(溴的四氯化碳溶液)为橙红色,c为蓝色,上述反应的化学方程式为2FeBr2+3Cl2=2FeCl3+2Br2、2FeCl3+2KI=2FeCl2+2KCl+I2。14. 检验装置的气密性 用蒸馏水润湿试纸 容量瓶、滴定管、分液漏斗【详解】(1)气体的制取与性质探究实验中,需尽可能防止空气进入装置或气体漏出,因此第一步操作是检验装置的气密性;(2)用淀粉碘化钾试纸检验氯气的实验原理是利用氯气氧化碘离子,若试纸是干燥的,则该反应不能完成,因此第一步操作是用蒸馏水润湿试纸;(3)带有活塞的实验仪器在使用时,需先进行检漏,常见仪器有:容量瓶、滴定管、分液漏斗。15.(1)AD(2) Cl2 HClO H2O(3) 红 HClO 浅黄绿 Cl2(4)(5) 挥发 还原(6)C(7) 冷凝水未下进上出 温度计水银球未在支管口处(8)B(9)D(10)D 【详解】(1)粗盐含有、、,用足量的除去,用足量的除去,用足量的除去,添加试剂时,还要除去足量的试剂,所以溶液既可以除去,液可以除去足量的,所以要先加入足量的,再加入足量的,最后溶液中剩余的和,用盐酸除去,所以试剂添加顺序为:②③④①或者③②④①,选AD;(2),为强电解质,为弱电解质,所以氯水中的分子为:、和;(3)氯气通入紫色石蕊试液中,与反应,生成先酸性,石蕊变红,而具有强氧化性,红色石蕊褪色,再继续通入过量的,形成绿水,溶液变成浅绿色。(4)苦卤时浓缩海水,含有,通入,发生反应:,得到含有的溶液;(5)因为具有挥发性,所以可以用空气将其吹出,再用二氧化硫的水溶液吸收,发生反应:,体现了二氧化硫的还原性;(6)蒸馏原理主要依据是各组分的沸点不同且相差较大,故选C;(7)蒸馏时,冷凝水未下进上出,温度计水银球未在支管口处;(8)过滤时,要用玻璃棒引流,蒸发时要用玻璃棒搅拌,所以过滤和蒸发操作时都需要用道玻璃棒;(9)检验滤液中是否含有: A.淀粉溶液和氯水,溶液变蓝色B. 硝酸酸化的硝酸银溶液,生成黄色沉淀C.氯水和四氯化碳,溶液分层,下层为紫红色D.溴水和酒精,无明显现象。故选D;(10)因为四氯化碳的密度比水大,不溶于水,碘单质在四氯化碳中的溶解度大于在水中的溶解度,故溶液分层,下层有颜色,且体积为上层的约,故选D。
相关试卷
这是一份2024届高三化学一轮复习培优--烷烃训练,共16页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习培优-糖类训练,共22页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习培优--卤代烃训练,共19页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。








