

所属成套资源:2023重庆市西南大学附中、重庆育才中学、重庆外国语学校三校高一下学期5月月考及答案(九科)
2023重庆市西南大学附中、重庆育才中学、重庆外国语学校三校高一下学期5月月考化学试题含答案
展开这是一份2023重庆市西南大学附中、重庆育才中学、重庆外国语学校三校高一下学期5月月考化学试题含答案,共10页。试卷主要包含了考试结束后,将答题卡交回,下列图示与对应的叙述相符的是,向容积为2L的密闭容器中加入0等内容,欢迎下载使用。
西南大学附属中学高2025届高一下阶段性检测(二)
化学试题
(满分:100分;考试时间:75分钟)
注意事项:
1.答题前,考生先将自己的姓名、班级、考场/座位号、准考证号填写在答题卡上。
2.答选择题时,必须使用2B铅笔填涂;答非选择题时,必须使用0.5毫米的黑色签字笔书写;必须在题号对应的答题区域内作答,超出答题区域书写无效保持答卷清洁、完整。
3.考试结束后,将答题卡交回(试题卷学生保存,以备评讲)。
可能用到的相对原子质量:H1 Li7 N14 O16 S32 Mg24 Cu64 Fe56 Ba137
一、选择题:本题共14小题,每小题3分,共42分。在每小题所给出的四个选择中,只有一项符合题目要求。
1.“绿水青山就是金山银山”旨在引导社会各界自觉践行绿色生活,共建美丽中国。下列说法错误的是( )
A.水中氮、磷元素过多,造成藻类疯长,消耗水中溶解氧,使水质恶化,会造成水华、赤潮等水体污染问题
B.绿色化学的核心思想是改变“先污染后治理”的观念和做法,减少或消除产品在生产和应用中涉及的有害化学物质
C.合理开发和利用金属资源可通过提高金属矿物的利用率、开发环保高效冶炼方法、防止金属腐蚀、加强废旧金属的回收和再利用、使用替代其他材料等途径
D.、、、均是常见的大气污染物,主要来源于化石燃料的燃烧,可能造成酸雨、雾霾、光化学烟雾等污染
2.下列离子方程式正确的是( )
A.少量通入溶液中:
B.水玻璃中通入少量,
C.尾气用溶液吸收:
D.溶于稀硝酸:
3.在反应:中,可使反应速率增大的措施是( )
①压缩体积 ②升高温度 ③体积不变,通入
④增加碳的量 ⑤移出 ⑥体积不变,通入
⑦恒温恒压,通入
A.①②⑥ B.①②③⑤⑦ C.①②④⑥ D.①②③④⑥
4.三氟化氮()在微电子工业中是一种优良的等离子蚀刻气体,而且在芯片制造、高能激光器方面得到了大量的运用。下表是几种化学键的键能:
化学键 | |||
键能() | 941.7 | 154.8 | 283.0 |
下列有关说法正确的是( )
A.过程吸收154.8kJ能量
B.过程要放出能量
C.反应
D.一旦吸收能量就能发生化学反应
5.一种制备高效漂白剂的实验流程如图所示,反应I中的反应为:,下列说法不正确的是( )
A.产品中可能含有
B.反应II中作氧化剂
C.的漂白原理与新制氯水、84消毒液相同
D.实验室进行结晶操作通常在蒸发皿中进行
6.某兴趣小组探究气体还原,他们使用的药品和装置如下图所示,下列说法不合理的是( )
A B C
A.为了验证A中发生了氧化还原反应,滴入溶液,紫红色褪去,产生白色沉淀
B.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的溶液
C.表明还原性强于的现象是B中蓝色溶液褪色或变浅
D.装置C的作用是吸收尾气,防止污染空气
7.下列实验操作、实验现象和实验结论均正确的是( )
| 实验 | 现象 | 结论 |
A | 用萃取碘水中的 | 溶液分层,上层紫红色,下层无色 | 在中的溶解度更大 |
B | 用玻璃棒蘸取新制氯水滴到pH试纸上 | pH试纸先变红后褪色 | 新制氯水既有酸性,又有漂白性 |
C | 用与稀硝酸反应制备,并用向下排空法收集气体 | 铜片溶解,有无色气体生成,得到蓝色溶液 | 稀硝酸具有强氧化性 |
D | 加热的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | 显碱性 |
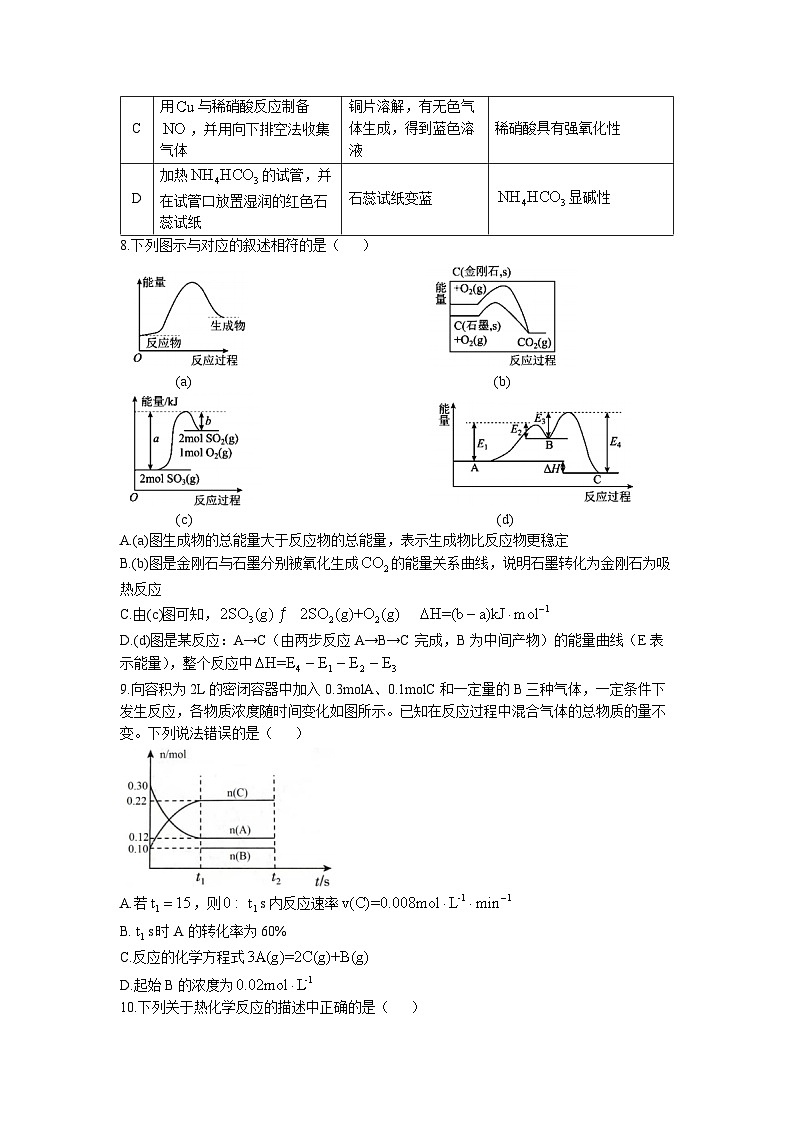
8.下列图示与对应的叙述相符的是( )
(a) (b)
(c) (d)
A.(a)图生成物的总能量大于反应物的总能量,表示生成物比反应物更稳定
B.(b)图是金刚石与石墨分别被氧化生成的能量关系曲线,说明石墨转化为金刚石为吸热反应
C.由(c)图可知,
D.(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(E表示能量),整个反应中
9.向容积为2L的密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的总物质的量不变。下列说法错误的是( )
A.若,则s内反应速率
B.s时A的转化率为60%
C.反应的化学方程式
D.起始B的浓度为
10.下列关于热化学反应的描述中正确的是( )
A.稀盐酸和稀溶液发生反应生成1mol液态水放出57.3kJ的热量,则
B.25°C、101kPa时,的燃烧热为,则
C.25°C、101kPa时,已知、、的燃烧热为、、,则
D.已知500°C、30MPa下, ,现将1.5mol和足量的在此条件下充分反应,放出热量为46.2kJ
11.已知:。某化学小组欲探究该反应过程中浓度、温度对化学反应速率的影响,进行如下表实验(忽略溶液体积变化)。实验中测定酸性溶液褪色的时间。下列说法错误的是( )
编号 | 酸性溶液体积/mL | 溶液体积/mL | 水的体积/mL | 反应温度/℃ | 时间/min |
I | 2 | 2 | 0 | 20 | 2.1 |
Ⅱ | 2 |
| 1 | 20 | 5.5 |
Ⅲ | 2 | 0 | 50 | 0.5 |
A.,
B.实验I、III的目的是探究温度对化学反应速率的影响
C.若加入酸性溶液过量,将不能达到实验目的
D.实验III中用浓度变化表示的反应速率
12.应用下列装置测定氨气的组成。实验利用了氨气能还原氧化铜生成氮气、铜和水的原理。实验后测得装置D增重ag,用排水法测量得的体积为bL(已折算成标准状况)。下列有关实验描述正确的是( )
A.装置A用于制备氨气,可用加热氯化铵固体的装置代替
B.装置E的作用是防止水蒸气进入装置D中,若撤去装置E,则测得氮氢比偏大
C.装置B的作用是干燥氨气,可替换成无水氯化钙
D.由实验数据可以计算得到氨气分子中的氮氢个数比为
13.地球上99%的溴元素以的形式存在于海水中,因此溴被称为“海洋元素”。从海水中提取溴的工艺流程如图:
下列说法错误的是( )
A.经操作I后剩余溶液可返回过程I循环利用
B.过程Ⅱ通入热空气吹出,利用了溴的挥发性
C.过程III的离子方程式是
D.理论上过程III、IV消耗的、的物质的量之比为1:1
14.利用某分子筛作催化剂,可脱除废气中的和,生成两种无毒物质。其反应历程如图所示,下列说法正确的是( )
A.反应过程中、之间的反应是氧化还原反应
B.上述历程的总反应可以为:
C.在③反应中,X是
D.是反应过程中的催化剂
二、非选择题:本题共4个大题,共58分。
15.(16分)已知甲、乙、丙为常见单质,其中甲、乙所含元素都是第三周期的元素。A、B、C、D、E、F、G、X均为常见的化合物,B和乙均为淡黄色固体,丙是空气的主要成分之一。在一定条件下,各物质相互转化关系如下图所示:
(1)甲所含元素在周期表中的位置为___________,写出B的电子式___________。
(2)G的水溶液和固体C用于测定中和热时,测得的中和热△H___________(填“偏大”“偏小”或“无影响”)。
(3)已知1mol转化为1mol会放出98kJ的热量,写出32g和丙反应生成的热化学方程式___________。假如实际生产中1mol 与足量的丙反应放出的热量约为24.5kJ,则F的转化率为_________。
(4)关于的反应,下列说法正确的是___________。
A.该反应反应物断开化学键吸收的总能量比生成物形成化学键放出的总能量少
B.选择优良的催化剂降低正反应反应和逆反应的活化能,有利于减少过程中的能耗
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
(5)一种与E含相同元素的化合物在酸性条件下可以生成乙和F,写出该离子反应方程式__________________;盛装乙的试管可用热的烧碱溶液清洗,反应原理是______________________(用化学方程式表示)。
16.(15分)硼酸()是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含、及少量、)为原料生产硼酸及轻质氧化镁的工艺流程如下:
已知:
回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式________________。
(2)“滤渣1”的主要成分有________(填化学式)。为检验“过滤1”后的滤液中是否含有离子,可选用的化学试剂是________________(填化学式)。
(3)已知的电离方程式为,可知为_______元弱酸,请写出与足量溶液反应的离子方程式________________;“过滤2”前,将溶液pH调节至3.5的目的是________________。
(4)“沉镁”后分离生成的沉淀的操作为___________,母液经加热后可返回___________
(填“溶浸”“吸收”或“沉镁”)工序循环使用。高温焙烧碱式碳酸镁可制备轻质氧化镁,写出化学方程式_________________________________。
17.(16分)实验室用粗锌(含少量铜、硫化亚铁)和稀硫酸反应制备氢气,用氢气还原硫酸锂可以制备疏化锂,实验装置如下。已知:硫化锂易潮解,在加热条件下易被空气中的氧气氧化。
请回答下列问题:
(1)按气流从左至右,装置的连接顺序是c→_________(按气流方向,填小写字母,部分装置可重复利用)。
(3)组装仪器后,加药品之前的实验操作是_________,利用B装置还可制备的常见气体有_________(填序号)。
A. B. C. D.
(3)装置C的作用是________________________________________。
(4)若装置A中只有两种产物生成,请写出反应的化学方程式________________________。
(5)采用E装置对装置B中混合物进行分离,再将滤液进行蒸发浓缩、降温结晶可得到副产物皓矾晶体。采用E装置对装置B中混合物进行分离的目的是_____________________。
(6)实验小组欲探究产品的成分,现进行如下实验操作。取少量等质量的两份样品:一份滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色,加热后又恢复红色;另一份滴加盐酸酸化的溶液,产生白色沉淀。(已知:易溶于水)
I. 由上述实验可知,样品中含有_____、_____杂质(填化学式)。
II. 若产品含上述实验所检测出的杂质,为检测产品纯度,取100g样品加入足量溶液,充分反应后,过滤、洗涤、干燥得到固体24.03g,将固体在空气中加热,固体质量变为25.63g,则测得样品中两种杂质的物质的量之比为_____。
18.(11分)大气环境中的减量化排放受到国内外广泛关注。利用碳还原的反应为
。回答下列问题:
(1)以上反应可分为如下三步反应方程:
第一步: 快反应
第二步: 快反应
第三步: 慢反应
I.物质X为__________(填化学式)。在这三步反应中第__________(填“一”“二”“三”)步是该反应的决速反应。
II.下列关于活化能说法正确的是__________。
A.增大压强使容器容积减小,单位体积内活化分子数目增多,化学反应速率加快
B.升高温度和使用催化剂,均能降低反应的活化能,使得活化百分数增大,加快化学反应速率
C.催化剂可以改变反应历程
D.第一步中与的碰撞都是有效碰撞
(2)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入、、,通入使其浓度达到。不同温度下,测得第2小时去除率如图所示:
I. 据图分析,温度490°C以下,三种情况下反应的活化能最小的是__________(用a、b、c表示);、去除效果比更好,其依据是______________。
II. 在、490°C条件下0~2h内的平均反应速率________,2h时反应器中的浓度为______________。
高2025级高一下阶段性检测(二)化学参考答案
一、选择题(每个3分,共42)
1 | 2 | 3 | 4 | 5 | 6 | 7 |
D | C | A | C | B | A | B |
8 | 9 | 10 | 11 | 12 | 13 | 14 |
B | A或者C | C | D | D | C | B |
二、填空题(共4个大题,58分)
15.(16分)
(1)第三周期 ⅠA族 (2分)(2分)
(2)偏大(2分)
(3) (可以为n倍)(2分) 25%(2分)
(4)AB(2分)
(5) (2分)
(2分)
16.(15分)
(1)(2分)
(2) (2分)(2分)
(3)一(1分)(2分)使转化为,促进析出(2分)
(4)过滤(1分)溶浸(1分) (2分)
17.(16分)
(1)或(2分)
(2)检查装置气密性(2分)AD(2分)
(3)除去B中产生的气体(2分)
(4) (2分)
(5)防止过滤过程中因温度降低,皓矾晶体析出造成损失(2分)
Ⅰ.、 (每空1分,共2分)
Ⅱ.10:1或者1:10(2分)
18.(11分)
(1)I. (1分) 三 (1分) II. AC(2分)
(2)I. a (1分) 相同温度下, 去除率更高 (2分)
相关试卷
这是一份重庆市育才中学、万州高级中学及西南大学附中2024届高三上学期12月三校联考化学试题(无答案),共9页。试卷主要包含了考试结束后,将答题卡交回,已知,下列离子方程式书写正确的是,金刚砂等内容,欢迎下载使用。
这是一份2024重庆市育才中学校、西南大学附中、万州中学高二上学期12月联考化学试题含解析,文件包含重庆市育才中学校西南大学附中万州中学2023-2024学年高二上学期12月联考化学试题含解析docx、重庆市育才中学校西南大学附中万州中学2023-2024学年高二上学期12月联考化学试题无答案docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
这是一份重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题,共11页。试卷主要包含了考试结束后,将答题卡交回,5 Cu-64 I-127,已知室温时,某一元碱在水中有0,已知反应是可逆反应,、、的所有电离平衡常数如下表等内容,欢迎下载使用。












