

云南省楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考化学试题(Word版含答案)
展开楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),共8页
试题分值:100分,考试时间:120分钟
注意事项:
1.答卷前,考生务必将自己的姓名、学号、班级写在答题卷上。
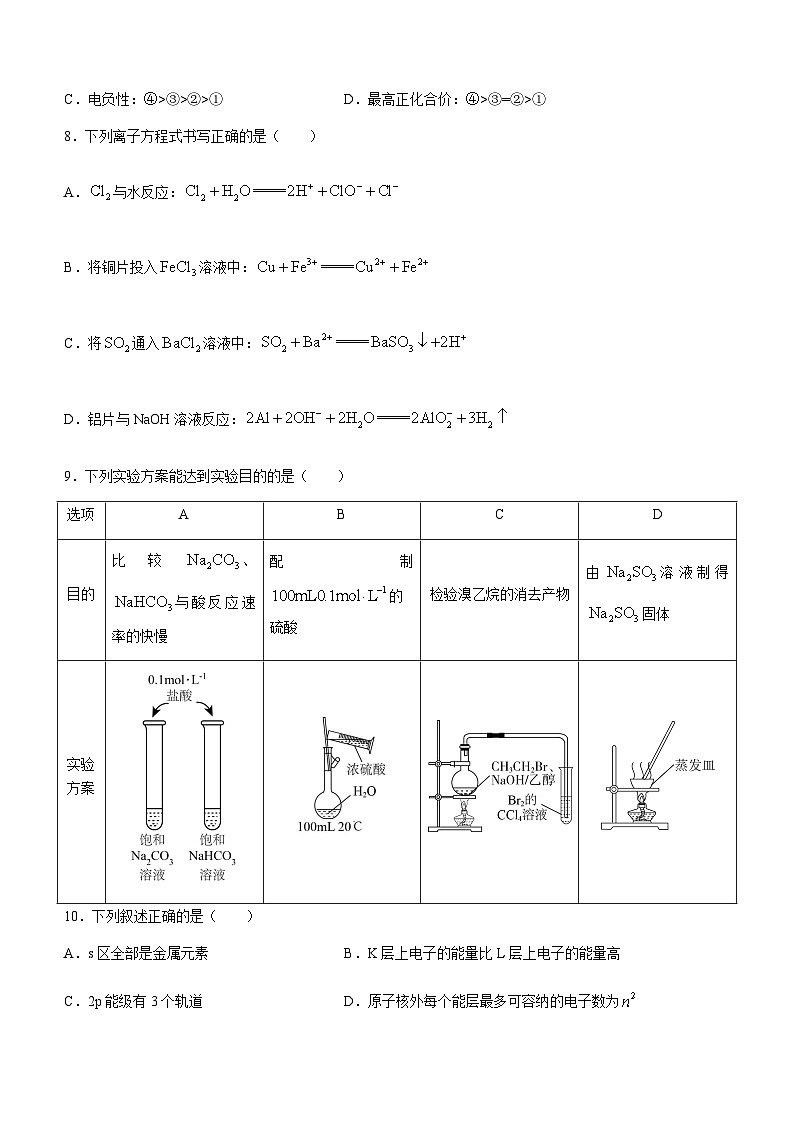
2.第Ⅰ卷和第Ⅱ卷各题均须按规定要求在答题卡上作答,题号要对应,填涂要规范。
可能用到的相对原子质量:
H-1 Li-7 C-12 O-16 P-31 K-39 Fe-56 Cu-64
第Ⅰ卷(选择题 共42分)
一、选择题(每小题只有一个选项符合题意,共21题,每小题2分共42分)
1.下列物质间的转化不能一步完成的是( )
A. B. C. D.
2.下列说法正确的是( )
A.在水溶液中电离:
B.Cu元素位于元素周期表的ds区
C.次氯酸的结构式:
D.的电子式:
3.仪器分析技术的发展对于化学的进步有重要作用,以下说法不正确的是( )
A.原子光谱是不连续光谱,可用于鉴定氢元素
B.X射线衍射法是鉴别晶体和非晶体最科学的方法
C.利用质谱可以确定有机物的立体分子结构
D.红外光谱可以测定未知物中所含化学键和官能团
4.正确佩戴口罩能有效降低新冠疫情传播风险。下列说法正确的是( )
A.一次性防尘口罩可防烟、雾,烟、雾的分散质是空气
B.氯气泄漏时,可戴上用氨水润湿过的口罩
C.古人使用蚕丝巾遮盖口鼻,蚕丝巾的主要成分是蛋白质
D.医用口罩过滤层由聚丙烯熔喷布构成,熔喷布是天然高分子材料
5.类比法是化学学习中的常用方法,下列类比关系正确的是( )
A.干冰是分子晶体,则二氧化硅也是分子晶体
B.苯不能使酸性溶液褪色,则甲苯也不能使酸性溶液褪色
C.乙醇与浓硫酸在加热时能脱水生成乙烯,则丙醇与浓硫酸在加热时也能脱水生成丙烯
D.分子式为的芳香族化合物的同分异构体有4种,则分子式为的芳香族化合物的同分异构体也是4种
6.下列关于有机化合物的说法正确的是( )
A.石油的分馏、煤的干馏、煤的气化和液化均属于物理变化
B.聚合物()可由单体和加聚制得
C.香叶醇()能发生加成反应不能发生取代反应
D.油脂、淀粉、纤维素、蛋白质均为高分子化合物
7.现有四种元素的基态原子的电子排布式如下:
①;②;③;④
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
8.下列离子方程式书写正确的是( )
A.与水反应:
B.将铜片投入溶液中:
C.将通入溶液中:
D.铝片与NaOH溶液反应:
9.下列实验方案能达到实验目的的是( )
选项 | A | B | C | D |
目的 | 比较、与酸反应速率的快慢 | 配制的硫酸 | 检验溴乙烷的消去产物 | 由溶液制得固体 |
实验方案 |
10.下列叙述正确的是( )
A.s区全部是金属元素 B.K层上电子的能量比L层上电子的能量高
C.2p能级有3个轨道 D.原子核外每个能层最多可容纳的电子数为
11.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.中键的数目为
B.中为杂化的原子数为
C.中S的价层电子对数为
D.甲烷酸性燃料电池中正极有1mol气体反应时转移的电子数目
12.氰化氢(HCN)主要应用于电镀业,可通过制备。下列说法正确的是( )
A.是含有极性键的非极性分子 B.的电子式为
C.HCN分子中键与键的个数比为1:3 D.固态属于共价晶体
13.下列措施或事实能用勒夏特列原理解释的是( )
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.、、HI三者的平衡混合气加压后颜色变深
C.钢铁在潮湿的空气中更容易生锈
D.含有酚酞的氨水中加入少量的氯化铵溶液的颜色变浅
14.下列有关反应热的叙述正确的是( )
A. ,恒温恒容条件下达到平衡后加入X,上述反应的增大
B. ,说明金刚石比石墨稳定
C.已知 , ,则
D.已知 ,则氢气的燃烧热为241.8kJ/mol
15.短周期元素D、E、F、W原子序数依次递增,已知:①D元素的某种同位素通常用于地质年代的鉴定;
②F元素电负性在周期表所有元素中位列第二;③W的各级电离能如图。
下列判断不正确的是( )
A.D、E、F三元素的第一电离能由大到小的顺序是
B.D、E、F三元素的简单氢化物中可形成氢键的有两种
C.元素W在周期表中的位置是第3周期第ⅡA族
D.基态D原子价电子轨道表示式为
16.配合物可用于离子检验,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键
B.配离子为,中心离子为,配位原子为N
C.1mol配合物中含有键
D.该配合物为离子化合物,易电离,1mol配合物电离得到阴阳离子共4mol
17.某金属氟化物材料具有生物医学功能,其晶胞结构如图所示,已知图中A处原子分数坐标为。下列说法错误的是( )
A.该物质的化学式为 B.的配位数为12
C.与距离相等且最近的有6个 D.B处原子分数坐标为
18.有关晶体的结构如图所示,下列说法中不正确的是( )
A.在金刚石晶体中,碳原子与碳碳键个数之比为1:2
B.该气态团簇分子的分子式为EF或FE
C.在NaCl晶体中,距最近的形成正八面体形
D.在晶体中,每个晶胞平均占有4个
19.X、Y、Z、W是原子序数依次增大的短周期主族元素,Y、Z、W位于同一周期,基态W原子的核外电子总数是其最高能级电子数的2倍,它们形成的某种阴离子的结构如图所示。下列说法错误的是( )
A.由X、Y、W三种元素形成的酸都是二元酸
B.该阴离子与形成的化合物是两性物质
C.元素的第一电离能:
D.简单离子半径:
20.一种生产聚苯乙烯的流程如图所示,下列叙述正确的是( )
A.反应①②③原子利用率均为100%
B.等质量的乙苯、苯乙烯、聚苯乙烯完全燃烧,耗氧量相同
C.苯、苯乙烯和乙苯均能使溶液褪色
D.乙苯与完全加成后的产物M的一氯代物有6种
21.常温下,向溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
A.上述溶液中:
B.图中
C.a点对应的溶液中:
D.当加入NaOH溶液的体积为20mL时,溶液中:
第Ⅱ卷(非选择题 共58分)
二、填空题(四个大题,共58分)
22.(14分)
有机物为解决人类面临的资源、能源、环境和健康等问题起到了重要的作用。请回答下列问题:
(1)线型结构酚醛树脂的结构简式为__________。
(2)的系统命名法的名称为__________。
(3)写出丙醛与银氨溶液发生银镜反应的化学方程式__________。
(4)0.1mol某链状经与0.2molHCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,则该经的结构简式为__________。
(5)某有机化合物X经李比希法测得其中碳的质量分数为72.0%,氢的质量分数为6.67%,其余为氧元素,用质谱法分析得知X的相对分子质量为150。根据下列信息确定X的分子结构:图甲为X的核磁共振氢谱,5组峰的面积之比为1:2:2:2:3;图乙为X的红外光谱:X分子苯环上只有一个取代基,且含有两种
官能团。
①X的分子式为__________。
②X中含有官能团的名称为__________。
③1molX与足量氢气完全反应消耗氢气的物质的量为__________mol。
23.(14分)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
,
反应物和产物的相关数据列表如下:
| 海点/℃ | 密度 | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将放入100mL烧杯中,加30mL水溶解,与5mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。
(1)实验中,溶液和浓硫酸添加的顺序为__________。
(2)加入沸石的作用是__________。若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,D仪器的名称是__________,E仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是__________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在__________层(填“上”或“下”)。
(6)本实验中,正丁醛的产率为__________%(结果保留两位小数)。
24.(22分)(Ⅰ)瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。
其结构如图所示:
回答下列问题:
(1)该结构中基态P原子价电子的轨道表示式为__________,核外电子占据最高能级的电子云轮廓图形状为__________。
(2)瑞德西韦组成元素中位于第二周期元素的第一电离能从大到小的顺序为__________,分子中氮原子的杂化类型有__________。
(3)苯酚()是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是__________。
苯酚与甲苯(,熔点℃)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是__________。
(Ⅱ)大力推广磷酸亚铁锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。电极材料以硫铁矿(主要成分,含少量、和)为原料制备,工业流程如图所示。回答下列问题:
(1)分子的空间结构名称为__________,试剂R是一种绿色氧化剂,其中心原子杂化方式是__________。
(2)从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)__________。
(3)若“沉铁”时溶液中,则“沉铁”时pH不能高于__________,[已知:常温下,、、,溶液体积变化忽略不计]。
(4)磷酸亚铁锂()的晶胞结构如图所示:
长方体晶胞的长和宽均为,高为,为阿伏加德罗常数的值,晶体的密度为__________。
25.(8分)利用电化学原理,将、和熔融制成燃料电池,模拟工业电解法来处理含废水,如下图所示;电解过程中溶液发生反应:
(1)甲池工作时,转变成绿色硝化剂Y,Y是,可循环使用。则石墨Ⅱ是电池的__________极;
石墨Ⅰ附近发生的电极反应式为__________。
(2)工作时,甲池内的离子向__________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的和的体积比为__________。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为__________。
楚雄彝族自治州民族中学2022-2023学年高二下学期6月月考
化学试题答案
第Ⅰ卷(选择题 共42分)
一、选择题(每小题只有一个选项符合题意,共21题,每小题2分共42分)
1.D 2.B 3.C 4.C
5.C 6.B 7.A 8.D
9.C 10.C 11.C 12.A
13.D 14.C 15.D 16.B
17.B 18.B 19.A 20.D
21.D
第Ⅱ卷(非选择题 共58分)
二、填空题(四个大题,共58分)
22.(14分)【每空2分】(1)
(2)4-甲基-2-戊醇
(3)
(4)
(5)①;②酮羰基(或羰基)、醚键;③4
23.(14分)【除特殊标记外,其余每空2分】
(1)往溶液中滴加浓硫酸
(2)防止暴沸 冷却后补加
(3)直行冷凝管【1分】 锥形瓶【1分】
(4)检漏
(5)上
(6)51.39%
24.(22分)【每空2分】
(Ⅰ)(1) 哑铃形
(2) 、、sp
(3)分子晶体 苯酚分子间存在氢键
(Ⅱ)(1)V形
(2)在水溶液中存在如下水解平衡:,加如FeO后,,导致溶液中浓度减小,上述平衡正向移动,产生沉淀
(3)5.3
(4)
25.(8分)【除特殊标记外,其余每空2分】
(1)正【1分】
(2)石墨Ⅰ【1分】 1:4
(3)
云南省楚雄彝族自治州2022-2023学年高二下学期期末考试化学试题(解析版): 这是一份云南省楚雄彝族自治州2022-2023学年高二下学期期末考试化学试题(解析版),共21页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量等内容,欢迎下载使用。
云南省楚雄彝族自治州2022-2023学年高二下学期期末考试化学试题(解析版): 这是一份云南省楚雄彝族自治州2022-2023学年高二下学期期末考试化学试题(解析版),共21页。
云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试卷(含答案): 这是一份云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试卷(含答案),共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












