
















所属成套资源:2023版高中化学选择性必修二 物质结构与性质课件+练习
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第二节 分子晶体与共价晶体精品精练
展开
这是一份高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第二节 分子晶体与共价晶体精品精练,文件包含第2节分子晶体与共价晶体pptx、分层作业13分子晶体与共价晶体pptx、分层作业13分子晶体与共价晶体docx等3份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
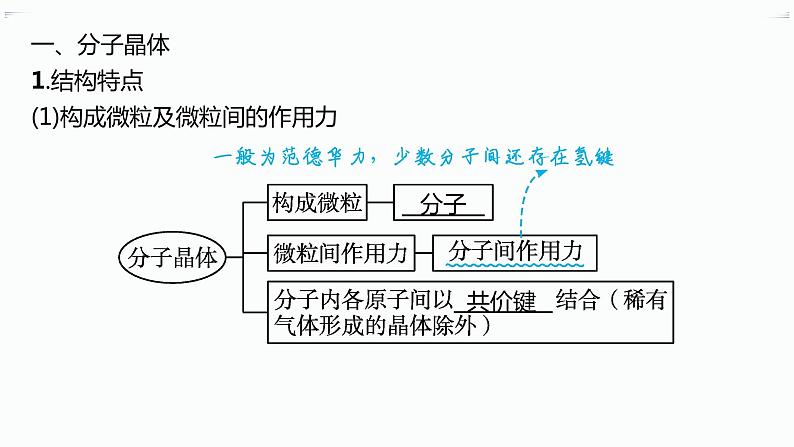
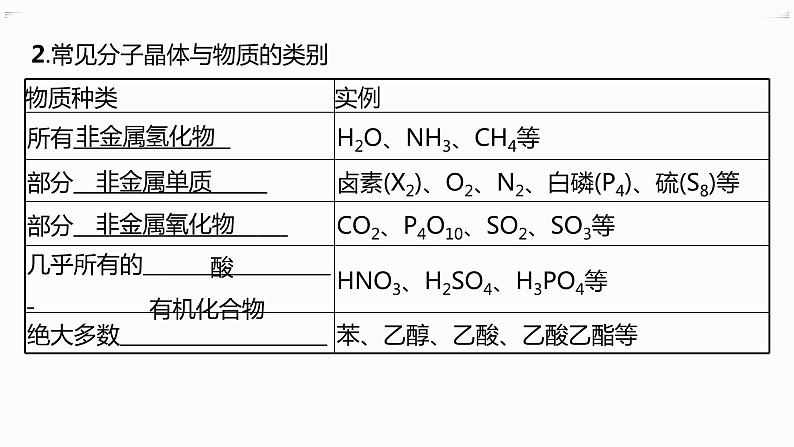
第三章 分层作业13 分子晶体与共价晶体A级 必备知识基础练1.下列关于共价晶体和分子晶体的说法不正确的是( )A.共价晶体硬度通常比分子晶体大B.共价晶体的熔点较高C.有些分子晶体的水溶液能导电D.金刚石、水晶和干冰都属于共价晶体2.下列晶体中,其中任何一个原子都被相邻四个原子包围,以共价键形成正四面体,并向空间伸展成共价键三维骨架结构的是( )A.C60 B.冰C.金刚石 D.水晶3.下列关于分子晶体的说法正确的是( )A.分子晶体中的共价键有方向性,而分子间作用力无方向性B.在分子晶体中一定存在氢键C.冰和Br2都是分子晶体D.稀有气体不能形成分子晶体4.下列关于SiO2和CO2的描述不正确的是( )A.SiO2为共价晶体,CO2为分子晶体B.两者中心原子采取的杂化方式不同C.SiO2和CO2都是非极性分子D.SiO2晶体的熔点比CO2晶体的高5.[2023河北唐山开滦第一中学高二期末]根据下列性质判断,属于共价晶体的是( )A.熔点为2 700 ℃,导电性好,延展性强B.无色晶体,熔点为3 550 ℃,不导电,质硬,难溶于水和无机溶剂C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电D.熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电6.有关晶体的叙述中正确的是( )A.在SiO2晶体中,最小的单元环是由6个硅原子组成的六元环B.在124 g白磷(P4)晶体中,含P—P共价键个数为4NA(设NA表示阿伏加德罗常数的值)C.金刚石的熔、沸点高于晶体硅,是因为C—C键能小于Si—SiD.12 g金刚石中含C原子数与C—C数之比为1∶27.下列各组物质的熔点按由高到低的顺序排列,其中熔点高低均与键能大小有关的是( )A.钠、干冰B.金刚石、晶体硅C.碘化氢、溴化氢D.二氧化硅、二氧化硫8.(1)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3,常温下它们都是易挥发的液体。ClF3的熔、沸点比BrF3的 (填“高”或“低”)。 (2)如图为CO2分子晶体结构的一部分。观察图示可知,每个CO2分子周围有 个与之紧邻的CO2分子;该结构单元平均占有 个CO2分子。 B级 关键能力提升练9.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是( )A.B4C分子是由4个硼原子和1个碳原子构成的B.B4C是一种共价晶体C.B4C是一种分子晶体D.B4C晶体中存在离子键10.[2023江苏连云港灌南、灌云高二联考]X射线主探器单体结构如图,下列有关物质的性质与用途不具有对应关系的是( )A.金属铍有延展性,可作主探器的射线窗B.石英对光线全反射,可作光导材料C.SiO2属于共价晶体,可作耐高温材料D.NaI、CsI遇光易分解,能作为闪烁体11.下列物质的沸点顺序正确的是( )A.CH4>SiH4>GeH4>SnH4B.NH3<PH3<AsH3<SbH3C.H2Te>H2Se>H2O>H2SD.HF>HI>HBr>HCl12.BeCl2熔点较低,易升华,可溶于醇和醚,其化学性质与AlCl3相似,BeBr2与BeCl2晶体类型相同。由此可推测BeCl2( )A.熔融态不导电B.水溶液呈中性C.熔点比BeBr2高D.不与NaOH溶液反应13.我们可以将SiO2的晶体结构想象为在晶体硅的Si—Si共价键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用B.每个O原子也通过Si—O极性键与2个Si原子作用C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成D.在晶体中存在石英分子,故能叫分子式14.下表是某些共价晶体的熔点和硬度,分析表中的数据,判断下列叙述正确的是( )共价晶体金刚石氮化硼碳化硅石英硅锗>3 5003 0002 7001 7101 4101 211硬度109.59.576.56.0A.构成共价晶体的原子种类越多,晶体的熔点越高B.构成共价晶体的原子间的共价键的键能越大,晶体的熔点越高C.构成共价晶体的原子半径越大,晶体的硬度越大D.构成共价晶体的共价键键长越长,晶体的硬度越大15.请按要求填空:(1)C、N元素形成的新材料具有如图所示的结构,该晶体的化学式为 。 (2)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。①氮化硅的硬度 (填“大于”或“小于”)氮化碳的硬度,原因是 ; ②已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式: 。 (3)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为 ,GaN属于 晶体。 16.碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。(1)C60分子形成的晶体中,在晶胞的顶角和面心均含有一个C60分子,则一个C60晶胞的质量约为 。 (2)干冰和冰是两种常见的分子晶体,下列关于这两种晶体的比较正确的是 (填字母)。a.晶体的密度:干冰>冰b.晶体的熔点:干冰>冰c.晶体的空间利用率:干冰>冰d.晶体中分子间相互作用力类型相同(3)金刚石晶胞的结构如图所示,立方BN的结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的空间结构为 ,一个BN晶胞中N原子数目为 。 (4)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶角和面心均含有一个Cu原子,则Cu晶体中与一个Cu原子距离最近的Cu原子数为 。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数值为NA,则Cu的原子半径为 cm。 答案:1.D 解析 由于共价晶体中粒子间以共价键结合,而分子晶体中分子间以分子间作用力结合,故共价晶体比分子晶体的熔点高、硬度大;有些分子晶体溶于水后能电离出自由移动的离子而导电,如H2SO4、HCl;干冰(固态CO2)是分子晶体,D错误。2.C 解析 C60和冰都是分子晶体,A、B两项均不符合题意;金刚石和水晶都是共价晶体,在金刚石中,每个碳原子周围都有四个等距离的碳原子与之形成正四面体结构,C项符合题意;在水晶中,每个硅原子与四个氧原子以共价键相连形成正四面体结构,但是每个氧原子只与两个硅原子直接相连,D项不符合题意。3.C 解析 分子晶体中的共价键一般有方向性,而分子间作用力中的氢键也有方向性,故A错误;在分子晶体中不一定存在氢键,如甲烷分子间及分子内都不存在氢键,故B错误;冰和Br2均由分子构成,均属于分子晶体,故C正确;稀有气体构成微粒是单原子分子,可形成分子晶体,故D错误。4.C 解析 二氧化硅是硅原子和氧原子形成的共价晶体,二氧化碳是由二氧化碳分子形成的分子晶体,二氧化硅晶体的熔点高于二氧化碳,故A、D正确,C错误;二氧化硅晶体中每个硅原子周围有4个氧原子,则硅原子的杂化方式为sp3杂化,二氧化碳分子中碳原子的价层电子对数为2,孤电子对数为0,碳原子的杂化方式为sp杂化,B正确。5.B 解析 因为共价晶体中原子与原子之间以共价键结合,共价键的作用比较强,使共价晶体熔点高、硬度大,B项符合共价晶体的特征。6.D 解析 在SiO2晶体中,由Si原子、O原子构成的最小单元环是12元环,每个最小环中含有6个硅原子和6个氧原子,故A错误;124 g白磷(P4)晶体物质的量==1 mol,又因为1个P4分子中含6个P—P 共价键,所以124 g白磷(P4)晶体中,含P—P共价键的个数为6NA,故B错误;C—C键能大于Si—Si,所以金刚石的熔、沸点高于晶体硅,故C错误;金刚石晶体中,1个碳原子形成4个共价键,每个共价键连有2个C原子,所以碳原子数与C—C数之比为1∶2,故D正确。7.B 解析 干冰为分子晶体,熔点较低,是因为分子间作用力弱,而不是因为键能小,A错误;晶体硅、金刚石都为共价晶体,原子半径C<Si,原子半径越小,共价键键能越大,则熔点越高,B正确;HI、HBr为同主族元素所形成的分子晶体,分子的相对分子质量越大,分子间作用力越大,晶体的熔点越高,故熔点:HI>HBr,C错误;二氧化硫形成的是分子晶体,其熔点低是由于分子间作用力弱,不是由键能引起的,D错误。8.答案 (1)低 (2)12 4解析 (1)组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔、沸点越高,所以ClF3的熔、沸点比BrF3的低。9.B 解析 B4C由非金属元素组成,可用于制作切削工具和高温热交换器,说明熔点高,应为共价晶体,不存在单个分子,构成微粒为原子,碳、硼原子之间以共价键结合。10.D 解析 铍窗利用了铍的延展性,将铍做成铍片;石英对光线全反射,传导光的能力非常强,可作光导材料;SiO2属于共价晶体,熔点很高,可作耐高温材料;NaI、CsI能作为闪烁体的原因是吸收高能粒子,闪烁体中的电子被激发跃迁后又回到基态,释放光能而发光,不涉及化学变化,即不涉及NaI、CsI的分解。11.D 解析 同主族元素形成的气态氢化物的分子结构和性质相似,且相对分子质量随着原子序数增大而增大。一般情况下,范德华力随着相对分子质量的增大而增大,但由于氨、水和HF分子间分别可以形成氢键,所以其沸点在同主族元素氢化物中反常,故A、B、C项错误,D正确。12.A 解析 由BeCl2熔点较低、易升华、可溶于醇和醚可知BeCl2晶体为分子晶体,分子晶体在熔融状态下不导电,A正确;根据BeCl2的化学性质与AlCl3相似,由于AlCl3溶液中的Al3+能发生水解:Al3++3H2OAl(OH)3+3H+,使溶液显酸性,可知BeCl2水溶液应显酸性,B错误;BeCl2和BeBr2形成的晶体都是分子晶体,且二者结构相似,故熔、沸点随着相对分子质量的增大逐渐升高,C错误;由AlCl3能与NaOH溶液反应可知BeCl2也能与NaOH溶液反应,D错误。13.D 解析 晶体硅的结构是五个硅原子形成正四面体结构,其中有一个硅原子位于正四面体的中心,另外四个位于正四面体的顶角,故SiO2的结构为每个硅原子周围有四个氧原子,而每个氧原子周围有两个硅原子,在晶体中Si原子与O原子的原子个数比为1∶2,“SiO2”仅表示石英的组成,故没有单个的SiO2分子。14.B 解析 共价晶体的熔、沸点和硬度等物理性质取决于晶体内的共价键,构成共价晶体的原子半径越小,键长越短,键能越大,对应共价晶体的熔、沸点越高,硬度越大。15.答案 (1)C3N4(2)①小于 硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,故氮碳形成的共价键的键能大,氮化碳的硬度大 ②Si3N4(3)4 正四面体形 共价解析 (1)根据题给晶胞的结构可知含有碳原子数目=8×+4×=3,氮原子数目为4,则化学式为C3N4。(2)①氮化碳和氮化硅晶体结构相似,它们的硬度大、熔点高、化学性质稳定,这说明二者形成的晶体都是共价晶体,由于硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,键能大,所以氮化硅的硬度小于氮化碳的硬度;②N的最外层电子数为5,要满足8电子稳定结构,需要形成3个共价键,Si的最外层电子数为4,要满足8电子稳定结构,需要形成4个共价键,所以氮化硅的化学式为Si3N4。(3)GaN的晶体结构与晶体硅相似,则GaN属于共价晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为正四面体形。16.答案 (1) g (2)ac (3)正四面体 4 (4)12 解析 (1)C60形成的分子晶体,在晶胞的顶角和面心均含有一个C60分子,故每个晶胞中含有4个C60分子,故一个C60晶胞的质量为240个碳原子的质量,即约为 g。(2)干冰晶体中CO2分子间只存在范德华力,其结构是分子密堆积;而冰晶体中存在氢键,由于氢键具有方向性,冰中水分子不是密堆积,故密度:干冰>冰;熔点:冰>干冰;空间利用率:干冰>冰。(3)在BN晶体中,B原子与N原子交替出现,故每个B原子周围紧邻4个N原子,每个N原子周围也紧邻4个B原子,形成正四面体结构;在金刚石晶胞中共有碳原子个数为8×+6×+4=8,故在BN晶胞中B原子和N原子各4个。(4)由于金属铜采用面心立方最密堆积,与一个Cu原子距离最近的Cu原子数为12;每个晶胞中含有4个Cu原子,且面对角线上的3个Cu原子相切,设Cu原子半径为r,则有(2r)3×ρ=,故r= cm。
相关试卷
这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优秀当堂检测题,共14页。试卷主要包含了分子晶体,共价晶体,分子与共价晶体综合等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优秀课后练习题,共14页。试卷主要包含了下列物质不属于分子晶体的是,下列各组晶体物质中等内容,欢迎下载使用。
这是一份高中人教版 (2019)第三章 晶体结构与性质第二节 分子晶体与共价晶体当堂检测题,共4页。










