



人教版 (2019)选择性必修2第二节 分子的空间结构教学课件ppt
展开
这是一份人教版 (2019)选择性必修2第二节 分子的空间结构教学课件ppt,共60页。PPT课件主要包含了课前·新知导学,红外光谱,X射线衍射,OCO,直线形,平面三角形,三角锥形,°28′,正四面体形,价层电子对等内容,欢迎下载使用。
分子的空间结构1.分子结构的测定许多现代仪器和方法可测定分子结构,如____________、____ ___________等。_________可以测定分子中含有哪些化学键或官能团。
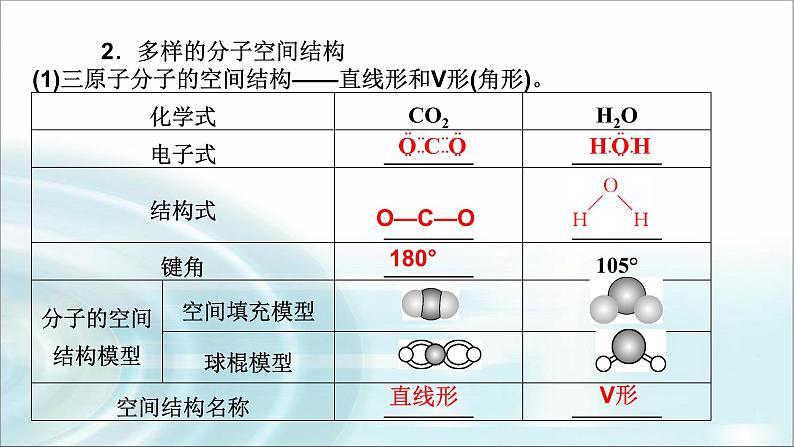
2.多样的分子空间结构(1)三原子分子的空间结构——直线形和V形(角形)。
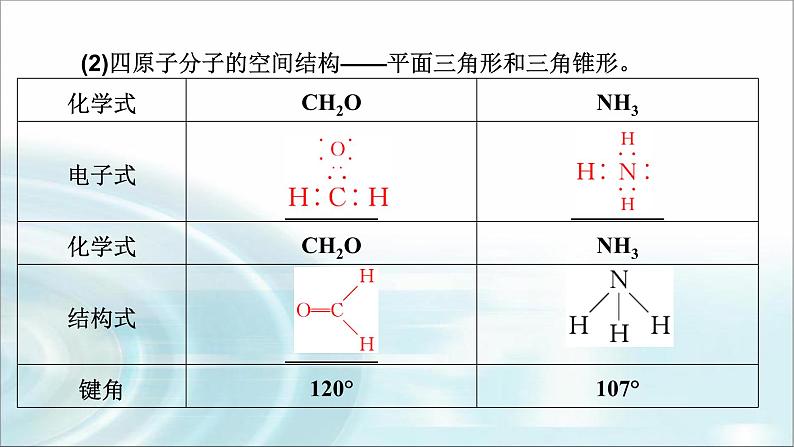
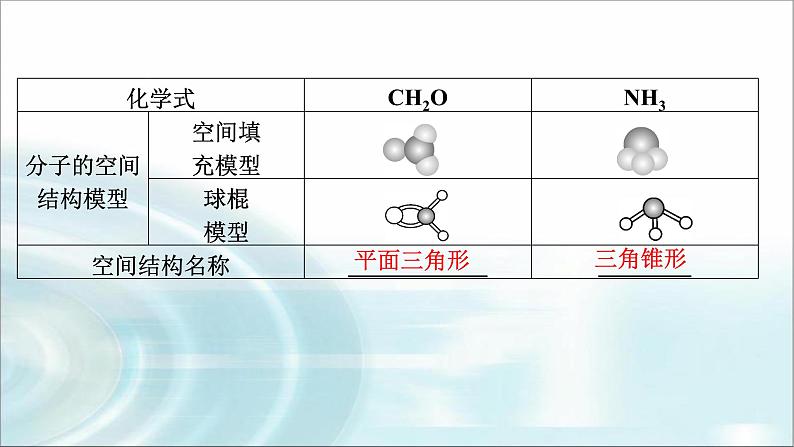
(2)四原子分子的空间结构——平面三角形和三角锥形。
(3)五原子分子的空间结构——正四面体形。
3.价层电子对互斥模型(1)价层电子对互斥模型认为,分子的空间结构是中心原子周围的“______________”相互__________的结果。分子中的价层电子对包括______________和中心原子上的________________,多重键只计其中的____________________,不计________________。
(2)VSEPR模型的两种类型。①中心原子上的价电子都用于形成共价键的分子。
②中心原子上有孤电子对的分子:对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的空间结构。
4.杂化轨道理论简介(1)原子轨道杂化与杂化轨道。 【答案】相近 相等 能量相同
(2)杂化轨道类型及分子的空间结构。
5.知识拓展:等电子体(1)定义:原子总数、价电子总数均相同的分子或离子互为等电子体。(2)等电子原理:互为等电子体的微粒具有相似的化学键特征和立体结构,许多性质相似,如CO和N2。
(1)根据价层电子对互斥理论得到的VSEPR模型,就是分子的实际空间结构吗?(2)举例说明,中心原子采取sp3杂化的分子的空间结构是否都是正四面体形?【答案】(1)不完全是。VSEPR模型是按分子中价层电子对数进行判断的,但是有些分子中的部分价层电子对未形成化学键(孤电子对),因此得到的分子的空间结构是忽略孤电子对后的形状。(2)不是。CH4、NH3、H2O分子中的中心原子都是sp3杂化,CH4是正四面体形,NH3是三角锥形,H2O是角形(或V形)。
判断正误。(正确的画“√”,错误的画“×”)(1)价层电子对之间的夹角越小,排斥力越小。( )(2)NH3分子的VSEPR模型与分子空间结构不一致。( )(3)五原子分子的空间结构都是正四面体形。( )(4)杂化轨道和参与杂化的原子轨道的数目相同,但能量不同。( )(5)凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )(6)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )【答案】(1)× (2)√ (3)× (4)√ (5)× (6)×
重难点一 利用价层电子对互斥模型判断分子的空间结构 1.中心原子价层电子对数的计算
(1)a表示中心原子的价电子数。对主族元素,a=最外层电子数;对于阳离子,a=价电子数-离子电荷数;对于阴离子,a=价电子数+|离子电荷数|。(2)x表示与中心原子结合的原子数。(3)b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。
2.利用VSEPR模型确定粒子空间结构的步骤(1)确定分子的VSEPR模型。(2)确定分子的空间结构——略去中心原子孤电子对后的空间结构。
推测下列分子的空间结构。(1)H2Se______________。(2)BBr3______________。(3)CHCl3______________。(4)SiF4______________。【答案】(1)V形 (2)平面三角形 (3)四面体形 (4)正四面体形
【解析】根据原子的最外层电子排布,可以判断出各分子中心原子含有的孤电子对数。
H2Se略去两对孤电子对,分子空间结构为V形,BBr3为平面三角形,CHCl3分子中由于氢原子和氯原子不同,空间结构不是正四面体形,SiF4为正四面体形。
运用价层电子对互斥模型推测下列分子或离子的空间结构。(1)BeCl2_______________________。(2)SCl2_______________________。(4)PF3_______________________。【答案】(1)直线形 (2)V形 (3)三角锥形 (4)三角锥形
用VSEPR模型预测下列分子或离子的空间结构,其中正确的是( )A.CH4与CH2Cl2均为正四面体形B.BeCl2与SO2均为直线形C.BF3与PCl3均为三角锥形
重难点二 利用杂化轨道理论解释分子的空间结构 1.轨道的杂化与杂化轨道
3.杂化类型的判断(1)方法:①杂化轨道数=中心原子孤电子对数+中心原子结合的原子数。②根据杂化轨道数判断杂化类型。注意:轨道数与杂化类型是一 一对应的,即:
4.分子的空间构型的判断分子的空间构型与杂化轨道类型的关系取决于中心原子结合的原子个数与杂化轨道数关系。
【名师点拨】从杂化轨道理论的角度比较键角的大小(1)比较键角时,先看中心原子杂化类型,杂化类型不同时,键角一般按sp、sp2、sp3顺序依次减小。(2)杂化类型相同时,中心原子孤电子对数越多,键角越小。
指出下列原子的杂化轨道类型、分子的结构式及空间结构。(1)CS2分子中的C为_____杂化,分子的结构式为_____________,空间结构为________________。(2)CH2O中的C为_____杂化,分子的结构式为_______________,空间结构为________________。 (3)CCl4分子中的C为_____杂化,分子的结构式为_____________,空间结构为________________。 (4)H2S分子中的S为______杂化,分子的结构式为_____________,空间结构为________。
【答案】(1)sp S==C==S 直线形
下列说法正确的是( )A.含有四个原子的分子的空间结构不可能为正四面体形B.分子式为AB2的分子的空间结构一定为V形【答案】D
【名师点拨】杂化轨道与共价键类型杂化轨道只能用于形成σ键或用来容纳未参与成键的孤电子对,不能用于形成π键;未参与杂化的p轨道可用于形成π键。
(1)(2020年全国卷Ⅰ,节选)磷酸根离子的空间构型为_____ _____,其中P的价层电子对数为________、杂化轨道类型为_______。
(3)(2021年广东卷,节选)很多含硫基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A.在Ⅰ中S原子采取sp3杂化B. 在Ⅱ中S元素的电负性最大C. 在Ⅲ中C—C—C键角是180°D. 在Ⅲ中存在离子键与共价键E. 在Ⅳ中硫氧键的键能均相等【答案】(1)正四面体形 4 sp3 (2)sp3 (3)AD
(1)下列分子中的中心原子采取sp2杂化的是________(填字母,下同)。A.CH4 B.SO3 C.CCl4 D.H2S E.SO2(2)下列各组粒子的空间结构相同的是________。A.全部 B.①②③⑤C.③④⑤ D.②⑤【答案】(1)BE (2)C
【名师点拨】用等电子体原理判断分子空间结构(1)常见的等电子体。
(2)等电子体原理的应用。根据已知的一些分子的结构推测另一些与它等电子的微粒的立体构型,并推测其物理性质。①(BN)x与(C2)x,N2O与CO2等也是等电子体。②硅和锗是良好的半导体材料,它们的等电子体磷化铝(AlP)和砷化镓(GaAs)也是很好的半导体材料。③白锡(β-Sn2)与锑化铟是等电子体,它们在低温下都可转变为超导体。
1.下列分子中,空间结构不是直线形的是( )A.CO B.H2OC.CO2 D.C2H2【答案】B 【解析】CO为双原子分子,属于直线形;CO2、C2H2是典型的直线形分子,而H2O分子为V形。
2.下列有关NH3分子空间结构的分析正确的是( )A.中心原子孤电子对数为0,分子为平面三角形,键角为120°B.中心原子孤电子对数为0,分子为三角锥形,键角为107°C.中心原子孤电子对数为1,分子为三角锥形,键角为107°D.中心原子孤电子对数为1,分子为平面三角形,键角为109°28′【答案】C 【解析】氨分子中氮原子上有一对孤电子对,分子空间构型为三角锥形,键角为107°。
3.用VSEPR模型预测,下列分子中键角是120°的是( )A.C2H2 B.CH4C.BF3 D.CO2【答案】C 【解析】C2H2与CO2为直线形,键角180°;CH4为正四面体形,键角109°28′。
4.下列分子中的中心原子采取sp2杂化的是( )A.SO2 B.CO2C.CCl4 D.NH3【答案】A 【解析】SO2分子中的硫原子采取sp2杂化,A正确;CO2分子中碳原子采取sp杂化,B错误;CCl4分子中的C原子采取sp3杂化,C错误;NH3分子中的氮原子采取sp3杂化,D错误。
( )A.等于109.5°B.小于109.5°C.大于109.5°D.等于120°【答案】B
6.下列关于原子轨道的说法正确的是( )A.凡是中心原子采取sp3杂化轨道成键的分子,其立体构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键【答案】C
【解析】中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但若其结合的原子数不等于杂化轨道数时其立体构形就不是四面体,如水和氨气分子中中心原子采取sp3杂化,但H2O是V形,NH3是三角锥形,忽视这一点就会错选A;CH4中sp3杂化轨道是由中心碳原子的能量相近的一个2s轨道和3个2p轨道杂化形成,与它结合的H的电子无关,而且1s轨道和2p轨道的能量差别较大,也不能形成杂化轨道,若不理解杂化轨道的形成原理,则会错选B;中心原子的杂化类型与其结合的原子个数没有直接的关系,若根据结合的原子数,判断中心原子的杂化类型而会错选D。
(1)空间结构呈正四面体的是____________。 (2)中心原子采取sp3杂化的是______________________,为sp2杂化的是________________。 (3)所有原子共平面的是____________,共直线的是____________。
(4)①④⑥⑦⑧键角由大到小的顺序为_______________________(填字母)。 A.⑥>①>⑧>④>⑦B.⑥>①>④>⑦>⑧C.⑥>①>④>⑧>⑦【答案】(1)①⑤⑦ (2)①④⑤⑦⑧⑨ ⑥ (3)②③⑥⑧⑨②③ (4)C
相关课件
这是一份高中鲁科版 (2019)第2节 共价键与分子的空间结构授课ppt课件,共17页。PPT课件主要包含了一手性分子,手性异构体,CHBrClF分子,看图整理,手性分子,有手性异构体的分子,手性碳原子,乳酸分子两种异构体,手性分子的判断方法,不能重合是手性分子等内容,欢迎下载使用。
这是一份2020-2021学年第2节 共价键与分子的空间结构授课ppt课件,共51页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构示范课课件ppt,共45页。PPT课件主要包含了内容索引,自主梳理,手性分子,自我检测,问题探究,归纳拓展,应用体验,答案D,答案C等内容,欢迎下载使用。









