
所属成套资源:2024届高三新高考化学大一轮专题练习(46份)
2024届高三新高考化学大一轮专题练习:盐类的水解
展开
这是一份2024届高三新高考化学大一轮专题练习:盐类的水解,共22页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:盐类的水解
一、单选题
1.(2023·四川乐山·统考三模)下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
测定硫酸铜晶体中结晶水的含量
加热盛有硫酸铜晶体的坩埚,待固体全部呈白色后将坩埚放置在铁架台上冷却,再称重
B
检验Fe(NO3)2中是否混有Fe(NO3)3
取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液
C
验证石蜡油分解的产物不仅是烷烃
将热分解的气体产物通入溴的四氯化碳溶液
D
制备无水氯化铝
在硬质玻璃管中灼烧AlCl3·6H2O,同时通入干燥空气气流保护
A.A B.B C.C D.D
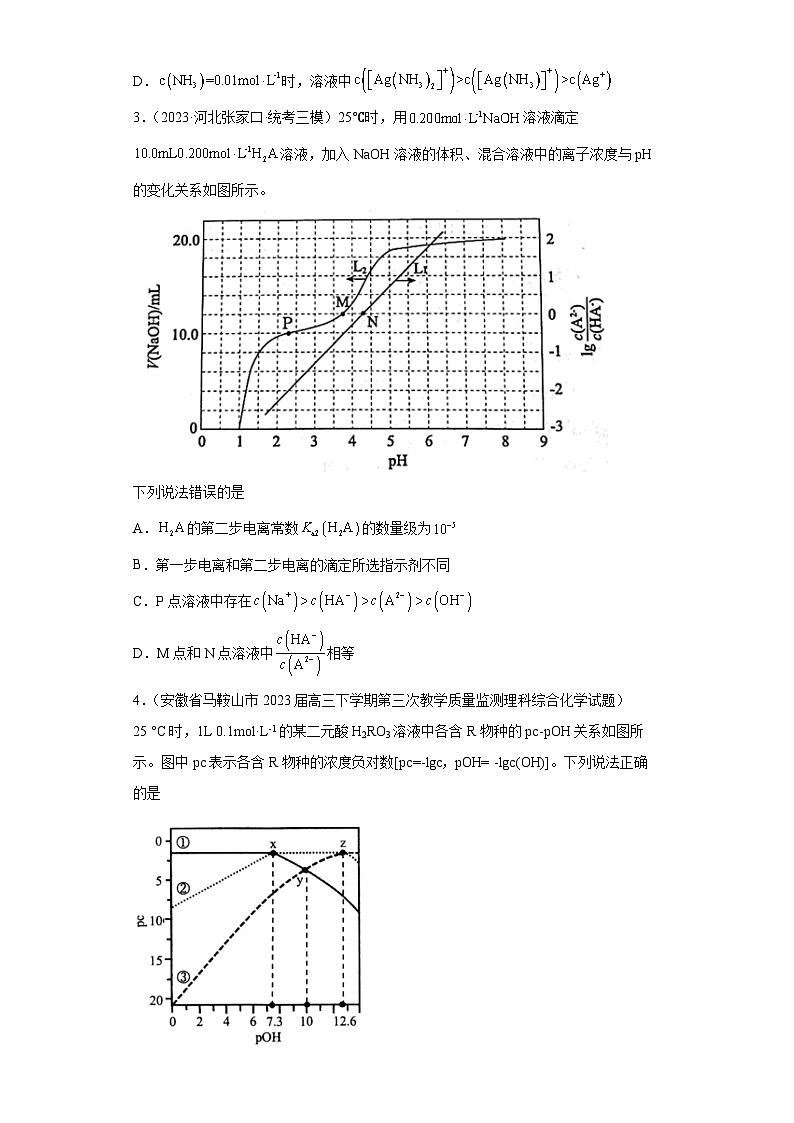
2.(2023·全国·统考高考真题)向饱和溶液(有足量固体)中滴加氨水,发生反应和,与的关系如下图所示(其中M代表、、或)。
下列说法错误的是
A.曲线I可视为溶解度随浓度变化曲线
B.的溶度积常数
C.反应的平衡常数K的值为
D.时,溶液中
3.(2023·河北张家口·统考三模)25℃时,用溶液滴定溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
下列说法错误的是
A.的第二步电离常数的数量级为
B.第一步电离和第二步电离的滴定所选指示剂不同
C.P点溶液中存在
D.M点和N点溶液中相等
4.(安徽省马鞍山市2023届高三下学期第三次教学质量监测理科综合化学试题)25 °C时,1L 0.1mol·L-1的某二元酸H2RO3溶液中各含R物种的pc-pOH关系如图所示。图中pc表示各含R物种的浓度负对数[pc=-lgc,pOH= -lgc(OH)]。下列说法正确的是
A.曲线③表示pc()随pOH的变化
B.y点的溶液中:c(H2RO3)+2c()=0.1mol·L-1
C.H2RO3的Ka1=1.0×10-6.7
D.2H2RO3+的平衡常数K=1.0×10-5.3
5.(2023春·浙江·高三校联考阶段练习)碳、铝化合物主要有、、,三者分别水解,生成和一种气态烃,而气态烃通常不可能的是
A.甲烷 B.乙烯 C.乙烷 D.乙炔
6.(2023·全国·高三统考专题练习)二元弱酸H2A溶液中各组分百分含量δ随pH的变化如图所示。难溶盐MA的溶度积ksp(MA)=4.0×10-8,M2+离子不水解。已知≈3.2,下列说法错误的是
A.H2A的二级电离常数Ka2的数量级为10-5
B.C点的pH为2.75
C.反应H2A(aq)+M2+(aq)MA(s)+2H+(aq)的平衡常数K≈80
D.向MA的饱和溶液中加酸调节至中性,则一定存在:2c(M2+)=2c(A2-)+c(HA-)
7.(2023秋·江苏扬州·高三江苏省高邮中学校联考期末)已知,,室温下,通过实验研究亚硫酸盐的性质,下列说法正确的是
实验
实验操作和现象
1
测得某浓度的溶液的为5.2
2
向溶液中加入过量溶液,产生白色沉淀
3
向溶液中滴入等浓度等体积的溶液
4
向溶液中滴加少量酸性溶液,溶液的紫红色褪去
A.实验1的溶液中:
B.实验2反应静置后的上层清液中有
C.实验3中:
D.实验4中发生反应:
8.(2023秋·江苏扬州·高三江苏省高邮中学校联考期末)室温下,下列实验探究方案能达到探究目的的是
选项
探究方案
探究目的
A
向浓度均为的和的混合液中滴少量的溶液,观察实验现象
B
向蔗糖溶液中滴加稀硫酸,加热,再加入银氨溶液并水浴加热,观察是否出现银镜
蔗糖在酸性条件下能水解
C
将少量铜粉加入到2.0mol·L溶液中,观察实验现象
氧化性比强
D
室温下,用计测得溶液的小于溶液
水解平衡常数:
A.A B.B C.C D.D
9.(2023秋·湖北武汉·高三武汉市育才高级中学校联考期末)常温下,下列有关电解质溶液的说法正确的是
A.相同浓度的和溶液,前者的较大,则
B.相同浓度的和溶液等体积混合后约为4.7,则溶液中
C.已知溶于稀硫酸,而不溶于稀硫酸,则
D.在溶液中,
10.(2023·浙江·校联考一模)下列方案设计、现象和结论都正确的是
实验目的
实验设计
现象和结论
A
检验某固体化合物样品中是否存在
取少量固体样品完全溶于盐酸,在滴加KSCN溶液
若出现血红色,则该固体化合物中存在
B
探究和HClO的酸性强弱
将气体通入溶液中
若产生白色沉淀,则说明酸性:
C
探究常温下同浓度的和的电离能力
常温下,分别测0.1mol/L的和溶液的pH
若两者的pH之和等于14,则两者的电离程度相同
D
验证某红棕色气体是否为
将气体通入淀粉碘化钾溶液
若溶液变蓝,则说明气体为
A.A B.B C.C D.D
11.(2023春·湖北·高三校联考专题练习)室温下,通过下列实验探究(为水解平衡常数、为电离平衡常数)溶液的性质。
实验
实验操作和现象
1
用试纸测定溶液的pH,测得约为5.5
2
向含的稀溶液中加入,产生沉淀
3
向溶液中通入过量HCl,无明显现象
4
向溶液中通入一定量,测得溶液
下列有关说法错误的是
A.实验1的溶液中:
B.实验2反应静置后的上层清液中:
C.实验3得到的溶液中:
D.实验4所得的溶液中:
12.(2023·云南·校联考二模)水溶液中甘氨酸盐酸盐(HOOCCH2NH2 ·HCl)可看作是二元酸,溶液中存在以下平衡:
+H+ Ka1
-OOCCH2NH2+H+ Ka2
25°C时,用1. 0mol/L NaOH溶液滴定100mL 1. 0mol/L的甘氨酸盐酸盐溶液,滴定曲线变化如图所示。下列说法不正确的是
A.Ka1的数量级为10-3
B.水的电离程度: Bc()
13.(2023·辽宁·校联考一模)室温下,用溶液滴定体积均为未知浓度的溶液和溶液。滴定过程中,溶液的与相关离子浓度的关系如下图(X代表A或B),当消耗溶液时,两溶液均恰好等于7,下列说法错误的是
A.的数量级为
B.滴定前浓度:
C.将M、N两点溶液混合,所得溶液中存在
D.水的电离程度:
二、多选题
14.(2023春·安徽池州·高三池州市第一中学校联考阶段练习)室温下,向10mL 0.1异丁酸钠溶液(异丁酸记为HM,)中逐滴滴加相同物质的量浓度的乳酸(记为HR)溶液,测得溶液中与的关系如图所示,下列说法不正确的是
A.(乳酸)
B.相同浓度的乳酸钠溶液pH比异丁酸钠溶液大
C.滴加过程中水的电离程度先增大后减小
D.滴到10mL时,溶液中
三、非选择题
15.(2022秋·福建龙岩·高三福建省连城县第一中学校考阶段练习)常温下,部分弱电解质的电离平衡常数如表;浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
弱电解质
HCN
H2CO3
CH3COOH
电离常数
Ka=4.9×10-10
Ka1=4×10-7
Ka2=5.6×10-11
Ka=1.7×10-5
(1)这4种溶液的pH由大到小的顺序是_______(填标号),其中②由水电离的H+浓度为_______。
(2)①中各离子浓度由大到小的顺序是_______。
(3)④的水解常数Kh=_______。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_______④(填“>”“①>④>③; 1.0×10-13 mol·L-1;
(2)c(Na+)>c(CN-)>c(OH-)>c(H+);
(3)2.5×10-8;
(4)<;
(5)。
【详解】(1)同浓度的4种溶液中,NaOH溶液为强碱溶液,因为酸性: CH3COOH> H2CO3> HCN>,越弱越水解,因此溶液的碱性:②>①>④>③, 4种溶液pH由大到小的顺序是②>①>④>③;0.1 mol·L-l的NaOHpH= 13,由水电离的H+浓度为1.0×10-13mol·L-l答案为:②>①>④>③;1.0×10-13 mol·L-1;
(2)NaCN溶液中CN水解,溶液显碱性,离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+);答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(3)NaHCO3溶液碳酸氢根水解:,答案为:2.5×10-8;
(4)等体积等浓度的CH3COONa溶液和NaHCO3溶液中,NaHCO3水解程度大于醋酸钠,溶液的碱性强于CH3COONa,滴加盐酸至呈中性,则消耗盐酸的体积③②>④
(5)4.7×10-7
【详解】(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,其反应离子方程式Al3++3HCO=Al(OH)3↓+3CO2↑。
(2)FeCl3溶液中存在Fe3+的水解平衡:Fe3++3H2OFe(OH)3+3H+,加入盐酸,c(H+)增大,可抑制Fe3+的水解。
(3)次氯酸钠属于弱酸强碱盐,ClO-水解使溶液显碱性,离子方程式为:ClO-+H2OHClO+OH-;常温时pH=10的NaClO溶液中c(H+)=10-10mol/L,c(OH-)=,根据电荷守恒c(H+)+ c(Na+)=c(OH-)+c(ClO -),c(Na+)-c(ClO-)= c(OH-)- c(H+)=10-4-10-10。
(4)①因为电离常数:碳酸K1=4.3×10-7、K2=5.6×10-11;次氯酸的电离常数K=3×10-8,因此酸性强弱为H2CO3>HClO> HCO,根据强酸制弱酸的原理,少量CO2通入NaClO溶液中生成HCO和HClO,离子方程式为:ClO-+H2O+CO2=HClO+HCO;
②在某CH3COOH和CH3COONa的混合液中,醋酸的电离常数K=1.8×10-5,当=时,c(H+)=1×10-5mol/L,溶液的pH=5;
③由表中电离常数数据可知酸性:CH3COOH >H2CO3>HClO> HCO,根据越弱越水解的原理,①CO②HCO③ClO-④CH3COO-结合质子能力由强到弱的顺序为①>③>②>④。
(5)当AgCl和AgI同时沉淀时,溶液中=4.7×10-7。
18.(1) 10-12 不变
(2) 酸 NH+H2ONH3·H2O+H+
(3)CO2+ClO-+H2O=HClO+HCO
(4)B
【详解】(1)pH=2的CH3COOH溶液中c(H+)=10-2mol/L,则c(OH-)=10-12mol/L,氢氧根全部由水电离,水电离出氢离子浓度和氢氧根相等,所以也为10-12mol/L;==,温度不变Ka和Kw不变,所以该比值不变;
(2)NH4Cl溶液中存在铵根的水解:NH+H2ONH3·H2O+H+,所以溶液显酸性;
(3)根据题目所给信息可知酸性:H2CO3>HClO>HCO,所以少量二氧化碳通入到次氯酸钠溶液中生成HClO和碳酸氢钠,离子方程式为CO2+ClO-+H2O=HClO+HCO;
(4)A.饱和H2SO3溶液和饱和H2CO3溶液的浓度不同,所以不能根据这两种物质的饱和溶液pH大小判断酸性强弱,A不符合题意;
B.同温下,等浓度的NaHSO3溶液和NaHCO3溶液,NaHCO3溶液的碱性强,说明HCO的水解程度更大,则H2CO3的电离程度小,即H2SO3的酸性强于H2CO3的,B符合题意;
C.二氧化硫和二氧化碳都能使澄清石灰水变浑浊,因为该题中二氧化硫是过量的,澄清石灰水变浑浊不能说明是否产生二氧化碳,则不能说明酸性强弱,C不符合题意;
综上所述答案为B。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习—盐类的水解,共24页。试卷主要包含了单选题,工业流程题,原理综合题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习-盐类的水解,共21页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习---盐类的水解,共22页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。









