
所属成套资源:2024届高三新高考化学大一轮专题训练(50份)
2024届高三新高考化学大一轮专题训练—影响化学反应速率的因素
展开
这是一份2024届高三新高考化学大一轮专题训练—影响化学反应速率的因素,共18页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题训练—影响化学反应速率的因素
一、单选题
1.(2023·浙江·校联考三模)下列实验方案设计、现象和结论均正确的是
目的
方案设计
现象和结论
A
检验乙醇是否发生消去反应
将乙醇和浓共热产生的气体依次通入足量的溶液、稀酸性溶液
溶液褪色,证明发生了消去反应
B
检验与的还原性强弱
向含的溶液中通入,再滴加淀粉溶液,观察现象
溶液变蓝色,说明还原性
C
鉴别同为白色粉末状晶体的尿和氯化铵
分别取少量晶体于试管中,加入足量浓溶液加热,在试管口放置湿润的红色石蕊试纸,观察试纸是否变色
若试纸不变蓝色,说明该晶体为尿素,若试纸变蓝色,说明该晶体为氯化铵
D
探究温度对化学反应速率的影响
向两支试管各加入酸性溶液和溶液,将其中一支放入冰水中,一支放入80℃热水中
80℃热水中褪色快,说明温度升高,反应速率加快
A.A B.B C.C D.D
2.(2023春·江苏盐城·高三校联考阶段练习)NH3、NH4Cl、NO、NO2、HNO3等是氮的重要化合物,工业合成氨的反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ•mol-1。NH3可与酸反应制得铵盐,也可通过催化氧化生成NO,用于生产HNO3。浓氨水加到生石灰中,放出大量热量,促进NH3·H2O分解,可用于实验室制取NH3。对于工业合成氨的反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ•mol-1。下列说法正确的是
A.该反应为吸热反应
B.升高温度能加快反应速率
C.0.1molN2与0.3molH2充分反应可释放9.24kJ的能量
D.若3v(N2)=v(H2),该反应处于平衡状态
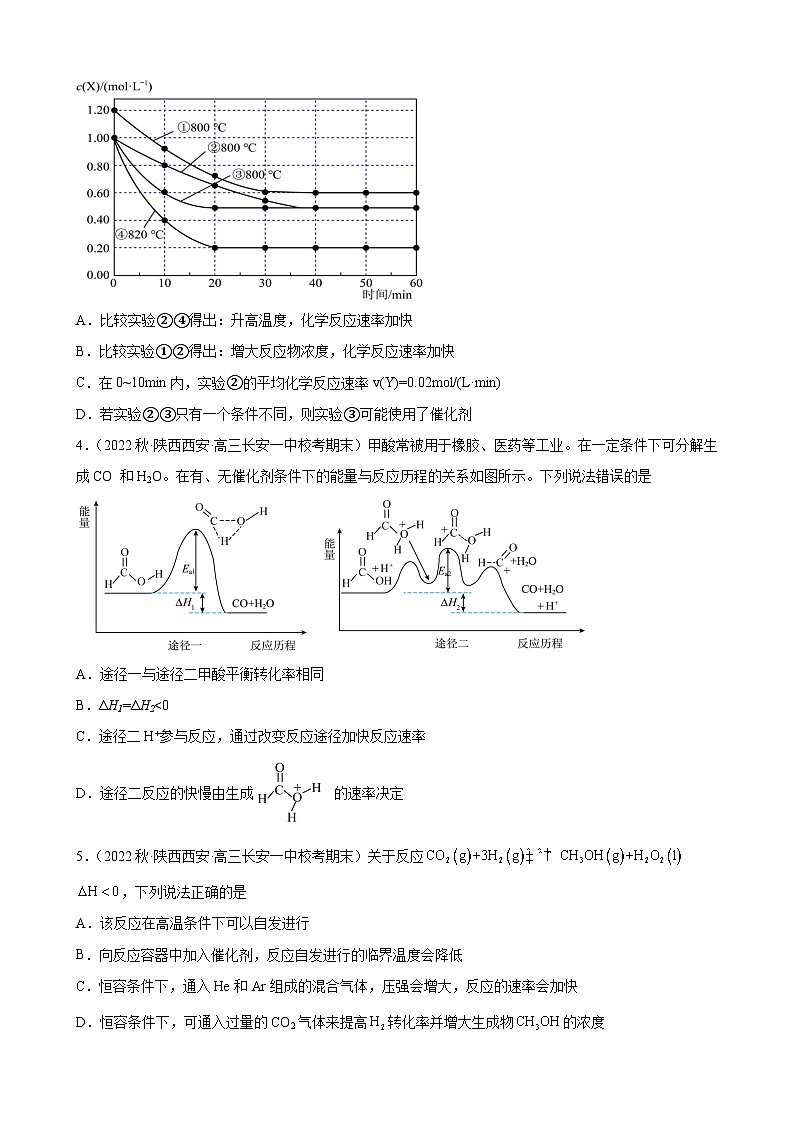
3.(2023春·河北衡水·高三河北阜城中学校考阶段练习)研究反应2X(g)Y(g)+Z(g)的化学反应速率的影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是
A.比较实验②④得出:升高温度,化学反应速率加快
B.比较实验①②得出:增大反应物浓度,化学反应速率加快
C.在0~10min内,实验②的平均化学反应速率v(Y)=0.02mol/(L·min)
D.若实验②③只有一个条件不同,则实验③可能使用了催化剂
4.(2022秋·陕西西安·高三长安一中校考期末)甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成CO 和H2O。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
A.途径一与途径二甲酸平衡转化率相同
B.ΔH1=ΔH2Fe3+
B
取2mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3溶液,充分反应后滴入5滴10%KSCN溶液
溶液变血红色
KI与FeCl3的反应有一定限度
C
向Na2SiO3溶液中通入CO2气体
有白色沉淀生成
非金属性:C>Si
D
两只试管中均加入2mL0.1mol/L酸性KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/LH2C2O4溶液,比较溶液褪色的时间
加入0.2mol/LH2C2O4溶液的褪色时间更短
其它条件相同时,反应物浓度越大,反应速率越大
A.A B.B C.C D.D
8.(2023春·四川南充·高三校考期中)已知H2O2(aq)分解为H2O(l)和O2(g)的能量变化如图曲线A所示,若在H2O2溶液中加入少量KI,则H2O2的分解过程可表示为:①H2O2+I-=H2O+IO-,②H2O2+IO-=H2O+O2+I-,其能量变化如图曲线B所示。下列有关说法不正确的是
A.上述反应①为吸热反应,反应②为放热反应
B.2molH2O2(aq)具有的能量大于2molH2O(l)和1molO2(g)具有的总能量
C.I-在H2O2分解过程中起到催化剂作用
D.催化剂不参与化学反应,反应前后性质、质量不变
9.(2023·辽宁·校联考一模)利用计算机技术测得在甲、乙两种催化剂作用下由正丁烷(g)制备1-丁烯(g)的反应历程如下,其中甲、乙催化剂表面的物种均用*号标注,过渡态均用TS表示,下列说法中错误的是
A.选用催化剂甲时的最高能垒(活化能)为1.95eV
B.选用催化剂乙时,相对能量从的过程为正丁烷的吸附过程
C.为吸热反应
D.若只从平均反应速率快慢角度考虑,生产中适宜选用催化剂乙
10.(2023·湖北武汉·统考模拟预测)已知反应S2O(aq)+2I-(aq)2SO(aq)+I2(aq),若起始向反应体系中加入含Fe3+的溶液,反应机理如图所示。下列说法正确的是
A.S2O中硫元素显+7价
B.反应速率与Fe3+浓度无关
C.由图可知氧化性:Fe3+>S2O
D.若不加Fe3+,正反应的活化能比逆反应的小
11.(2023·广东湛江·统考二模)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物,可作为有机锌离子电池的正极材料。下列叙述正确的是
已知:作该反应的催化剂,升华温度为178℃,的熔点为801℃。
A.吩嗪和是的链节
B.为了提高反应速率,可将反应温度由150℃升至160℃
C.上述反应中,断裂了键和键,也形成了键和键
D.吩嗪和完全合成时,生成水
12.(2023·全国·高三专题练习)水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用•标注。下列说法正确的是
A.水煤气变换反应的△H>0
B.步骤③的化学方程式为:CO•+OH•=COOH•
C.步骤⑤的热化学方程式可写为:COOH•+2H•+OH•=CO2(g)+H2(g)+H2O• △H=-2.24eV•mol-1
D.该历程中最大能垒(活化能)E正=2.02eV
13.(2023·安徽淮南·统考一模)以[PIMPS]H2PW12O40为催化剂,可实现苯甲硫醚高效催化氧化,其反应机理如图所示。下列说法错误的是
A.当有1mol苯甲硫醚被氧化为最终产物时共转移4mole-
B.H2O2 分子参加的反应一定有电子转移
C.苯甲硫醚的催化氧化最终生成 , 催化氧化过程中温度不宜过高
D.催化剂中的-W=O部位与H2O2作用生成活性过氧物
14.(2023·内蒙古呼和浩特·二模)下列各实验操作、现象和结论均正确的是
选项
实验
现象
结论
A
两支试管中均装有2mL 0.01mol·L-1酸性KMnO4溶液,向第一支试管加入1mL 0.01 mol·L-1草酸溶液和1mL水,向第二支试管加入2mL 0.01 mol·L-1草酸溶液
第一支试管褪色时间比第二支试管长
其他条件相同时,反应物浓度越大,反应速率越快
B。
镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中,一段时间后加入K3[Fe(CN)6]溶液
无蓝色沉淀生成
铁片没有被腐蚀
C
用pH试纸分别测定相同物质的量浓度的
CH3COONa和NaClO溶液的pH
测得NaClO溶液的pH小于CH3COONa
CH3COO-水解程度大于ClO-
D
将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中
溶液变黄色
氧化性: H2O2比Fe3+强
A.A B.B C.C D.D
二、非选择题
15.(2023春·辽宁·高三凤城市第一中学校联考期中)在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生化学反应,用淀粉溶液检验产物,根据溶液出现蓝色所需的时间来衡量该反应的速率,某学生设计实验如表所示(表格中体积单位均为ml)(已知碘遇淀粉溶液变蓝)
0.01mol/L KIO3
溶液的体积
某浓度的Na2SO3
溶液的体积
H2O的体积
实验温度/℃
溶液出现蓝色
所需时间
实验1
5
5
V1
0
a
实验2
5
5
20
25
b
实验3
5
V2
15
25
c
(1)写出酸性条件下KIO3和Na2SO3发生反应的离子方程式______。
(2)表中______ml,______
(3)如果研究浓度对反应速率的影响,应使用表中的实验______。
(4)对比表中实验1和实验2,可以研究______对化学反应速率的影响。
(5)溶液出现蓝色所需的时间从多到少的顺序是______(用a、b、c表示)
16.(2023春·上海·高三卢湾高级中学校考期中)某研究小组同学用活性炭还原处理氮氧化物,向恒容密闭容器中加入足量C与发生反应,。在不同实验条件下,平衡时与温度T的关系如图所示:
(1)结合图中数据,判断该反应的___________0(填“>”或“”“=”或“ H2SiO3,从而得出非金属性:C>Si,C正确;
D.2Mn+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,根据离子反应方程式可得,高锰酸钾和草酸恰好完全反应的物质的量之比为2:5,所以D选项实验中高锰酸钾过量,溶液并不能完全褪色,故D不正确;
故选C。
8.D
【详解】A.由图可知,反应①生成物能量大于反应物为吸热反应,反应②生成物能量低于反应物为放热反应,A正确;
B.过氧化氢分解生成水和氧气总反应为放热反应,故2molH2O2(aq)具有的能量大于2molH2O(l)和1molO2(g)具有的总能量,B正确;
C.反应中碘离子被消耗又生成,在H2O2分解过程中起到催化剂作用,C正确;
D.催化剂反应前后性质、质量不变,但可以参与化学反应,D错误;
故选D。
9.A
【详解】A.过渡态物质的总能量与反应物总能量的差值为活化能,由图可知,选用催化剂甲时的最高能垒(活化能)为选用催化剂甲时的最高能垒(活化能)为1.29eV,A项错误;
B.由图可知,选用催化剂乙时,相对能量从的过程为正丁烷的在催化剂表面的吸附过程,B项正确;
C.生成物能量高于反应物的能量,则为吸热反应,C项正确;
D.活化能越小反应越快,活化能越大反应越慢,若只从平均反应速率快慢角度考虑,生产中适宜选用催化剂乙,其反应历程中活化能较小,D项正确。
故选A。
10.D
【详解】A.硫最外层只有6个电子,不会显+7;S2O中含有过氧键存在-1价氧,使得硫元素显+6价,A项错误;
B.反应中铁离子参与反应生成亚铁离子,亚铁离子又转化为铁离子,则铁离子为催化剂,改变反应速率,故反应速率与Fe3+浓度有关,B项错误;
C.氧化剂氧化性大于氧化产物,由图示第二步反应可知,氧化性:Fe3+
相关试卷
这是一份2024届高三新高考化学大一轮专题训练-影响化学反应速率的因素,共19页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习---影响化学反应速率的因素,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习-影响化学反应速率的因素,共19页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。








