所属成套资源:2024届高三新高考化学大一轮复习专题练习(45份)
2024届高三新高考化学大一轮专题练习—电解池
展开这是一份2024届高三新高考化学大一轮专题练习—电解池,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习—电解池
一、单选题
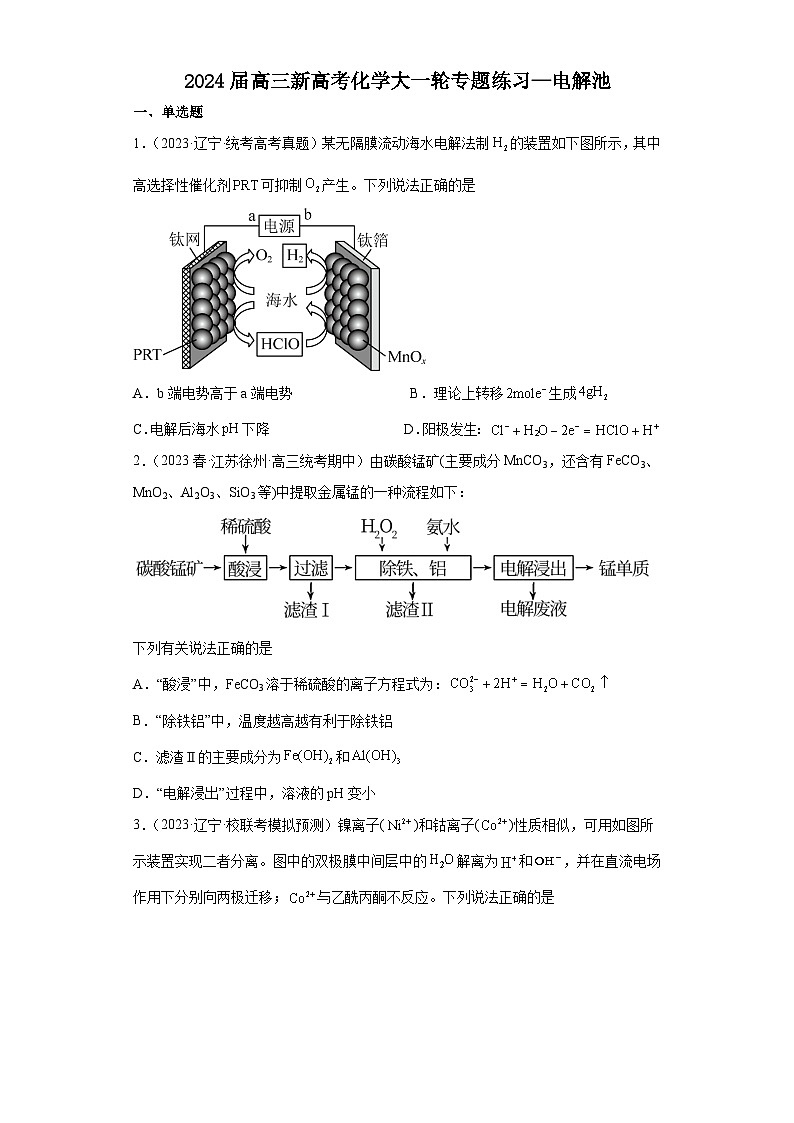
1.(2023·辽宁·统考高考真题)某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是
A.b端电势高于a端电势 B.理论上转移生成
C.电解后海水下降 D.阳极发生:
2.(2023春·江苏徐州·高三统考期中)由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO3等)中提取金属锰的一种流程如下:
下列有关说法正确的是
A.“酸浸”中,FeCO3溶于稀硫酸的离子方程式为:
B.“除铁铝”中,温度越高越有利于除铁铝
C.滤渣Ⅱ的主要成分为和
D.“电解浸出”过程中,溶液的pH变小
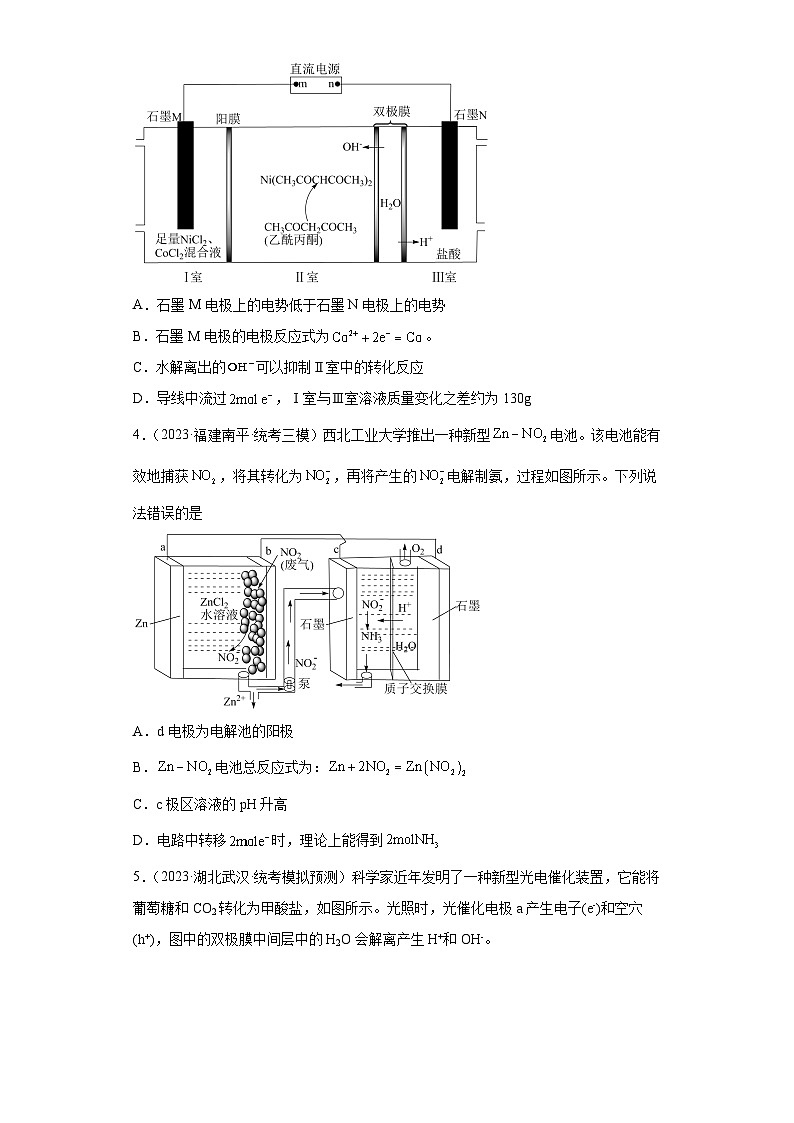
3.(2023·辽宁·校联考模拟预测)镍离子()和钴离子()性质相似,可用如图所示装置实现二者分离。图中的双极膜中间层中的解离为和,并在直流电场作用下分别向两极迁移;与乙酰丙酮不反应。下列说法正确的是
A.石墨M电极上的电势低于石墨N电极上的电势
B.石墨M电极的电极反应式为。
C.水解离出的可以抑制Ⅱ室中的转化反应
D.导线中流过,Ⅰ室与Ⅲ室溶液质量变化之差约为130g
4.(2023·福建南平·统考三模)西北工业大学推出一种新型电池。该电池能有效地捕获,将其转化为,再将产生的电解制氨,过程如图所示。下列说法错误的是
A.d电极为电解池的阳极
B.电池总反应式为:
C.c极区溶液的pH升高
D.电路中转移时,理论上能得到
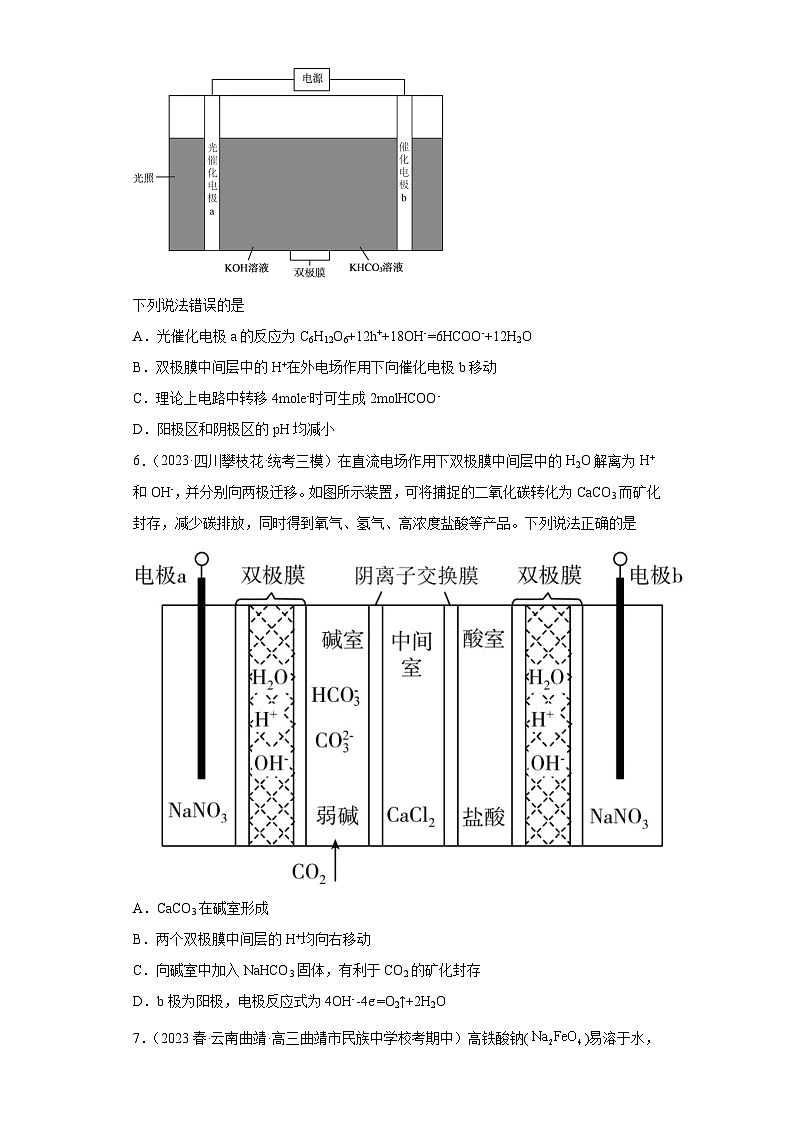
5.(2023·湖北武汉·统考模拟预测)科学家近年发明了一种新型光电催化装置,它能将葡萄糖和CO2转化为甲酸盐,如图所示。光照时,光催化电极a产生电子(e-)和空穴(h+),图中的双极膜中间层中的H2O会解离产生H+和OH-。
下列说法错误的是
A.光催化电极a的反应为C6H12O6+12h++18OH-=6HCOO-+12H2O
B.双极膜中间层中的H+在外电场作用下向催化电极b移动
C.理论上电路中转移4mole-时可生成2molHCOO-
D.阳极区和阴极区的pH均减小
6.(2023·四川攀枝花·统考三模)在直流电场作用下双极膜中间层中的H2O解离为H+和OH-,并分别向两极迁移。如图所示装置,可将捕捉的二氧化碳转化为CaCO3而矿化封存,减少碳排放,同时得到氧气、氢气、高浓度盐酸等产品。下列说法正确的是
A.CaCO3在碱室形成
B.两个双极膜中间层的H+均向右移动
C.向碱室中加入NaHCO3固体,有利于CO2的矿化封存
D.b极为阳极,电极反应式为4OH--4e‑=O2↑+2H2O
7.(2023春·云南曲靖·高三曲靖市民族中学校考期中)高铁酸钠()易溶于水,是一种新型多功能水处理剂,可以用电解法制取,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。下列说法错误的是
A.铁电极与电源正极相连
B.阳极室中发生的电极反应为
C.电解总方程式为
D.电解结束后,阳极室溶液的pH将增大
8.(2023·江西鹰潭·统考二模)为探究电解过程中溶液pH的变化。装置、所得数据结果如图所示。电解过程中,充分搅拌使溶液均匀,忽略溶液体积的变化。下列说法错误的是
A.0-t1时:4AgNO3+2H2O4Ag+O2↑+4HNO3,t1-t2时:2H2O2H2↑+O2↑
B.若进行到t2时刻共有0.224L气体(标况下)产生,则外电路有0.04mol电子通过
C.若使用氢氧燃料电池为电源,t1时,理论上负极消耗的气体物质的量为0.005mol
D.电解到t1时刻,加入1.16gAg2O可使溶液复原
9.(2023·山东济宁·统考二模)可用电化学原理进行氮的氧化物脱除,下图装置可同时吸收和NO(已知连二亚硫酸稀)。
下列说法错误的是
A.N为直流电源的负极
B.装置中P为阳离子交换膜
C.左室的电极反应式为:
D.吸收池中的反应为:
10.(2023·全国·高三专题练习)废水中的有机污染物可通过MFC-电芬顿技术来处理,该技术通过产生羟基自由基处理有机污染物,同时高效净化废水,其耦合系统原理示意图如下,下列说法正确的是
A.甲池中溶液的不变
B.电极为阴极,电极反应为
C.乙池中产生的对废水也能起到净水作用
D.乙池中发生反应,之后部分生成絮状沉淀
11.(2023·全国·高三专题练习)镍钴锰三元材料中为主要活泼元素,镍钴锰电极材料可表示为,,通常简写为,三种元素分别显价。下列说法正确的是
A.放电时元素最先失去电子
B.在材料中,若,则
C.可从充分放电的石墨电极中回收金属锂
D.充电时,当转移电子,两极材料质量差为
12.(2023·湖北·校联考模拟预测)次磷酸镍[]主要用于化学镀镍、金属及塑料着色剂等,工业上利用电解法制备一定量的工作原理如图所示,下列说法错误的是
A.a极接电源正极
B.通电过程中,Ⅳ室溶液中NaOH浓度增大
C.当电路中有2mol电子转移时,透过膜a的离子数目为
D.b电极上电极反应式为
13.(2023秋·河南平顶山·高三统考期末)镍镉电池是一种新型的封闭式小体积的可充电电池,其放电时的工作原理如图所示。下列说法错误的是
A.a极为负极
B.b极的电极反应式为
C.负极区pH减小,正极区pH增大
D.用该电池作电源电解硫酸铜溶液时,电路中通过时,阳极产生
14.(2023春·山西运城·高三康杰中学校考期中)对氨基苯酚(,俗称PAP)是一种重要的精细化工中间体,工业上常采用电解硝基苯的方法制取,其装置原理如图所示。下列说法错误的是
A.电源b为正极
B.电极c上发生的电极反应式为
C.离子交换膜最好用质子交换膜
D.当成时,右侧生成的在标准状况下体积为
二、非选择题
15.(2023秋·云南丽江·高三统考期末)回答下列问题:
(1)锌-空气电池是金属空气电池的一种,电解质溶液为KOH溶液,工作示意图如图1所示。
Zn电极作______极,写出通入空气一极的电极反应式:______。
(2)氯碱工业中电解饱和食盐水的原理示意图如图2所示:
①a口产生的气体是______,c口获得的产品是______,当d口产生标况下2.24L气体时,电路中转移电子的物质的量为______。
②写出电解饱和食盐水的离子方程式______。
(3)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。鉴于腐蚀问题的严重性,国内外对防腐工作都很重视,采取各种措施来减轻腐蚀的危害,图3是金属防护的两个例子。
①为了降低某水库的铁闸门被腐蚀的速率,可以采用图3甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用______(填字母)。
A.铜 B.石墨 C.锌
②图3乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的______(填“正”或“负”)极,该金属防护的方法叫做______。
16.(2023秋·甘肃天水·高三天水市第一中学校考期末)乙醇是一种比较理想的可用于燃料电池的有机物。乙醇来源丰富,可以通过含糖有机物的发酵进行大规模的生产。如图是以乙醇燃料电池为电源,电解含的废气制备示意图(c、d均为石墨电极)。
(1)请判断该装置的电极名称:a__________、c__________。
(2)甲池中a极上的电极反应式为:__________,乙池中c极上的电极反应式:__________。
(3)甲池中向______极迁移,乙池中向______极迁移(用a、b、c、d表示)。
(4)假设电解前,乙池两侧溶液体积均为,左侧溶液中为。电解结束后,左侧溶液中变为,若忽略溶液体积变化,则处理的体积为______mL(标准状况);乙池右侧溶液与电解前相比__________(填“增大”、“减小”、“不变”)。
17.(2023·全国·高三专题练习)天津大学研究团队以溶液为电解质溶液,CoP和纳米片为催化电极材料,电催化合成偶氮化合物(RCN,R代表烃基)的装置如图所示:
极作___________极,电极反应式为____________________;CoP极作__________极,电极反应式为_______________________________。
18.(2023·全国·高三专题练习)回答下列问题:
(1)可利用甲醇燃烧反应设计一个燃料电池。如图1所示,用作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池负极的电极反应式:_______。
②若利用该燃料电池作电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增加时,燃料电池中消耗标准状况下氧气的体积为_______L。
(2)电解法可消除甲醇对水质造成的污染,原理为通电后转化为,然后将甲醇氧化成和(用石墨烯除去)。现用如图2所示装置模拟上述过程,则在阳极的电极反应式为_______。除去甲醇的离子方程式为_______。
(3)一种用铅蓄电池进行电絮凝净水装置如图3所示,回答下列问题:
①装置Ⅰ中Y电极的电极材料是_______(填化学式),工作时向_______(填“X”或“Y”)电极移动;Y电极的电极反应式为_______。
②装置Ⅱ中电极的电极反应式为_______。
③每消耗,装置的电流效率为,则理论上电解池阴极上生成_______。
参考答案:
1.D
【分析】由图可知,左侧电极产生氧气,则左侧电极为阳极,电极a为正极,右侧电极为阴极,b电极为负极,该装置的总反应产生氧气和氢气,相当于电解水,以此解题。
【详解】A.由分析可知,a为正极,b电极为负极,则a端电势高于b端电势,A错误;
B.右侧电极上产生氢气的电极方程式为:2H++2e-=H2↑,则理论上转移生成,B错误;
C.由图可知,该装置的总反应为电解海水的装置,随着电解的进行,海水的浓度增大,但是其pH基本不变,C错误;
D.由图可知,阳极上的电极反应为:,D正确;
故选D。
2.D
【分析】向碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)中加入稀硫酸,SiO2不与稀硫酸反应,滤渣Ⅰ为SiO2,用H2O2将Fe2+转化为Fe3+,加入氨水将Fe2+转化为Fe(OH)3、Al3+转化为Al(OH)3,则滤渣Ⅱ为Fe(OH)3和Al(OH)3。
【详解】A.酸浸时,FeCO3溶于稀硫酸的离子方程式为:FeCO3+2H+=Fe2++H2O+CO2↑,A项错误;
B.“除铁铝”中,H2O2在高温时分解,故温度不能过高,B项错误;
C.根据分析,滤渣Ⅱ为Fe(OH)3和Al(OH)3,C项错误;
D.电解浸出过程的总反应为,生成,溶液的pH值减小,D项正确;
答案选D。
3.D
【详解】A.由图分析,向石墨N电极方向移动,则石墨N电极为阴极、石墨M电极为阳极,石墨M电极上的电势更高,A项错误;
B.石墨M电极上由失电子,电极反应式为,B项错误;
C.由原子守恒和电荷守恒知,Ⅱ室中的转化反应生成,故水解离出的可以促进Ⅱ室中的转化反应,C项错误;
D.由原理可知,导线中流过,Ⅰ室移入Ⅱ室的和的总物质的量为1mol,同时有生成,质量减少,Ⅲ室中阴极反应消耗的由水解离出的等量补充,溶液质量不变,故两室溶液质量变化之差约为,D项正确;
故答案为:D。
4.D
【分析】由图可知,锌为活泼金属,失去电子发生氧化反应,a为负极、b为正极,则c为阴极、d为阳极;
【详解】A.由分析可知,d电极为电解池的阳极,A正确;
B.电池总反应为锌和二氧化氮反应生成亚硝酸锌:,B正确;
C.c极区为阴极区,亚硝酸根离子发生还原生成,溶液碱性增强,故溶液的pH升高,C正确;
D.c极区为阴极区,亚硝酸根离子发生还原生成,电子转移为,则电路中转移时,理论上能得到,D错误;
故选D。
5.C
【分析】科学家近年发明了一种新型光电催化装置,它能将葡萄糖和CO2转化为甲酸盐,光照时,光催化电极a产生电子(e-)和空穴(h+),电子经过电源到达催化电极b处,则光催化电池a为阳极,催化电极b为阴极,以此解答。
【详解】A.该装置可以将葡萄糖转化为甲酸盐,C6H12O6在电极a处得到空穴(h+)生成HCOO-,方程式为:C6H12O6+12h++18OH-=6HCOO-+12H2O,故A正确;
B.电解池中阳离子向阴极移动,则双极膜中间层中的H+在外电场作用下向催化电极b移动,故B正确;
C.CO2在电极b处得到电子生成HCOO-,电极方程式为:CO2+2e-+H2O= HCOO-+OH-,理论上电路中转移4mole-时可以在催化电极b处得到2mol HCOO-,另外光催化电极a处得到2mol HCOO-,共可生成4molHCOO-,故C错误;
D.光催化电极a处发生反应C6H12O6+12h++18OH-=6HCOO-+12H2O,氢氧根浓度减小,pH减小,电极b处CO2转化为甲酸,然后甲酸和KHCO3溶液反应使溶液pH减小,故D正确;
故选C。
6.D
【分析】右侧双极膜中氢离子进入酸室,氢氧根离子右移在电极b上发生还原反应生成O2,所以b为阳极,左侧双极膜中氢氧根离子进入碱室,与二氧化碳反应生成碳酸根离子,氢离子左移在电极a上发生还原反应生成H2,所以a为阴极,以此解答。
【详解】A.由图可知,CO通过左侧阴离子交换膜进入中间室内与Ca2+结合形成碳酸钙,CaCO3 在中间室形成,故A错误;
B.由图可知,右侧双极膜中氢离子进入酸室生成盐酸,左侧双极膜中氢离子左移在电极a上发生还原反应生成H2,故B错误;
C.碱室中二氧化碳和碱反应生成碳酸根离子,碳酸根离子通过左侧阴离子交换膜进入中间室内,与Ca2+结合形成碳酸钙,加入NaHCO3固体会消耗氢氧根不利于CO2的吸收,故C错误;
D.右侧双极膜中氢离子进入酸室,氢氧根离子右移在电极b上发生还原反应生成O2,所以b为阳极,电极反应式为4OH--4e‑=O2↑+2H2O,故D正确;
故选D。
7.D
【分析】装置通电后,铁电极附近生成紫红色的,铁电极为阳极,镍电极有气泡产生,镍电极为阴极。
【详解】A.铁电极为阳极,与电源正极相连,A正确;
B.铁电极上发生的电极反应为,发生氧化反应,B正确;
C.Ni电极发生的电极反应为,铁电极发生的电极反应为,电解总方程式为,C正确;
D.阳极室消耗,且生成水,降低,pH将减小,D错误;
故选D。
8.B
【详解】A.银离子氧化性大于氢离子的氧化性,所以溶液中银离子先被还原,水电离出的OH-被氧化生成氧气,0-t1时:4AgNO3+2H2O4Ag+O2↑+4HNO3,当银离子被电解完,水电离出来的氢离子被还原生成氢气,t1-t2时:2H2O2H2↑+O2↑,故A正确;
B.进行到t1时银离子被完全还原,溶液的pH为1,硝酸银溶液中,,由反应得消耗电子转移0.01mol,设此过程生成氧气的物质的量为,,,,,t1- t2电解水生成的气体体积为0.224L-0.056L=0.168L,其中氧气和氢气体积比为1:2,电解水生成的氧气体积为0.056L,氧气的物质的量为,电子转移0.01mol,共计电子转移0.02mol,故B错误;
C.若使用氢氧燃料电池为电源,氢气与通过电子的关系为: ,t1时,电子转移0.01mol,理论上负极消耗的氢气物质的量为0.005mol,故C正确;
D.电解到t1时刻,生成了0.01mol的银和0.025mol氧气,0.01mol硝酸,加入1.16gAg2O其物质的量为,0.005molAg2O与0.01mol硝酸恰好完全反应生成0.01mol硝酸银和0.005mol水,可使溶液复原,故D正确;
故选:B。
9.D
【分析】由图可知,在右边电极上发生还原反应生成H2S2O4,则右边电极为阴极,电极反应为2+2e-+4H+=H2S2O4+2H2O;在左边电极上SO2发生氧化反应生成H2SO4,左边电极为阳极,电极反应为;结合电解原理分析解答。
【详解】A.由图可知,在右边电极上发生还原反应生成H2S2O4,则右边为电解池的阴极, N极为直流电源的负极,故A正确;
B.电解过程中阳极区生成的氢离子通过离子交换膜向阴极区移动,因此装置中P为阳离子交换膜,故B正确;
C.由图可知,在左边电极上SO2发生氧化反应生成H2SO4,根据得失电子守恒和电荷守恒配平电极方程式为:,故C正确;
D.由图可知,吸收池中NO和H2S2O4反应生成N2和,H2S2O4是弱酸在离子方程式中不能拆,故D错误;
故选D。
10.C
【详解】A.甲池是燃烧电池,反应生成二氧化碳和水,溶液体积增大,磷酸浓度减小,因此溶液的增大,故A错误;
B.氧气为正极,则电极为阳极,电极反应为,故B错误;
C.乙池中产生的会形成氢氧化铁胶体,对废水起到净水作用,故C正确;
D.铁离子和氢氧根会反应,则乙池中发生反应,故D错误。
综上所述,答案为C。
11.B
【分析】图为原电池时,A极LinC,B极Li1-nMO2,隔膜中X通过,应该为Li+,原电池中阳离子定向移动到正极,故B为正极,电极反应为;A为负极,电极反应为,电极总反应为;
【详解】A.中金属性最强的为Mn,放电时Mn元素最先失去电子,选项A错误;
B.在中,,三种元素分别显价,若x:y:z=2:3:5,根据化合价中元素正负化合价的代数和为0可得:+1(1-a)+(+20.2)+(+30.3)+(+40.5)+(-2)2=0,解得a=0.3,选项B正确;
C.B电极反应为,不能通过充分放电的石墨电极中回收金属锂,选项C错误;
D.充电时阴极发生反应nLi++C6+ne-=LinC6,当转移nmol电子时,有nmolLi+进入负极的C6材料中,故理论上负极材料增加nmolLi,质量增加7ng,阳极,质量减少7ng,故两极材料质量变化量相差为,而无法确定两极质量差,选项D错误;
答案选B。
12.C
【分析】电镀时镀层金属失电子,故a连接正极,为电解池的阳极,不锈钢连接电源的负极,为阴极;
【详解】A.电解中单质镍只有做阳极才能转化为,选项A正确;
B.进入Ⅱ室,Ⅳ室是阴极室,得电子转化为、,由于溶液中阴离子浓度增大,故Ⅲ室中的应进入Ⅳ室,导致Ⅳ室溶液中增大,选项B正确;
C.电路中转移的电子所带电量应与通过指定膜的离子所带电荷相等,通过膜a进入Ⅱ室,离子数目为,选项C错误;
D.进入Ⅱ室,Ⅳ室是阴极室,得电子转化为、,由于溶液中阴离子浓度增大,故Ⅲ室中的应进入Ⅳ室,导致Ⅳ室溶液中增大,选项D正确;
答案选C。
13.D
【分析】根据图中信息可知放电时b极变为,Ni化合价降低,为正极,a为负极。
【详解】A.根据图中信息可知放电时a极为负极,b极为正极,A项正确;
B.正极变为,则放电时b极的电极反应式为,B项正确;
C.根据图示,负极反应式为,则负极区pH减小,根据b极电极反应式可知,正极区pH增大,C项正确;
D.未给出具体电极,且1.12L氧气所处的温度和压强条件未知,无法判断,D项错误;
故选D。
14.D
【分析】经过装置图分析,电极d中,CH3COO−转化为CO2,碳元素化合价升高,失去电子,是阳极,则电极b是正极,电极a是负极。
【详解】A.CH3COO−转化为CO2,碳元素化合价升高,属于氧化反应,则d为阳极,b为正极,A正确;
B.NH4Cl溶液显酸性,c电极上发生反应的电极反应式为+4H++4e-=+H2O ,B正确;
C.电解池中左侧消耗H+,右侧产生H+,故离子交换膜选用质子交换膜,C正确;
D.d电极的反应式为:CH3COO−−8e−+2H2O=7H++2CO2↑,当生成1mol时转移4mole−,右侧生成的CO2在标准状况下体积为22.4L,D错误;
故选:D。
15.(1) 负 O2+2H2O+4e-=4OH-
(2) Cl2 NaOH 0.2mol 2Cl-+2H2O2OH-+H2↑+Cl2↑
(3) C 负 外加电流法
【详解】(1)锌易失电子发生氧化反应,Zn电极作负极,氧气易得电子发生还原反应,通入空气一极是正极,正极氧气得电子生成氢氧根离子,电极反应式O2+2H2O+4e-=4OH-;
(2)①左侧电极为阳极,阳极氯离子失电子生成氯气,a口产生的气体是Cl2;右侧是阴极,阴极反应式为,所以c口获得的产品是NaOH,d口放出氢气, 当d口产生标况下2.24L气体时,电路中转移电子的物质的量为0.2mol。
②电解饱和食盐水生成氢气、氯气、氢氧化钠,反应的离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑。
(3)①图3甲所示的方案为牺牲阳极法,其中焊接在铁闸门上的固体材料R的活泼性大于铁,故选C。
②图3乙方案为外加电流阴极保护法,其中铁闸门应该连接在直流电源的负极。
16.(1) 负极 阳极
(2)
(3) b d
(4) 448 不变
【详解】(1)a极进入甲醇,甲醇失电子为负极,b极进入氧气,为正极,与正极相连的c极就是阳极。
(2)a极进入甲醇,甲醇失电子为负极,发生氧化反应,a极上的电极反应式:CH3CH2OH+3H2O-12e-=2CO2↑+12H+。乙池中c极与正极相连则为阳极,阳极NO失电子发生氧化反应,根据题意可知生成硝酸根,电极反应式:NO-3e-+2H2O=+4H+。
(3)甲池为原电池,向正极(b极)迁移,乙池为电解池,向阴极(d极)迁移。
(4)乙池两侧溶液体积均为100ml,左侧溶液中c(HNO3)为0.1 mol/L。电解结束后,左侧溶液中c(HNO3)变为0.3 mol/L,反应后增加了(0.3 mol/L-0.1 mol/L)×0.1L=0.02mol,根据N原子守恒可知,处理NO的物质的量为0.02mol,体积为0.02mol×22.4L/mol=0.448L=448mL。生成的氢离子会通过质子交换膜向右侧移动,所以乙池右侧溶液的pH与电解前相比不变。
17. 阳 阴
【详解】,发生去氢的氧化反应,则极为阳极,电极反应式为。,发生去氧的还原反应,则极作阴极,电极反应式为。
18.(1) B 1.12
(2)
(3) X 、
【详解】(1)①用作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气,甲醇失电子发生氧化反应生成碳酸根离子和水,通入甲醇的一极为负极,负极的电极反应式为;
②利用该燃料电池作电源,与题图1右边烧杯相连,在铁件表面镀铜,则铁件作电解池的阴极,阴极与电源负极连接,题图1中与甲醇相连的B电极是阴极;所以铁件应是B极;在铁件表面镀铜,当铁件的质量增加时,根据可知转移电子,燃料电池中消耗氧气的电极反应式为,依据得失电子守恒,消耗的氧气的物质的量为,标准状况下氧气的体积为;
(2)通电后,转化为,电解池中阳极失电子发生氧化反应,电极反应式为;作氧化剂把水中的甲醇氧化成和,自身被还原为,反应的离子方程式为;
(3)①由装置Ⅱ中电极失电子发生的氧化反应知为阳极、为阴极,与相接的铅蓄电池的Y电极为正极,电极材料是;工作时向负极移动,即移向X电极;Y电极得电子生成PbSO4,电极反应式为。
②装置Ⅱ是电絮凝净水装置,工作时,转化为胶体,电极反应式为;由题图3知,还发生反应。
③由可知消耗,转移电子的物质的量为,装置的电流效率为,故装置Ⅱ阴极上参与反应的电子为,该电极反应式为,即产生。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习—电解池,共24页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习:电解池,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习---电解池,共23页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。












