

统考版2024版高考化学一轮复习微专题小练习专练52实验综合应用一
展开2.下列实验操作不当的是( )
A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
3.下列实验操作、现象、解释或结论都正确的是( )
4.[2023·广东佛山一检]实验室可用如图装置探究石蜡油分解产物的性质,下列说法错误的是( )
A.仪器①可控制石蜡油滴加的速率
B.装置②起到防倒吸的作用
C.实验过程中,关闭K1,打开K2,装置②中溶液颜色逐渐褪去
D.加热一段时间后,关闭K2,打开K1,在③处点燃气体可看到淡蓝色火焰
5.[2023·福建永安三中月考]关于下列各装置图的叙述中,错误的是( )
A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③检查乙炔的还原性(实验室是由饱和食盐水与电石制乙炔,产生的混合气体除乙炔外,常含有H3P,H2S等杂质气体)
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
6.草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A.若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B.通入N2的主要目的是防止空气中的CO2对产物检验产生影响
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,①中淡黄色粉未完全变成黑色,则产物一定为铁
7.[2023·辽宁沈阳市郊联体月考]用下列实验装置(部分夹持装置已略去)进行相应的实验,能达到实验目的的是( )
A.加热图1中烧杯用于分离I2和高锰酸钾固体
B.用图2装置验证二氧化硫的漂白性
C.用图3装置制备氢氧化亚铁
D.用图4装置检验氯化铵受热分解生成的两种气体
8.[2023·黑龙江大庆月考]下列有关实验操作、现象和解释或结论都正确的是( )
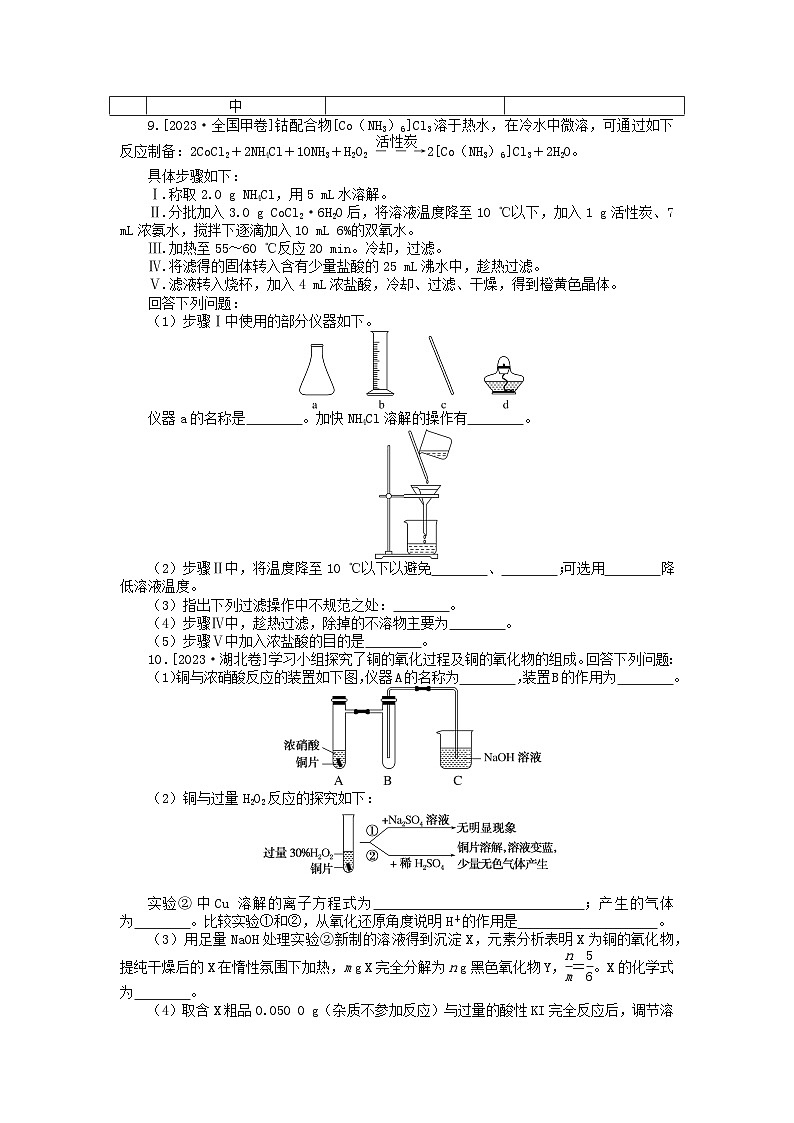
9.[2023·全国甲卷]钴配合物[C(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:2CCl2+2NH4Cl+10NH3+H2O2 eq \(――→,\s\up7(活性炭)) 2[C(NH3)6]Cl3+2H2O。
具体步骤如下:
Ⅰ.称取2.0 g NH4Cl,用5 mL水溶解。
Ⅱ.分批加入3.0 g CCl2·6H2O后,将溶液温度降至10 ℃以下,加入1 g活性炭、7 mL浓氨水,搅拌下逐滴加入10 mL 6%的双氧水。
Ⅲ.加热至55~60 ℃反应20 min。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的25 mL沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入4 mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10 ℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
10.[2023·湖北卷]学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为 ,装置B的作用为 。
(2)铜与过量H2O2反应的探究如下:
实验②中Cu溶解的离子方程式为 ;产生的气体为 。比较实验①和②,从氧化还原角度说明H+的作用是 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y, eq \f(n,m) = eq \f(5,6) 。X的化学式为 。
(4)取含X粗品0.050 0 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.100 0 ml·L-1Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液15.00 mL。(已知:2Cu2++4I-===2CuI↓+I2,I2+2S2O eq \\al(\s\up1(2-),\s\d1(3)) ===2I-+S4O eq \\al(\s\up1(2-),\s\d1(6)) )标志滴定终点的现象是 ,粗品中X的相对含量为 。
专练52 实验综合应用一
1.C A项,CH3COONH4为弱酸弱碱盐,NH eq \\al(\s\up1(+),\s\d1(4)) 对CH3COO-的水解有影响,可以分别测同浓度的CH3COONa与NaHCO3溶液的pH,错误;B项,KMnO4溶液与浓盐酸也可以发生氧化还原反应而褪色,不能验证溶液中是否有Fe2+,错误;C项,存在可逆反应:2CrO eq \\al(\s\up1(2-),\s\d1(4)) (黄色)+2H+⇌Cr2Oeq \\al(\s\up1(2-),\s\d1(7))(橙红色)+H2O,氢离子浓度增大,平衡正向移动,正确;D项,乙醇与钠也可以发生反应产生氢气,不能用来检验乙醇中是否含有水,错误。
2.B 锌粒与加入的硫酸铜溶液发生置换反应,置换出单质铜,形成锌铜原电池,反应速率加快,A正确;用盐酸滴定碳酸氢钠溶液,滴定终点时,碳酸氢钠应该完全反应转化为氯化钠、水和二氧化碳,此时溶液应该显酸性(二氧化碳在水中形成碳酸),应该选择酸变色的甲基橙为指示剂,B错误;用铂丝蘸取盐溶液在火焰上灼烧,进行焰色反应,火焰为黄色,说明该盐溶液中一定有Na+,C正确;蒸馏时,为保证加热过程中液体不会从烧瓶内溢出,一般要求液体的体积不超过烧瓶体积的三分之二,D正确。
3.C 将少量浓硝酸分多次加入Cu和稀硫酸的混合液中,相当于Cu与稀硝酸反应,还原产物是一氧化氮,一氧化氮易与氧气反应生成二氧化氮,故A错误; 火焰呈黄色,说明是含钠元素的物质,不能确定一定是钠盐,故B错误; 因为相同温度下Ksp(AgI)
5.C 由电流方向可知a是正极,b是负极,电解时, c为阳极,溶液中氯离子在此极发生氧化反应生成能使湿润的淀粉KI试纸变蓝的气体氯气,A正确; H2、NH3、Cl2、HCl、NO2可以采用排空气法来收集,收集H2、NH3时,导管是短进长出,收集Cl2、HCl、NO2时,导管长进短出,B正确;乙炔中含有杂质硫化氢等,硫化氢具有还原性,能使酸性高锰酸钾溶液褪色,影响到乙炔的还原性的检验,C错误;氨气的收集采用向下排空气法,导管可以短进长出,用碱石灰来干燥,用水来吸收时,要防止倒吸,故D正确。
6.A ③中放足量NaOH溶液,利用②③检验并除去CO2,④中的无水CaCl2将气体干燥后,如果⑤中黑色CuO固体变红,⑥中澄清石灰水变浑浊,说明有CO生成,A正确;实验时应先打开 K1,通入N2以除去装置内的空气,并且在反应后继续通入氮气至装置冷却到室温,防止⑥中澄清石灰水倒吸入⑤中,故 B 错误;因混合气体经过了②澄清石灰水,③NaOH溶液,必然会有水蒸气,使无水硫酸铜变蓝,不能证明分解生成产物中有水蒸气,C错误;实验结束后,①中淡黄色粉未完全变成黑色,可能为铁,也可能为FeO,Fe3O4,D错误。
7.D A项,加热使得碘升华,高锰酸钾分解,不能达到分离的目的,错误;B项,SO2使溴水褪色,体现SO2的还原性,错误;C项,图3装置中NaOH溶液无法与硫酸亚铁溶液接触,不能制备氢氧化亚铁,错误。
8.C A项,酸性条件下Fe2+能被NO eq \\al(\s\up1(-),\s\d1(3)) 氧化为Fe3+,不能说明Fe(NO3)2已变质,错误;B项,由于NH3极易溶于水,在生成NH3的量较少的情况下,不加热不能够逸出氨气,错误;D项,浓硝酸受热分解也可以生成NO2红棕色气体,错误。
9.(1)锥形瓶 升温,搅拌等
(2)浓氨水分解和挥发 双氧水分解 冰水浴
(3)玻璃棒没有紧靠三层滤纸处,漏斗末端较长处(尖嘴部分)没有紧靠在“盛滤液”的烧杯内壁
(4)活性炭
(5)利用同离子效应,促进钴配合物[C(NH3)6]Cl3尽可能完全析出,提高产率
解析:(1)由图中仪器的结构特征可知,a为锥形瓶;加快氯化铵溶解可采用升温,搅拌等;
(2)步骤Ⅱ中使用了浓氨水和双氧水,它们高温下易挥发,易分解,所以控制在10 ℃以下,避免浓氨水分解和挥发,双氧水分解。要控制温度在10 ℃以下,通常采用冰水浴降温;
(3)图中为过滤装置,玻璃棒没有紧靠三层滤纸处,可能戳破滤纸,造成过滤效果不佳。还有漏斗末端较长处(尖嘴部分)没有紧靠在“盛滤液”的烧杯内壁,可能导致液滴飞溅;
(4)步骤Ⅳ中,将所得固体转入有少量盐酸的沸水中,根据题目信息,钴配合物[C(NH3)6]Cl3溶于热水,活性炭不溶于热水,所以趁热过滤可除去活性炭;
(5)步骤Ⅴ中,将滤液转入烧杯,由于钴配合物[C(NH3)6]Cl3中含有氯离子,加入4 mL浓盐酸,可利用同离子效应,促进钴配合物[C(NH3)6]Cl3尽可能完全析出,提高产率,故答案为:利用同离子效应,促进钴配合物[C(NH3)6]Cl3尽可能完全析出,提高产率。
10.(1)具支试管 防倒吸
(2) Cu+H2O2+2H+=== Cu2++2H2O O2 既不是氧化剂,又不是还原剂
(3)CuO2
(4)溶液蓝色消失,且半分钟不恢复原来的颜色 72%
解析:(1)由图可知,仪器A的名称为具支试管;铜和浓硝酸反应生成硝酸铜和二氧化氮,其中二氧化氮易溶于水,需要防倒吸,则装置B的作用为防倒吸;
(2)根据实验现象,铜片溶解,溶液变蓝,可知在酸性条件下铜和过氧化氢发生反应,生成硫酸铜,离子方程式为:Cu+H2O2+2H+=== Cu2++2H2O;硫酸铜可以催化过氧化氢分解生成氧气,则产生的气体为O2;在铜和过氧化氢的反应过程中,氢元素的化合价没有发生变化,故从氧化还原角度说明H+的作用是:既不是氧化剂,又不是还原剂;
(3)在该反应中铜的质量m(Cu)=n× eq \f(64,80) = eq \f(4n,5) ,因为 eq \f(n,m) = eq \f(5,6) ,则m(O)=n× eq \f(16,80) +(m-n)= eq \f(2n,5) ,则X的化学式中铜原子和氧原子的物质的量之比为: eq \f(n(Cu),n(O)) = eq \f(\f(4n,5×64),\f(2n,5×16)) = eq \f(1,2) ,则X为CuO2;
(4)滴定结束的时候,单质碘消耗完,则标志滴定终点的现象是:溶液蓝色消失,且半分钟不恢复原来的颜色;在CuO2中铜为+2价,氧为-1价,根据2Cu2++4I-===2CuI↓+I2,I2+2S2O eq \\al(\s\up1(2-),\s\d1(3)) ===2I-+S4O eq \\al(\s\up1(2-),\s\d1(6)) ,可以得到关系式:CuO2~2I2~4S2O eq \\al(\s\up1(2-),\s\d1(3)) ,则n(CuO2)= eq \f(1,4) ×0.1 ml/L×0.015 L=0.000 375 ml,粗品中X的相对含量为 eq \f(0.000 375×96,0.05) ×100%=72%。
选项
实验目的
实验及现象
结论
A
比较CH3COO-和HCO eq \\al(\s\up1(-),\s\d1(3)) 的水解常数
分别测浓度均为0.1 ml·L-1的CH3COONH4和NaHCO3溶液的pH,后者大于前者
Kh(CH3COO-)
检验铁锈中是否含有二价铁
将铁锈溶于浓盐酸,滴入KMnO4溶液。紫色褪去
铁锈中含有二价铁
C
探究氢离子浓度对CrO eq \\al(\s\up1(2-),\s\d1(4)) 、Cr2O eq \\al(\s\up1(2-),\s\d1(7)) 相互转化的影响
向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色
增大氢离子浓度,转化平衡向生成Cr2O eq \\al(\s\up1(2-),\s\d1(7)) 的方向移动
D
检验乙醇中是否含有水
向乙醇中加入一小粒金属钠,产生无色气体
乙醇中含有水
选项
实验操作
实验现象
解释或结论
A
将少量浓硝酸分多次加入Cu和稀硫酸的混合液中
产生红棕色气体
硝酸的还原产物是NO2
B
某粉末用酒精润湿后,用铂丝蘸取做焰色反应
火焰呈黄色
该粉末一定是钠盐
C
向新生成的AgCl浊液中滴入KI溶液
白色沉淀逐渐转化为黄色沉淀
Ksp(AgI)
将少量牛油加入到纯碱溶液中,加热一段时间
液体不分层
油脂可直接与纯碱反应
实验操作
现象
解释或结论
A
将少量Fe(NO3)2加水溶解后,滴加稀H2SO4酸化,再滴加KSCN溶液
溶液变成血红色
Fe(NO3)2已变质
B
取某溶液于试管中,滴入稀NaOH溶液
试管口处湿润的红色石蕊试纸未变蓝
溶液中一定不含有NH eq \\al(\s\up1(+),\s\d1(4))
C
向某无色溶液中先滴加BaCl2溶液再滴加硝酸
生成白色沉淀
无法证明原溶液中是否存在SO eq \\al(\s\up1(2-),\s\d1(4))
D
红热的木炭加入到浓硝酸中
有红棕色气体产生
浓硝酸与木炭发生反应
高考化学《微专题 小练习》统考版 专练 52: 这是一份高考化学《微专题 小练习》统考版 专练 52,共5页。
新高考2024版高考化学一轮复习微专题小练习专练53实验综合应用二: 这是一份新高考2024版高考化学一轮复习微专题小练习专练53实验综合应用二,共6页。试卷主要包含了92 g,1%)等内容,欢迎下载使用。
新高考2024版高考化学一轮复习微专题小练习专练52实验综合应用一: 这是一份新高考2024版高考化学一轮复习微专题小练习专练52实验综合应用一,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












