【暑假初升高】人教版化学初三(升高一)暑假预习-第02讲 电解质的电离——电解质与非电解质 强弱电解质 讲学案
展开第02讲 电解质的电离——电解质与非电解质 强弱电解质
【学习目标】
1.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
2.知道电解质与非电解质是化合物的一种分类方法,理解其分类的依据是化合物能否电离。
3.知道根据电解质的电离程度将其分为强电解质和弱电解质。
4.能用电离方程式表示某些酸、碱、盐的电离,根据电离出的离子理解酸、碱、盐的通性。
【基础知识】
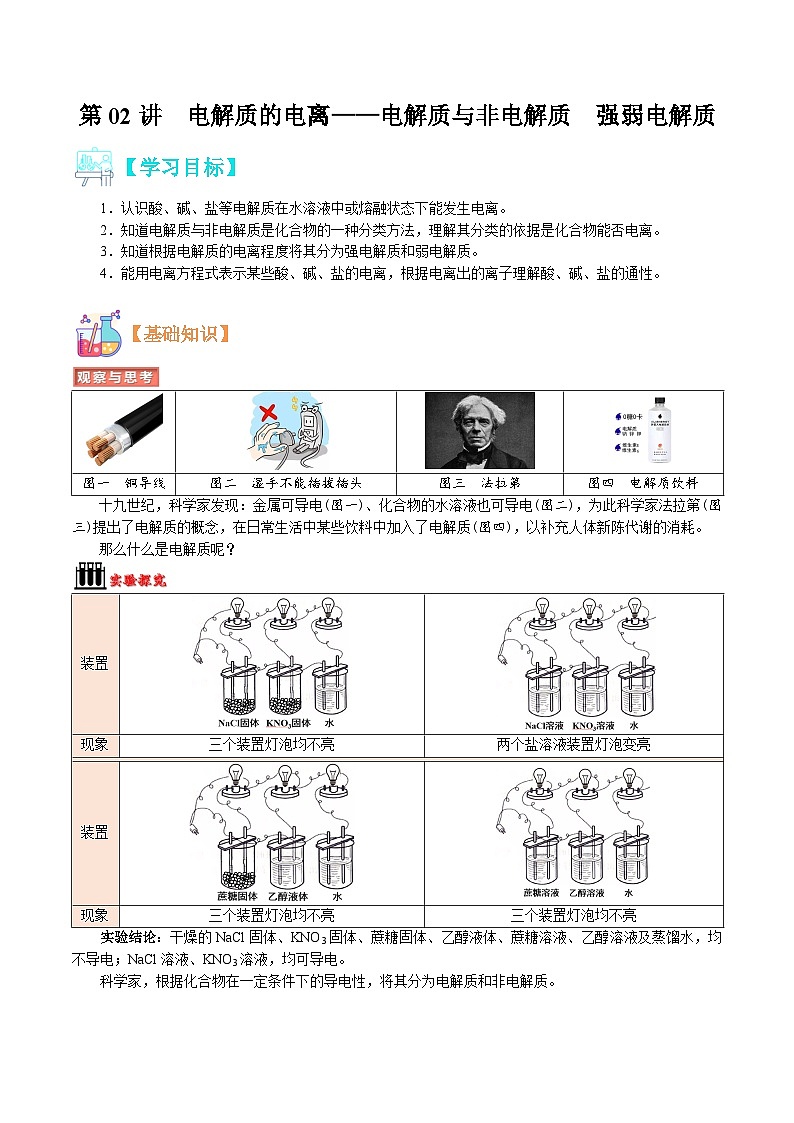
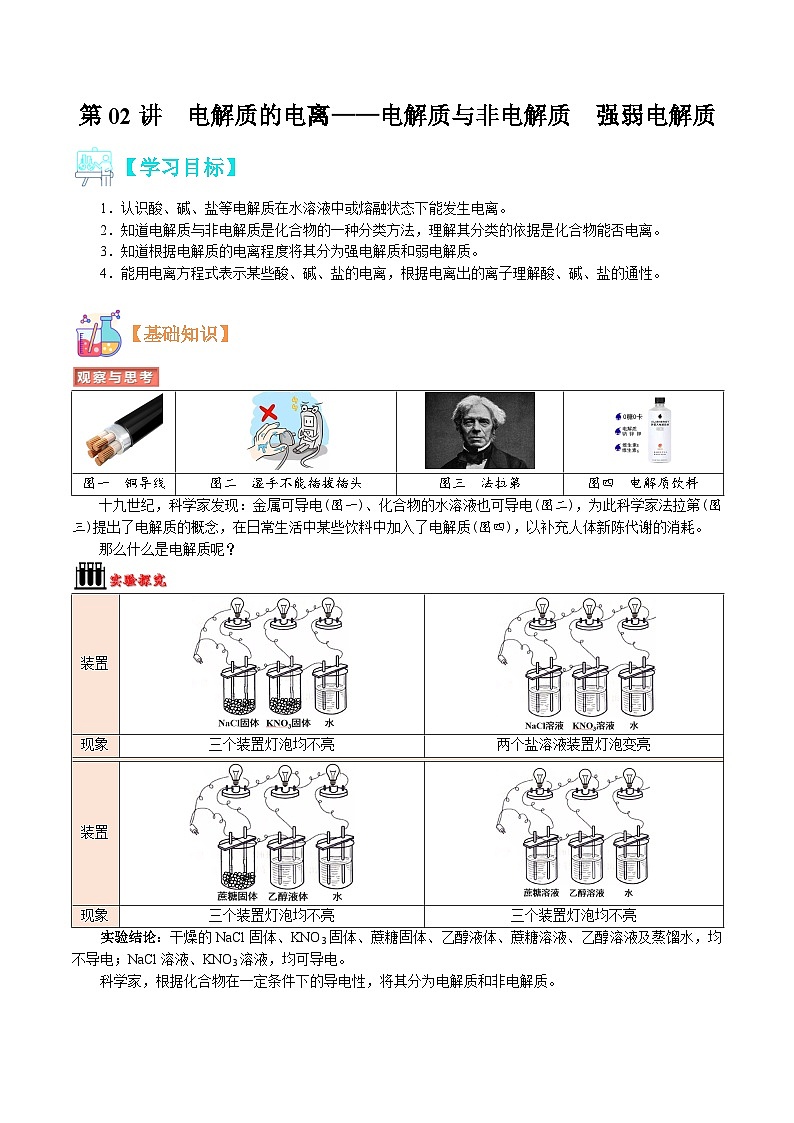
图一 铜导线
图二 湿手不能插拔插头
图三 法拉第
图四 电解质饮料
十九世纪,科学家发现:金属可导电(图一)、化合物的水溶液也可导电(图二),为此科学家法拉第(图三)提出了电解质的概念,在日常生活中某些饮料中加入了电解质(图四),以补充人体新陈代谢的消耗。
那么什么是电解质呢?
装置
现象
三个装置灯泡均不亮
两个盐溶液装置灯泡变亮
装置
现象
三个装置灯泡均不亮
三个装置灯泡均不亮
实验结论:干燥的NaCl固体、KNO3固体、蔗糖固体、乙醇液体、蔗糖溶液、乙醇溶液及蒸馏水,均不导电;NaCl溶液、KNO3溶液,均可导电。
科学家,根据化合物在一定条件下的导电性,将其分为电解质和非电解质。
严格来说,蒸馏水也能导电,只是导电能力非常弱,只是用上述实验装置不能测出。
一、电解质与非电解质
1.物质导电条件及原因
固体电解质
不导电,只有在水溶液里或受热熔化时才能导电。
电解质在水溶液里或受热熔化时发生了电离,电离出了能自由移动的阴阳离子,阴阳离子在电场作用下发生定向移动。
金属(或石墨)
能够导电
金属(或石墨)中存在自由移动的电子,电子在外电场的作用下,定向移动形成电流而导电。
(1)一般来说,对于NaOH、KCl等可溶性的碱和盐,在水溶液和熔融状态都可以导电。
(2)有些难溶于水的电解质只在熔融状态下才能导电,难溶性的盐如BaSO4、金属氧化物如Fe2O3。
(3)像HCl、H2SO4等酸只能在水溶液才可以导电,但熔融状态下不导电。
2.电解质与非电解质
电解质
非电解质
概念
在水溶液或熔融状态下能够导电的化合物
在水溶液里和熔融状态下均不能导电的化合物
类别
化合物
化合物
本质
在水溶液或熔融状态下自身能发生电离
在水溶液或熔融状态下自身不能发生电离
化合物类型
酸:H2SO4、HNO3、HCl、H2CO3
碱:NaOH、KOH、NH3·H2O、Fe(OH)3
盐:NaCl、CuSO4、AgCl、BaSO4
活泼金属氧化物:Na2O、CaO、Al2O3
其他:H2O
非金属氧化物:CO2、SO2、SO3
某些非金属氢化物:CH4、NH3
多数有机物:乙醇、蔗糖
(1)从物质分类角度:电解质和非电解质都是化合物,单质(如Cu、Fe)和混合物(如盐酸、食盐水)既不是电解质,也不是非电解质。
(2)从电离角度:电解质必须是自身能直接电离成自由移动离子的化合物,某些化合物如CO2溶于水可导电,但其本身不是电解质,与水反应生成的H2CO3才是电解质。
(3)从性质角度:电解质导电的条件是电解质溶于水或熔融状态下能自身电离的化合物,二者具备其一即可。与溶解度大小无关,如蔗糖溶于水,但是蔗糖是非电解质;难溶于水的盐,如BaSO4、AgCl在熔融状态下完全电离,在水中溶解的部分也能完全电离,是电解质。
电解质与导电性之间没有必然的关系:
(1)电解质不一定都能导电:如NaCl固体、HCl气体。是电解质。
(2)能导电的物质不一定是电解质:如石墨、金属单质、溶液。
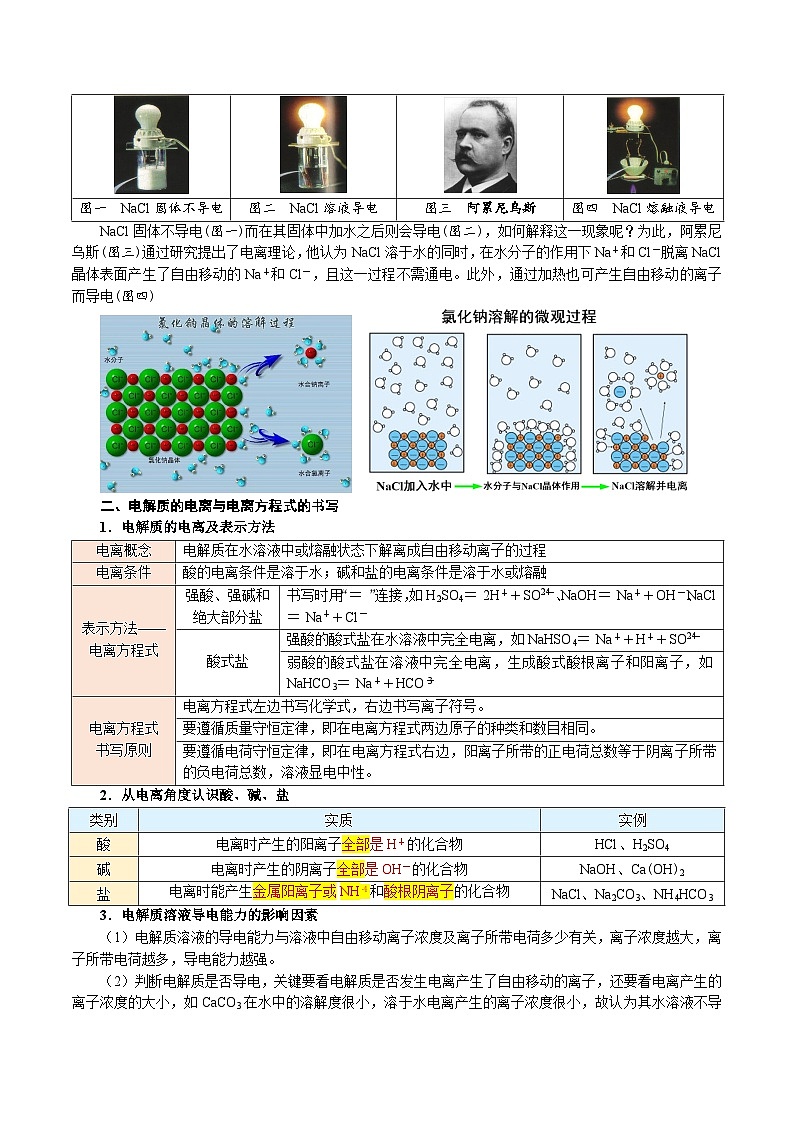
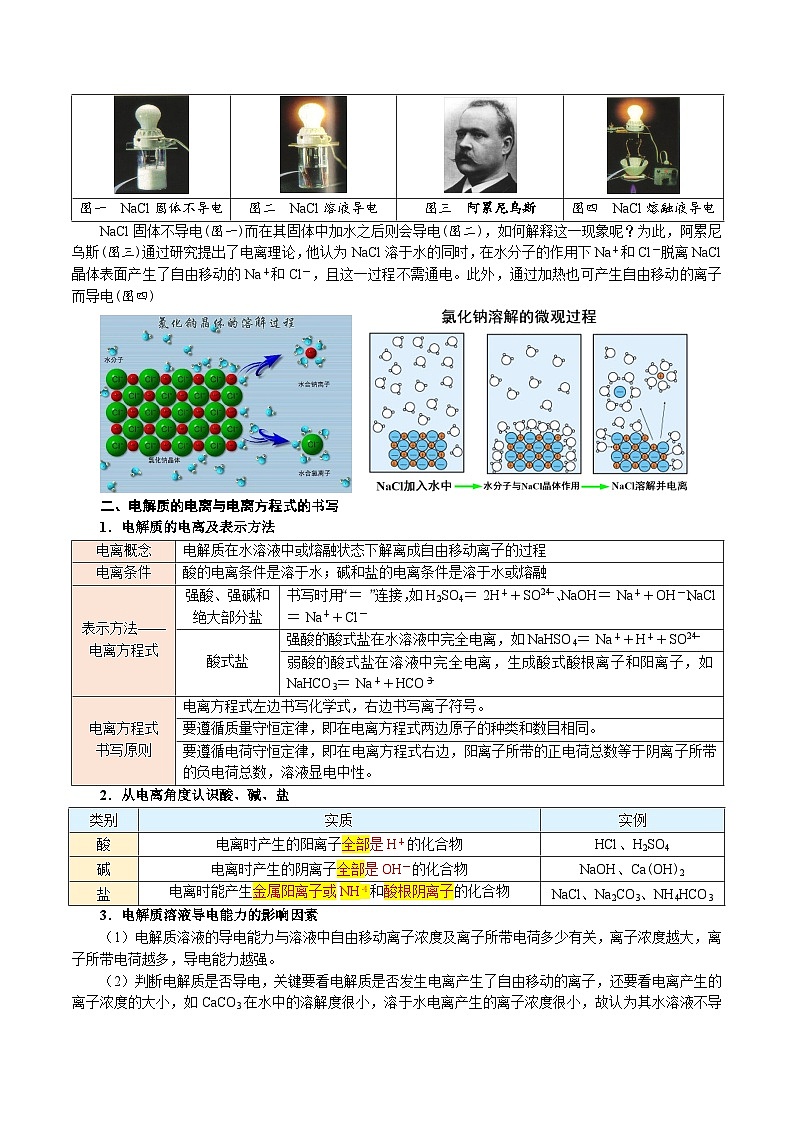
图一 NaCl固体不导电
图二 NaCl溶液导电
图三 阿累尼乌斯
图四 NaCl熔融液导电
NaCl固体不导电(图一)而在其固体中加水之后则会导电(图二),如何解释这一现象呢?为此,阿累尼乌斯(图三)通过研究提出了电离理论,他认为NaCl溶于水的同时,在水分子的作用下Na+和Cl-脱离NaCl晶体表面产生了自由移动的Na+和Cl-,且这一过程不需通电。此外,通过加热也可产生自由移动的离子而导电(图四)
二、电解质的电离与电离方程式的书写
1.电解质的电离及表示方法
电离概念
电解质在水溶液中或熔融状态下解离成自由移动离子的过程
电离条件
酸的电离条件是溶于水;碱和盐的电离条件是溶于水或熔融
表示方法——电离方程式
强酸、强碱和绝大部分盐
书写时用“=”连接,如H2SO4=2H++SO、NaOH=Na++OH-、NaCl=Na++Cl-
酸式盐
强酸的酸式盐在水溶液中完全电离,如NaHSO4=Na++H++SO
弱酸的酸式盐在溶液中完全电离,生成酸式酸根离子和阳离子,如NaHCO3=Na++HCO
电离方程式
书写原则
电离方程式左边书写化学式,右边书写离子符号。
要遵循质量守恒定律,即在电离方程式两边原子的种类和数目相同。
要遵循电荷守恒定律,即在电离方程式右边,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,溶液显电中性。
2.从电离角度认识酸、碱、盐
类别
实质
实例
酸
电离时产生的阳离子全部是H+的化合物
HCl、H2SO4
碱
电离时产生的阴离子全部是OH-的化合物
NaOH、Ca(OH)2
盐
电离时能产生金属阳离子或NH和酸根阴离子的化合物
NaCl、Na2CO3、NH4HCO3
3.电解质溶液导电能力的影响因素
(1)电解质溶液的导电能力与溶液中自由移动离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。
(2)判断电解质是否导电,关键要看电解质是否发生电离产生了自由移动的离子,还要看电离产生的离子浓度的大小,如CaCO3在水中的溶解度很小,溶于水电离产生的离子浓度很小,故认为其水溶液不导电。
装置
现象
结论
盛有盐酸、NaOH溶液、NaCl溶液三烧杯的灯泡很亮;盛有CH3COOH溶液、氨水溶液二烧杯的灯泡较暗
HCl、NaOH、NaCl与CH3COOH、NH3·H2O两类溶液中,电解质的电离能力不同
根据电解质的电离程度的不同,把电解质分为——强电解质和弱电解质。
强电解质
强电解质
概念
在水溶液中,全部电离成离子的电解质
在水溶液中,只有一部分电离成离子的电解质
电离程度
完全
部分
表示
用“=”
用“”
类别
强酸:HCl、H2SO4、HNO3
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
大多数盐:NaCl、(NH4)2SO4、AgCl
弱酸:CH3OOH、H2CO3、HClO
弱碱:NH3·H2O、Fe(OH)3、Cu(OH)2
少数盐(如醋酸铅)和H2O
1.多元弱酸的电离方程式,分步书写:如H2CO3H++HCO3-、HCO3-H++CO32-。
2.多元弱碱的电离方程式,一步书写:如Fe(OH)3Fe3++3OH-。
【考点剖析】
考点一:物质的导电性判断与实验
例1.(2022年江苏省宿迁市沭阳县期中)溶液的导电能力(I)与溶液中离子浓度的大小有关,向Ba(OH)2溶液中滴加H2SO4溶液时,溶液的导电能力与所加H2SO4溶液的体积的关系如图所示,下列说法不正确的是
A.a点溶液导电能力较强,说明Ba(OH)2是电解质
B.b点到c点溶液中,b点SO42-的浓度最小
C.a点到b点的过程中,白色沉淀增多
D.c点观察到的现象是白色沉淀溶解
【答案】D
【解析】A项,a点溶液导电能力较强,说明Ba(OH)2溶液能导电,Ba(OH)2是电解质,正确;B项,b点溶液导电能力最小,说明氢氧化钡和硫酸恰好反应,b点溶液中SO42-的浓度最小,正确;C项,a点到b点的过程中,氢氧化钡和硫酸逐渐反应,白色沉淀逐渐增多,正确;D项,b点氢氧化钡和硫酸恰好反应生成硫酸钡沉淀,c点硫酸过量,硫酸钡难溶于硫酸,错误。
考点二:电解质与非电解质的概念辨析
例2.(2022年贵州省毕节市第一次联考)下列关于电解质的叙述正确的是
A.能导电的物质一定是电解质
B.电解质一定是固体化合物,不可能是单质
C.电解质在熔融状态下一定能导电
D.电解质一定是纯净物,不可能是混合物
【答案】D
【解析】A项,金属单质导电,但是单质不是电解质,错误;B项,氯化氢气体溶于水可以导电,故为电解质,故电解质不一定是固体化合物,错误;C项,氯化氢溶于水导电,为电解质,但是在熔融状态下不导电,错误;D项,电解质是溶于水或熔融状态下导电的化合物,正确。
电解质和非电解质是化合物的一种分类方法,根据化合物在水溶液或熔融状态能否电离来分为电解质和非电解质,电解质能否导电关键看体系中有无自由移动的离子存在。
考点三:电解质与非电解质的判断
例3.(2022年江苏省徐州市第七中学期中)下列物质属于电解质的是
A.NaOH溶液 B.KNO3固体 C.酒精 D.石墨
【答案】B
【解析】A项,NaOH溶液是混合物,不是化合物,因此不属于电解质,不符合题意;B项,KNO3固体是盐,属于化合物,在水溶液中或熔融状态下能够发生电离而导电,因此属于电解质,符合题意;C项,酒精是化合物,在水溶液中或熔融状态下都不能够发生电离而导电,因此属于非电解质,不符合题意;
D项,石墨是非金属单质,不是化合物,因此不属于电解质,不符合题意。
考点四:电解质的电离方程式
例4.(2022年北京市丰台区期中)下列电离方程式书写不正确的是
A.HNO3=H++NO3- B.Ba(OH)2=Ba2++OH-
C.NH4NO3=NH+NO3- D.NaHCO3=Na++HCO3-
【答案】B
【解析】A项,HNO3为强酸,发生完全电离,生成H+和NO3-,正确;B项,Ba(OH)2为强碱,发生完全电离,生成Ba2+和OH-,但电离方程式应为Ba(OH)2=Ba2++2OH-,不正确;C项,NH4NO3为强电解质,发生完全电离,生成NH和NO3-,正确;D项,NaHCO3为强电解质,发生完全电离,生成Na+和HCO3-,正确。
【真题演练】
1.(2022年湖北省期中)目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.生理盐水 B.葡萄糖 C.MgSO4 D.CO2
【答案】C
【解析】A项,生理盐水是氯化钠的水溶液,属于混合物,不属于电解质,不符合题意;B项,葡萄糖在水溶液和熔融状态下均不能导电,是非电解质,不符合题意;C项,MgSO4属于盐,为电解质,符合题意;D项,CO2自身不能电离出离子,不导电,属于非电解质,不符合题意。
2.(2022年江苏省宿迁市沭阳县期中)医院里做心电图检查时,在仪器和皮肤接触部位涂抹的一种无色液体,你觉得可能是
A.氯化钠溶液 B.医用酒精 C.葡萄糖溶液 D.碘酒
【答案】A
【解析】A项,医院里医生给病人做心电图时,在仪器与皮肤接触部位擦的一种电解质溶液是氯化钠溶液,符合题意;B项,酒精属于非电解质,所以医用酒精不属于电解质溶液,不符合题意;C项,葡萄糖属于非电解质,所以葡萄糖溶液不属于电解质溶液,不符合题意;D项,碘酒是碘与酒精的混合物,不属于电解质溶液,不符合题意。
3.(2022年江苏省盐城市响水中学期中)下列说法中正确的是
A.难溶于水的电解质一定是弱电解质
B.易溶于水的电解质一定是强电解质
C.强电解质溶液的导电能力一定比弱电解质溶液强
D.强、弱电解质的本质区别是在水溶液中能否全部电离成离子
【答案】D
【解析】A项,电解质的强弱与其是否易溶于水无关,而是与电解质是否完全电离有关。硫酸钡难溶于水,但溶于水的部分或熔融状态下能完全电离,能导电,是强电解质,错误;B项,乙酸易溶于水,但它在水中部分电离,CH3COOHCH3COO-+H+,是弱电解质,错误;C项,溶液导电能力取决于溶液中离子浓度的大小,与电解强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,错误;D项,强电解质是指在水溶液中,或熔融状态下能完全电离的化合物,所以,强电解质在水溶液里全部电离成离子,正确。
4.(2022年北京市丰台区期中)碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中,不属于碱的共同性质的是
A.能与CO2反应生成水 B.能与盐酸反应生成水
C.能使酚酞溶液变红色 D.能与Na2SO4溶液反应生成BaSO4沉淀
【答案】D
【解析】A项,碱(OH-)能与CO2反应生成水和碳酸盐(CO32-)或碳酸氢盐(HCO3-),属于碱的共性,不符合题意;B项,碱(OH-)能与盐酸(H+)反应生成水和盐,属于碱的共性,不符合题意;C项,碱(OH-)都能电离出氢氧根,氢氧根能使酚酞溶液变红色,属于碱的共性,不符合题意;D项,Ba(OH)2与Na2SO4溶液反应,不是碱(OH-)与Na2SO4的反应,而是Ba2+与SO42-的反应,因此不属于碱的共性,符合题意。
5.(2022年贵州省毕节市第一次联考)下列物质在水中的电离方程式正确的是
A.HNO3=H++NO3- B.(NH4)2SO4 =NH42++SO42-
C.KOH=K++OH- D.BaCl2=Ba2++Cl2-
【答案】AC
【解析】A项,HNO3为一元强酸,完全电离为HNO3=H++NO3-,正确;B项,硫酸铵为强电解质,完全电离产生2个铵根和1个硫酸根,电离方程式为(NH4)2SO4=2NH+SO42-,错误;C项,KOH是一元强碱,完全电离,电离方程式为KOH=K++OH-,正确;D项,BaCl2电离出1个钡离子和2个氯离子,电离方程式为BaCl2=Ba2++2Cl-,错误。
6.(2022年北京市丰台区期中)依据下列实验事实,所得结论正确的是
选项
A
B
C
D
实验
铜丝能导电
NaCl固体不导电
NaCl溶液能导电
熔融NaCl能导电
结论
铜是电解质
NaCl固体中不含离子
NaCl在通电条件下
发生电离
NaCl是电解质
A.A B.B C.C D.D
【答案】D
【解析】A项,铜是金属单质,铜既不是电解质也不是非电解质,错误;B项,NaCl固体中含有钠离子、氯离子,但离子不能自由移动,错误;C项,NaCl发生电离的条件是溶于水,不需要通电,错误;D项,熔融NaCl能导电,所以NaCl是电解质,正确。
7.(2022年安徽省池州市贵池区期中改编)向一定体积的Ba(OH)2溶液中逐滴加入稀H2SO4溶液,测得混合溶液的导电能力随时间的变化曲线如图所示。下列说法正确的是
A.B点溶液中:CO32-、Na+、和Cl-可以大量共存
B.AC段溶液的导电能力减弱的原因是产物BaSO4为非电解质
C.D点溶液中加入NaOH固体发生的反应可能为:H2SO4+2NaOH=Na2SO4+2H2O
D.CD段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
【答案】C
【解析】向一定体积的氢氧化钡溶液中逐滴加入稀硫酸,氢氧化钡逐渐被消耗,最终得到白色沉淀,C点时为硫酸钡和水,导电能力几乎为0,C点以后,硫酸过量,导电能力增强。
A项,B点溶液中含有大量的钡离子,CO32-与钡离子不能大量共存,错误;B项,向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,生成硫酸钡和水,AC段溶液的导电能力不断减弱,是因为生成BaSO4沉淀,电离出的离子较少,BaSO4虽然难溶于水,但是其电离的部分完全电离,属于强电解质,错误;C项,D点溶液中含有过量的硫酸,加入NaOH固体可能发生反应H2SO4+2NaOH=Na2SO4+2H2O,正确;D项,CD段过量的硫酸电离产生氢离子和硫酸根离子导致溶液中自由移动离子浓度变大,导电能力增强,错误。
8.(2022年江苏省盐城市响水中学期中)在化学家的眼中,丰富多彩的化学物质可以按一定的标准进行分类。电解质和非电解质是中学化学中两个重要的概念,辨析清楚有利于我们对元素化合物知识的学习。
(1)在下列化学物质物质中(用字母序号填空)
a.Na;b.熔融K2O;c.CO2 ;d.HCl;e.稀硫酸;f.Ba(OH)2固体;g.NH4HCO3;h.蔗糖
①能导电的电解质的是_____________________;
②非电解质的是_____________________;
③既不是电解质也不是非电解质是_____________________。
(2)写出下列电解质在水溶液中的电离方程式:
①Ba(OH)2 _______________________________;
②(NH4)2SO4_______________________________;
③KAl(SO4)2 _____________________________;
【答案】(1)①b ②ch ③ae (2)①Ba(OH)2=Ba2++2OH- ②(NH4)2SO4=2NH+SO42- ③KAl(SO4)2=K ++Al3++2SO42-
【解析】电解质和非电解质均为化合物,纯净物;在水溶液或熔融状态下均能导电的化合物为电解质,上述两种情况下均不能导电的化合物为非电解质。
a.Na为金属单质,能够导电,既不属于电解质,也不属于非电解质;b.熔融K2O存在自由移动的离子,能够导电,属于电解质;c.CO2自身不能电离出自由移动的离子,不导电,属于非电解质;d.HCl在水溶液中电离出自由移动的离子,能够导电,属于电解质;e.稀硫酸存在自由移动的离子,能够导电,为混合物,不属于电解质和非电解质;f.Ba(OH) 2固体不存在自由移动的离子,不导电,但在水溶液中或熔融状态下均能导电,属于电解质;g.NH4HCO3固体不存在自由移动的离子,不导电,但在水溶液中能导电,属于电解质;h.蔗糖在水溶液中或熔融状态下均以分子形式存在,属于非电解质,不导电。
(1)①结合以上分析可知,能导电的电解质的是b;②结合以上分析可知,非电解质的是ch;③既不是电解质也不是非电解质是ae;(2)①Ba(OH)2属于强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;②(NH4)2SO4属于强电解质,完全电离,电离方程式:(NH4)2SO4=2NH+SO42-;③KAl(SO4)2属于强电解质,完全电离,电离方程式:KAl(SO4)2=K++Al3++2SO42-。
【过关检测】
1.(2022年湖北省孝感市期中)下列物质中,含有自由移动的Cl-的是
A.KClO3溶液 B.CaCl2固体
C.KCl溶液 D.液态HCl
【答案】C
【解析】A项,根据KClO3的电离方程式为KClO3=K++ClO3-,所以KClO3溶液中不存在Cl-,不符合题意;B项,CaCl2固体中存在Ca2+和Cl-,但不能自由移动,不符合题意;C项,由于KCl为强电解质,其电离方程式为KCl=K++Cl-,故KCl溶液中存在自由移动的Cl-,符合题意;D项,液态HCl中只存在氯化氢分子,不存在自由移动的Cl-,不符合题意。
2.(2022年浙江省衢州高级中学期中)下列物质中属于电解质的是
A.蔗糖 B.铜丝 C.硫酸钡固体 D.二氧化硫
【答案】C
【解析】A项,蔗糖是在水溶液里和熔融状态下都不导电的化合物,则属于非电解质,错误;B项,铜是单质,既不是电解质也不是非电解质,错误;C项,硫酸钡是盐,熔融时或在水溶液溶于水的部分能电离出自由移动的阴阳离子能使溶液导电,所以硫酸钡是电解质,正确;D项,二氧化硫在水溶液里或熔融状态下都不自身电离导电的化合物,属于非电解质,错误。
3.(2022年安徽省宿州市十三所重点中学期中)下列说法正确的是
A.硫酸钡溶液几乎不导电,所以它是非电解质
B.SO3溶于水可导电,SO3属于电解质
C.NaCl属于电解质,所以NaCl晶体可导电
D.已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离
【答案】D
【解析】A项,电解质的强弱与其电离程度有关,硫酸钡虽是难溶物,但溶解的部分完全电离,所以是强电解质,错误;B项,SO3溶于水导电的原因是它与水反应的产物H2SO4电离导致的,SO3自身不能电离,是非电解质,错误;C项,NaCl是电解质,在水溶液或熔融状态下可以导电,在晶体中,由于阴阳离子不能自由移动,所以不导电,错误;D项,已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离产生自由移动的铝离子和氧离子而导电,正确。
4.(2022年江苏省扬州市邗江区期中)下列物质中属于电解质的是
A.氯化钠溶液 B.乙醇
C.铜 D.氯化镁晶体
【答案】D
【解析】电解质是指在水溶液或熔融状态下能够导电的化合物,所有的酸碱盐和大多数金属氧化物均为电解质。A项,氯化钠溶液时混合物既不是电解质也不是非电解质,不符合题意;B项,乙醇是非电解质,不符合题意;C项,铜是单质,既不是电解质也不是非电解质,不符合题意;D项,氯化镁晶体属于盐类,属于电解质,符合题意。
5.(2022年贵州省毕节市第一次联考)下列物质中既能导电,又属于电解质的是
A.氨水 B.熔融的NaOH C.水银 D.稀硫酸
【答案】B
【解析】A项,氨水能电离出阴阳离子能导电,但氨水是混合物,既不是电解质也不是非电解质,错误;B项,熔融NaOH能电离出自由移动的离子,能导电又属于强电解质,正确;C项,水银虽然能够导电,但为单质,既不是电解质也不是非电解质,错误;D项,稀硫酸是混合物,既不是电解质也不是非电解质,错误。
6.(2022年河北省唐山市遵化市期中)适度饮水有益于健康,但过量饮水会使体内电解质浓度过低,导致生理紊乱而引起“水中毒”。下列属于人体内常见的电解质的是
A.CO2 B.NaCl C.O2 D.乙醇
【答案】B
【解析】在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,电解质和非电解质为化合物,单质和混合物不是电解质也不是非电解质。
A项,二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,不符合题意;B项,NaCl在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以NaCl是电解质,B符合题意;C项,O2是单质,不是电解质也不是非电解质,不符合题意;D项,乙醇在水溶液里和熔融状态下都不导电,是非电解质,不符合题意。
7.(2022年河北省唐山市遵化市期中)下列物质在水中的电离方程式错误的是
A.NH4HCO3=NH+HCO3- B.Ba(NO3)2=Ba2++2NO3-
C.KAl(SO4)2=K++Al3++2SO42- D.Ca(OH)2=Ca2++(OH) 2-
【答案】D
【解析】A项,NH4HCO3在水溶液中完全电离成NH和HCO3-,电离方程式为:NH4HCO3=NH+HCO3-,正确;B项,Ba(NO3)2在水溶液中完全电离成Ba2+和NO3-,电离方程式为:Ba(NO3)2=Ba2++2NO3-,正确;C项,KAl(SO4)2在水溶液中完全电离成K+、Al3+、SO42-,电离方程式为:KAl(SO4)2=K++Al3++2SO42-,正确;D项,Ca(OH)2在水溶液中完全电离成Ca2+和OH-,电离方程式为:Ca(OH)2=Ca2++2OH-,错误。
8.(2022年河南省新乡市期中)下列电解质在水溶液中的电离方程式书写错误的是
A.H2SO4=2H++SO42- B.Ca(OH)2=Ca2++2OH-
C.NaHCO3=Na++H++CO32- D.KNO3=K++NO3-
【答案】C
【解析】A项,H2SO4是二元强酸,完全电离, 电离方程式是H2SO4=2H++SO42-,正确;B项,Ca(OH)2是强碱,电离方程式是Ca(OH)2=Ca2++2OH-,正确;C项,NaHCO3是盐,在水溶液中电离出钠离子和碳酸氢根离子,碳酸是弱酸,碳酸氢根离子不能拆开写,电离方程式是NaHCO3=Na++HCO3-,错误; D项,KNO3是盐,在水溶液中完全电离出钾离子和硝酸根离子,电离方程式是KNO3=K++NO3-,正确。
9.(2022年河北省唐山市遵化市期中)下列物质中:①SO2;②液态氯化氢;③CH4;④熔融NaOH;⑤NH4Cl固体;⑥氨水。
属于混合物的是__________(填序号,下同);能导电的是___________;属于电解质的是___________;属于非电解质的是___________。
分别写出④和⑤的电离方程式:________________________、______________________________。
【答案】⑥ ④⑥ ②④⑤ ①③ NaOH=Na++OH-、NH4Cl=NH+Cl-
【解析】①SO2属于化合物,本身不能电离出离子,不能导电,其熔融状态也不导电,其水溶液为亚硫酸,能够导电,所以SO2为非电解质;②液态氯化氢属于化合物,没有自由移动的离子,不导电,溶于水完全电离,能够导电,属于电解质;③CH4属于化合物,本身不能电离出离子,不能导电,其不溶于水,熔融状态也不导电,属于非电解质;④熔融NaOH属于化合物,存在自由移动的离子,能够导电,属于电解质;⑤NH4Cl固体中离子不能自由移动,不导电,但溶于水后能够电离导电,属于化合物,属于电解质;⑥氨水能够导电,属于混合物,所以既不是电解质也不是非电解质;结合以上分析可知,属于混合物的是:⑥、能导电的是④⑥、属于电解质的是②④⑤、属于非电解质的是①③;NaOH、NH4Cl电离方程式分别为:NaOH=Na++OH-、NH4Cl=NH+Cl-。
10.(2022年河南省新乡市期中)现有下列物质:
a.稀盐酸 b.熔融的NaCl c.K2SO4 d.Na单质 e.乙醇 f.醋酸 g.SO2 h.KHCO3溶液 i.NaHSO4晶体
(1)属于混合物的是_______(填标号,下同)。
(2)属于电解质的是_______;能导电的是__________;属于化合物但不是电解质的是___________。
(3)属于盐是_______。
(4)分别写出c和i在熔融状态下的电离方程式:
c:____________________________;i:_________________________。
【答案】(1)ah (2)①bcfi ②abdh ③eg (3)bci (4)①K2SO4=2K++SO42- ②NaHSO4=Na++HSO4-
【解析】(1)混合物由两种或两种以上物质混合而成的物质。稀盐酸是HCl的水溶液,KHCO3溶液是KHCO3溶于水形成的混合物,故a和h属于混合物;(2)电解质是在水中或熔融状态下能导电的化合物。熔融的NaCl能导电,K2SO4溶于水和熔融状态下都能导电,醋酸溶于水能导电,NaHSO4晶体溶于水和熔融状态下都能导电,故bcfi是电解质;能导电的物质在需要由自由移动的离子或电子,稀盐酸中有自由移动的氢离子和氯离子,熔融NaCl中有自由移动的钠离子和氯离子,Na单质中有自由移动的电子,KHCO3溶液中有自由移动的钾离子和碳酸氢根离子,故能导电的是abdh;乙醇是化合物,但在水中和熔融状态下都不能导电,是非电解质,SO2是化合物,虽然溶于水能导电,但不是自身电离出来的离子导电,而是SO2和水生成的亚硫酸电离出来的离子导电,而且液态SO2也不导电,所以SO2是非电解质,故属于化合物但不是电解质的是eg;(3)盐是由金属离子(或铵根离子)和酸根离子组成的化合物,属于盐的是bci;(4)K2SO4熔融时电离出钾离子和硫酸根离子,电离方程式为:K2SO4=2K++SO42-;NaHSO4在熔融状态时电离出钠离子和硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-。
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第13讲 弱电解质的电离 讲学案: 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第13讲 弱电解质的电离 讲学案,文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第13讲弱电解质的电离教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第13讲弱电解质的电离学生版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
【暑假初升高】人教版化学初三(升高一)暑假预习-第16讲 原子结构与核素 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第16讲 原子结构与核素 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第16讲原子结构与核素解析版docx、暑假初升高人教版化学初三升高一暑假预习-第16讲原子结构与核素原卷版docx等2份学案配套教学资源,其中学案共24页, 欢迎下载使用。
【暑假初升高】人教版化学初三(升高一)暑假预习-第15讲 金属材料 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第15讲 金属材料 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第15讲金属材料解析版docx、暑假初升高人教版化学初三升高一暑假预习-第15讲金属材料原卷版docx等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。