







高中第一节 原子结构公开课第一课时教案及反思
展开(人教版高中化学选择性必修2)
《原子结构》第一课时 教学设计
课题名 | 《原子结构》第一课时 |
教材分析 | 本节内容是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子核外电子排布以及原子光谱。从介绍门捷列夫发现元素周期律,到波尔提出“能级、能层、构造原理”的科学历史入手,直接介绍能级和能层的的概念,并在原子基态、激发态、原子光谱等基础上介绍电子跃迁和光谱分析,最后根据构造原理进行原子核外电子排布。 |
核心素养 | 宏观辨识与微观探析:通过认识原子核外电子的排布,理解能级与能层的关系及核外电子的排布规律。 证据推理与模型认知:结合构造原理形成核外电子排布式书写的思维模型,能书写1-36号元素的电子排布式。 科学探究与创新意识:理解基态与激发态的含义与关系,能辨识光谱与电子跃迁之间的关系。 |
教学重点 | 能级与能层的关系及核外电子的排布规律,结合构造原理书写电子排布式。 |
教学难点 | 1-36号元素电子排布式的书写。 |
教学方法 | 讲解、举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
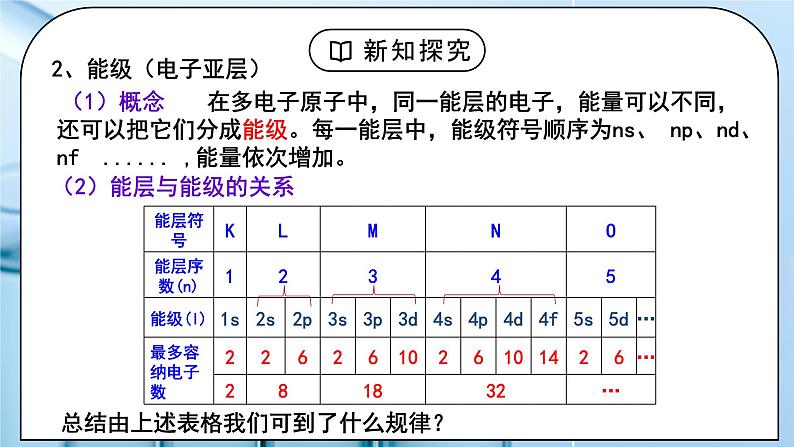
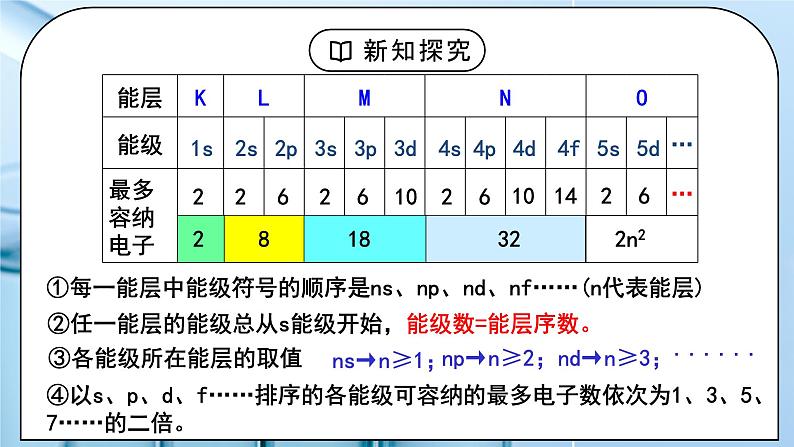
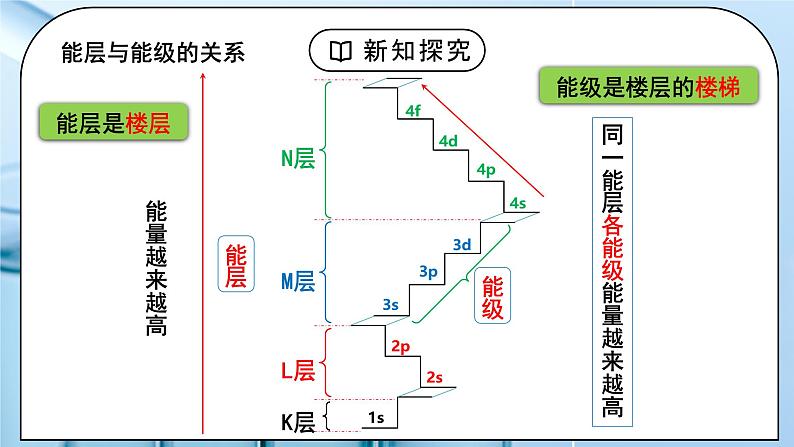
教学过程 | 一、新课导入 1.核外电子排布规律 教师:思考:请画出钠的原子结构示意图,并回忆核外电子排布的规律。 1、原子核外电子总是由里向外排列(能量最低原理) 2、每层最多能最多容纳2n2个电子 3、最外层最多容纳8个电子(K层为最外层时最多容纳2个) 4、次外层最多能容纳18个电子,倒数第三层最多容纳32个电子 学生:画出钠的原子结构示意图,回忆核外电子排布的规律。 [设计意图]回顾原子核外电子排布规律,引入新课学习。 二、探究新知 1.一、能层与能级 教师:1、能层(电子层) (1)概念:在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。 (2)能层的表示方法及容纳的最多电子数 每层最多容纳的电子数为2n2 核外电子总是尽先排满能量最低、离核最近的能层,然后才由里往外,依次排在能量较高能层。而失电子总是先失最外层电子。 2、能级(电子亚层) (1)概念: 在多电子原子中,同一能层的电子,能量可以不同,还可以把它们分成能级。每一能层中,能级符号顺序为ns、 np、nd、nf ...... ,能量依次增加 (2)能层与能级的关系 ①每一能层中能级符号的顺序是ns、np、nd、nf……(n代表能层) 结由上述表格我们可到了什么规律? ②任一能层的能级总从s能级开始,能级数=能层序数。 ③各能级所在能层的取值ns→n≥1;np→n≥2;nd→n≥3; ④以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。 能层与能级的关系:能层是楼层,能级是楼层的楼梯。 【思考与讨论】 1、一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系? 2、以s、p、d、f为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所能容纳的最多电子数是否相同? 3、第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?(本书只要求到f能级) 小结: 多电子原子中: ①E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q) ②E(ns)< E(np)< E(nd)< E(nf)…… ③能级数=能层序数(n) ④s、p、d、f 能级最多容纳的电子数依次为奇数数列1、3、5、7的2倍 ⑤一个能层最多可容纳电子数=2n2 学生: 练习1.下列能级符号表示正确的组合是 ( ) ①5s ②2d ③3f ④6p A.①④ B.②③ C.③④ D.①② 练习2.下列各能层不包含d能级的是 ( ) A.N B.M C.Q D.K [设计意图]进一步深入研究原子的构造,知道能级、能层等概念。 2.二、构造原理 教师:电子填充的先后顺序(构造原理) 随原子核电荷数递增,原子核外电子的排布遵循如左图的排布顺序,这个排布顺序被称为构造原理。 1、电子排布规律: ①在多电子原子中电子在能级上的排布顺序:电子最先排在能量低的能级上,然后依次排在能量高的能级上 ②并不是所有原子都是填满一个能层再排下一个能层,如K,电子排布遵循构造原理 ③“能级交错”现象:由构造原理知,从第三能层开始出现能级不完全遵循能层顺序,出现了能级交错现象 ④少数元素出现例外:铬,银,金,铜 24Cr:1s22s22p63s23p63d54s1 29Cu:1s22s22p63s23p63d104s1 2、各能级的能量高低顺序 : ①相同能层的不同能级的能量高低顺序 :ns<np<nd<nf ②英文字母相同的不同能级的能量高低顺序: 1s<2s<3s<4s;2p<3p<4p; 3d<4d ③不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数),当n≥( 3 )时,出现d,当n≥( 4 )时出现f。 3、原子核外电子排布的表示方法: ①原子结构示意图:表示各能层上排布的电子数 ②电子排布式:用核外电子分布的能级及各能级上电子数表示电子排布的式子 按能层次序书写,按构造原理充入电子。 注:根据构造原理书写原子的电子排布式时,能级按照能级的顺序排列,不能按照能量高低顺序排列。 ③简化电子排布式、原子实 如:Na:1s22s22p63s1简化为:[Ne]3s1 表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同 ④价层电子排布式: 将在化学反应中可能发生电子变动的能级称为价电子层(简称价层) Fe的简化电子排布式为[Ar]3d64s2,价层电子排布为3d64s2 学生:练习3.写出下列元素基态原子和离子的电子排布式: 1、C 2、N 3、O 4、Na 5、Cl 6、K 7、26Fe 8、35Br 1、Ca 2+ 2、 Fe 2+ 3、O 2- 练习4:请写出8号、14号、26号元素的简化排布式: 课后练习:1~36号元素的原子核外电子排布式 1~36号元素原子简化核外电子排布式 练习4.下列粒子中,电子排布式为1s22s22p63s23p6的有( ) A.Sc3+ B.Mg2+ C.Cl- D.Br- 练习5.下列化学用语,不能表示氯离子的是( ) A.Cl- B. C. D.1s22s22p63s23p6 练习6.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( ) A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(5s)>E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)>E(3d) 练习7.某元素原子的价电子构型为3s23p4, 则此元素在周期表的位置是____________ [设计意图]学会根据构造原理进行核外电子排布,会书写电子排布式。
教师:1、基态:处于最低能量状态的原子。 激发态:基态原子吸收能量,它的电子会跃迁到 较高能级,变成激发态原子。 思考:化学反应中的能量变化通常以光、热的形式呈现,那电子发生跃迁时能量变化又以什么形式呈现? 2、光谱与光谱分析 不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。 光谱分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。 ①吸收光谱:电子从基态或较低能量的激发态跃迁到较高能量的激发态,吸收光源中某些波长的光,形成吸收光谱。 ②发射光谱:电子从较高能量的激发态跃迁到较低能量的激发态或基态,释放光源中某些波长的光,形成发射光谱。 思考:发射光谱和吸收光谱有什么联系呢? 发射光谱: 特征:暗背景,彩色亮线,线状不连续 吸收光谱: 特征:亮背景,暗线,线状不连续 同种元素发射光谱中的彩色亮线与吸收光谱中的暗线处于相同位置。 由于不同原子具有不同的结构,能级各不相同,因此电子跃迁时发射(或吸收)光的波长(频率)也不相同。 思考:为什么霓虹灯管中装载的气体不同,在高压的激发下发出的光的颜色就不同? 学生:思考:请同学们解释钾与钠焰色不同的原因 当碱金属及化合物在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但是处于能量较高的的轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式释放,而释放的光的波长在可见光范围内,因而能使火焰呈现颜色。 钾和钠的原子结构不同,电子跃迁时能量的变化不同,则放出的光的波长不同,所以产生焰色也就不同。 [设计意图]掌握原子的基态、激发态,原子光谱等概念。 |
板书设计 | 一、能层与能级 1、能层(电子层) 2、能级(电子亚层) 二、构造原理 三、基态与激发态、原子光谱 |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:从介绍门捷列夫发现元素周期律,到波尔提出“能级、能层、构造原理”的科学历史入手,直接介绍能级和能层的的概念,并在原子基态、激发态、原子光谱等基础上介绍电子跃迁和光谱分析,最后根据构造原理进行原子核外电子排布。 课堂教学建议:本节内容比较抽象,按照课标要求深入而系统的介绍了原子结构与元素性质,重点应掌握1-36号元素原子的核外电子排布式。 |
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思,文件包含核心素养人教版高中化学选修二《配合物与超分子》课件pptx、核心素养人教版高中化学选修二《配合物与超分子》教学设计含教学反思docx等2份教案配套教学资源,其中教案共12页, 欢迎下载使用。
化学选择性必修2第二节 分子的空间结构优秀第一课时教案: 这是一份化学选择性必修2第二节 分子的空间结构优秀第一课时教案,文件包含核心素养人教版高中化学选修二《分子的空间结构》第一课时课件pptx、核心素养人教版高中化学选修二《分子的空间结构》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共8页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 共价键获奖第二课时教案: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键获奖第二课时教案,文件包含核心素养人教版高中化学选修二《共价键》第二课时课件pptx、核心素养人教版高中化学选修二《共价键》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共8页, 欢迎下载使用。














