





- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题9 题型专攻2 分子结构与性质简答题集训课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题9 原子结构、分子结构与性质的基础考查课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 题型专攻3 物质结构与性质选择题课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题11 热化学方程式的书写与盖斯定律课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题12 题型专攻4 电化学离子交换膜的分析与应用课件PPT 课件 0 次下载
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 晶体类型 晶体结构课件PPT
展开一、以备课组为单位制定好二轮复习计划。第一,用什么资料,怎样使用资料;第二,在那些核心考点上有所突破,准备采取什么样的措施;第三,用时多长,怎样合理分配。二、怎样查漏。第一,教师根据一轮复习的基本情况做出预判; 第二,通过检测的方式了解学情。三、怎样补缺。1、指导学生针对核心考点构建本专题的知识网络;2、针对学生在检测或考试当中出现的问题,教师要做好系统性讲评;3、教育学生在对待错题上一定要做到:错题重做,区别对待,就地正法。 4、抓好“四练”。练基本考点,练解题技巧,练解题速度,练答题规范。
1.掌握常见的晶体类型及微粒间相互作用。2.掌握常见晶体的结构及相关计算。
晶体类型与微粒间相互作用力
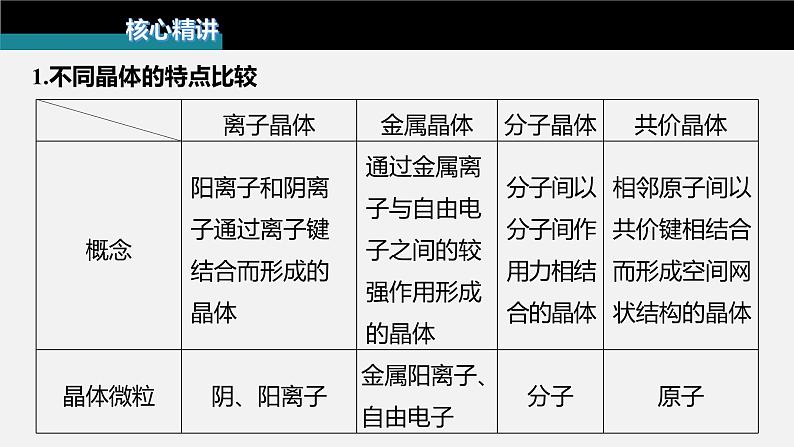
1.不同晶体的特点比较
2.晶体类别的判断方法(1)依据构成晶体的微粒和微粒间作用力判断由阴、阳离子形成的离子键构成的晶体为离子晶体;由原子形成的共价键构成的晶体为共价晶体;由分子依靠分子间作用力形成的晶体为分子晶体;由金属阳离子、自由电子以金属键构成的晶体为金属晶体。(2)依据物质的分类判断①活泼金属氧化物和过氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)、绝大多数的盐是离子晶体。②部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体是分子晶体。
③常见的单质类共价晶体有金刚石、晶体硅、晶体硼等,常见的化合物类共价晶体有SiC、SiO2、AlN、BP、GaAs等。④金属单质、合金是金属晶体。(3)依据晶体的熔点判断不同类型晶体熔点大小的一般规律:共价晶体>离子晶体>分子晶体。金属晶体的熔点差别很大,如钨、铂等熔点很高,铯等熔点很低。
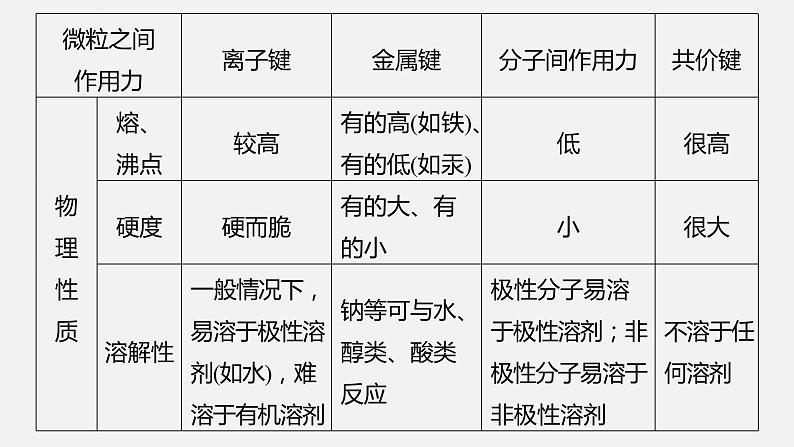
(4)依据导电性判断①离子晶体溶于水和熔融状态时均能导电。②共价晶体一般为非导体。③分子晶体为非导体,但分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水时,分子内的化学键断裂形成自由移动的离子,也能导电。④金属晶体是电的良导体。(5)依据硬度和机械性能判断一般情况下,硬度:共价晶体>离子晶体>分子晶体。金属晶体多数硬度大,但也有较小的,且具有较好的延展性。
3.晶体熔、沸点的比较(1)共价晶体
如熔点:金刚石>碳化硅>晶体硅。(2)离子晶体一般地说,阴、阳离子的电荷数越多,离子半径越小,离子间的作用力就越强,离子晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
(3)分子晶体①分子间作用力越大,物质的熔、沸点越高;具有分子间氢键的分子晶体熔、沸点反常得高,如沸点:H2O>H2Te>H2Se>H2S。②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4。③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点:CO>N2。④在同分异构体中,一般支链越多,熔、沸点越低,如熔、沸点:正戊烷>异戊烷。
(4)金属晶体金属离子半径越小,所带电荷数越多,其金属键越强,熔、沸点就越高,如熔、沸点:Na
角度二 晶体微粒间作用力3.[2018·全国卷Ⅰ,35(3)改编]LiAlH4中,存在的微粒间作用力有____________。4.[2018·全国卷Ⅲ,35(3)节选]ZnF2具有较高的熔点(872 ℃),其化学键类型是________。5.[2016·全国卷Ⅰ,37(5)改编]Ge单晶具有金刚石型结构,其微粒之间存在的作用力是________。6.[2016·全国卷Ⅱ,37(3)节选]单质铜及镍都是由______键形成的晶体。
角度三 晶体熔、沸点高低的比较7.[2017·全国卷Ⅰ,35(2)节选]K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________________________。8.[2017·全国卷Ⅲ,35(3)改编]在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)所涉及的4种物质中,沸点从高到低的顺序为______________________,原因是________________________________________________________________________________________________________________。
较大且价电子数较少,金属键较弱
>CH3OH>CO2>H2
H2O与CH3OH均为极性分子,H2O中氢键
数目比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大
9.[2016·全国卷Ⅲ,37(4)]GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________________________________。10.[2015·全国卷Ⅱ,37(2)改编]单质氧有两种同素异形体,其中沸点高的是____(填分子式),原因是_______________________________________________。
GaF3为离子晶体,GaCl3为分子晶体
O3相对分子质量较大且是极性分子,范德华
1.Cu2O与Cu2S比较,熔点较高的是_______,原因是_____________________________________________________________________________________________________。2.钛比钢轻,比铝硬,是一种新兴的结构材料。钛的硬度比铝大的原因是__________________________________________。
合物,且离子带电荷数相同,O2-的半径小于S2-的,所以Cu2O的离子键强度大,熔点更高
Ti原子的价电子数比Al原子的多,金属键更强
3.已知Ba、M的氯化物沸点信息如表所示。二者沸点差异的原因是_____________________________________________________________________________________________________________________________________________________。
属于离子晶体,MCl5属于分子晶体,离子晶体的沸点主要取决于离子键,分子晶体的沸点主要取决于分子间作用力,离子键通常强于分子间作用力(合理即可)
4.[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为 ,IMI的某种衍生物与甘氨酸形成的离子化合物 ,常温下为液态而非固态,原因是_______________________________________________________。
阴、阳离子半径大,电荷数小,形成的离
1.常见共价晶体结构分析(1)金刚石①每个C与相邻4个C以共价键结合,形成正四面体结构;②键角均为109°28′;③最小碳环由6个C组成且6个C不在同一平面内;④每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2;
(2)SiO2①每个Si与4个O以共价键结合,形成正四面体结构;②每个正四面体占有1个Si,4个“ ”,因此二氧化硅晶体中Si与O的个数之比为1∶2;③最小环上有12个原子,即6个O、6个Si;④密度ρ= (a为晶胞边长,NA为阿伏加德罗常数的值)。
(3)SiC、BP、AlN①每个原子与另外4个不同种类的原子形成正四面体结构;
2.常见分子晶体结构分析(1)干冰①8个CO2位于立方体的顶角且在6个面的面心又各有1个CO2;②每个CO2分子周围紧邻的CO2分子有12个;
(2)白磷①面心立方最密堆积;
3.常见金属晶体结构分析(1)金属晶胞中原子空间利用率计算
(2)晶体微粒与M、ρ之间的关系若1个晶胞中含有x个微粒,则1 ml该晶胞中含有x ml微粒,其质量为xM g(M为微粒的相对分子质量);若1个该晶胞的质量为ρa3 g(a3为晶胞的体积),则1 ml晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
[知识拓展] 金属晶体的四种堆积模型分析
4.常见离子晶体结构分析典型离子晶体模型的配位数
[知识拓展] 晶格能(1)定义:气态离子形成1摩离子晶体释放的能量。晶格能是反映离子晶体稳定性的数据,可以用来衡量离子键的强弱,晶格能越大,离子键越强。(2)影响因素:晶格能的大小与阴阳离子所带电荷数、阴阳离子间的距离、离子晶体的结构类型有关。离子所带电荷数越多,半径越小,晶格能越大。(3)对离子晶体性质的影响:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
(一)新高考卷真题研究1.[2021·广东,20(6)]理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是__________________________________________________________。
由图c可知,图b中Sb、Hg原子取代位置除图b外还有其他形式
对比图b和图c可得X晶体的晶胞中上下两个单元内的原子位置不完全相同,不符合晶胞是晶体的最小重复单元要求。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为____;该晶胞中粒子个数比Hg∶Ge∶Sb=_________。
③设X的最简式的式量为Mr,则X晶体的密度为_______________g·cm-3(列出算式)。
2.[2021·山东,16(4)]XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_____个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( )。已知Xe—F键长为r pm,则B点原子的分数坐标为________;晶胞中A、B间距离d=_______________pm。
3.[2020·山东,17(4)]以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
一个晶胞中有___个Sn,找出距离Cd(0,0,0)最近的Sn___________________(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有____个。
(0.5,0,0.25)、(0.5,0.5,0)
由题给原子的分数坐标和晶胞图示可知,小白球表示的是Sn原子,Sn原子位于面心和棱上,因此一个晶胞中含Sn原子的个数为6× =4。由Sn和As的分数坐标可知,x、y轴上a pm长的分数坐标为1,z轴上2a pm长的分数坐标为1。小黑球表示的是Cd原子,与Cd(0,0,0)最近的Sn有两个,其分数坐标分别为(0.5,0,0.25)和(0.5,0.5,0)。灰球表示的是As原子,每个Sn周围与Sn等距离的As原子有4个,即与单个Sn键合的As有4个。
4.[2021·河北,17(7)]分别用 、 表示H2PO 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为___________g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为______(填标号)。
由图(a)、(b)、(c)可知,晶胞在x轴方向的投影图为 。
5.[2021·湖南,18(3)]下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①已知化合物中Ge和O的原子个数比为1∶4,图中Z表示____原子(填元素符号),该化合物的化学式为____________。
②已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ=_____________g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
(二)三年全国卷真题汇编6.[2021·全国甲卷,35(4)]我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是____,晶胞参数为a pm、a pm、c pm,该晶体密度为_______________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=_____(用x表达)。
以晶胞中右侧面心的Zr4+为例,同一晶胞中与Zr4+连接最近且等距的O2-数为4,同理可知右侧晶胞中有4个O2-与Zr4+相连,因此Zr4+在晶胞中的配位数是4+4=8;
在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,其中Zn元素为+2价,Zr为+4价,O元素为-2价,根据化合物中各元素化合价代数和为0可知2x+4×(1-x)=2y,解得y=2-x。
7.[2021·全国乙卷,35(4)]在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是____原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为_________________%(列出计算表达式)。
8.[2020·全国卷Ⅰ,35(4)]LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有_____个。电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=______________,n(Fe2+)∶n(Fe3+)=________。
9.[2019·全国卷Ⅰ,35(4)]图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=______pm,Mg原子之间最短距离y=______pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_______________g·cm-3(列出计算表达式)。
已知1 cm=1010 pm,晶胞体积为(a×10-10)3 cm3,代入密度公式计算即可。
10.[2019·全国卷Ⅱ,35(4)]一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为_______________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=_____________________g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为 ,则原子2和3的坐标分别为_________、_________。
SmFeAsO1-xFx
考向一 “立方系”晶体结构分析1.已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ti原子与N原子的最近距离为___________(用含ρ、NA的代数式表示)pm。
2.铜的晶胞结构如图所示。一种金铜合金晶胞可以看成是铜晶胞面心上的铜被金取代,连接相邻面心上的金原子构成_________(填“正四面体”“正八面体”或“正四边形”)。已知:NA表示阿伏加德罗常数的值,晶胞参数为a pm,则该金铜合金晶体的密度为__________ g·cm-3(用含a、NA的代数式表示)。
铜晶胞面心上的铜被金取代,由图可知,连接相邻面心上的金原子,上下面2个金原子与4个侧面的金原子构成正八面体;
3.金属Ni可以与Mg、C形成一种化合物M,M是一种新型超导体,它的临界温度为8 K。已知M的晶胞(α=β=γ=90°)结构如图所示,则M的化学式为_________。其晶胞参数为d pm,该晶体的密度为___________ g·cm-3。(列出计算式)
考向二 “非立方”晶体结构分析4.天然硅酸盐组成复杂阴离子的基本结构单元是 四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中Si与O的原子数之比为______,化学式为__________。
5.从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数的值为NA,已知sin 60°= ,石墨晶体的密度为_________________g·cm-3(列出计算式)。
6.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti各有一个原子在结构单元内部),则该合金的化学式为________________。已知该结构单元底面(正六边形)边长为a nm,高为b nm,该合金的密度为______________________________________________ g·cm-3。(只需列出计算式,NA为阿伏加德罗常数的值)
Ti11Al5(或Al5Ti11)
考向三 和“俯视图”有关的晶体结构分析7.硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为a pm。该晶胞中离子的分数坐标为
(1)在图上画出硫化锂晶胞沿x轴投影图。
根据硫离子的分数坐标参数,硫离子位于晶胞的面心、顶角;根据锂离子的分数坐标参数,锂离子位于晶胞的内部,结合坐标位置,则硫化锂晶胞沿x轴投影图为 。
(2)硫离子的配位数为________。
根据(1)中的分析,从面心的S2-看,周围与之等距且最近的Li+有8个,所以S2-的配位数为8。
(3)设NA为阿伏加德罗常数的值,硫化锂的晶体密度为___________g·cm-3(列出计算表达式)。
8.硅和碳在同一主族。如图为SiO2晶体中Si原子沿z轴方向在xy平面的投影图(即俯视图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB之间的距离是________nm。
根据图可知其三维模型为 (图中黑球和白球均为硅原子,氧原子位于两个硅原子之间,省略),图中ABCD四个Si原子形成正四面体结构,且AB距离等于AC距离,AC距离在底面投影为底面面对角线的一半,则SiA与SiB的距离为
1.按要求回答下列问题。(1)AsCl3的沸点比BCl3的高,这是因为________________________________________________________________________________________________。(2)GaCl3的熔点为77.9 ℃,GaN的熔点为1 700 ℃,二者熔点差异的原因是_________________________________。(3)Ti形成的多种化合物中常见的有TiN和金红石(TiO2),两种晶体熔融状态下都能够导电,则它们属于_________(填晶体类型),两种晶体比较,TiN熔点较高,其原因是_________________________________________。
两者都是分子晶体,AsCl3的相对分子质量比BCl3的大,且AsCl3分子的极性较强,AsCl3分子间作用力较强
GaCl3为分子晶体,GaN为共价晶体
N3-所带电荷数多于O2-,TiN的离子键强度大
(4)Cu2O和Cu2S都是离子晶体,熔点较高的是_______。其原因是_________________________________________________________________________________________________。(5)工业上均采用碳酸盐分解法制取氧化镁与生石灰,MgCO3的分解温度_____(填“高于”或“低于”)CaCO3,原因是__________________________________________________________________________。
亚铜和硫化亚铜都是离子晶体,氧离子的离子半径小于硫离子,氧化亚铜的离子键强度大于硫化亚铜
离子半径Mg2+小于Ca2+,二者所带电荷数相同,Mg2+吸引O2-形成MgO的能力强
(6)已知:r(Fe2+)为61 pm、r(C2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CCO3,实验测得FeCO3的分解温度低于CCO3,原因是_____________________________________________________________________________。
Fe2+更容易结合碳酸根离子中的氧离子或Fe2+的半径小于C2+,FeO的离子键强度大
(7)MgCl2和TiCl4的部分性质对比如表:
二者虽然都是金属元素和氯元素形成的化合物,但前者熔点比后者高很多,其原因为__________________________________________________________________________。
TiCl4属于分子晶体,MgCl2属于离子晶体,离子晶体的熔点大于分子晶体的熔点
(8)GaN、GaP、GaAs熔融状态均不导电,据此判断它们是______(填“共价”或“离子”)化合物。它们的晶体结构与金刚石相似,其熔点如下表所示,试分析GaN、GaP、GaAs熔点依次降低的原因:_____________________________________________________________________________________________________________________________。
它们均为共价晶体,由于N、P、As的原子半径依次增大,故Ga—N、Ga—P、Ga—As的键长依次增大,共价键越长,键能越小,熔点越低
2.分析下列晶体结构。(1)已知Cu2O的立方晶胞结构如图所示。
①已知a、b的坐标参数依次为(0,0,0)、( ),则d的坐标参数为__________,它代表______原子。
②若铜、氧的原子半径分别为rCu pm、rO pm,Cu2O晶体的密度为ρ g·cm-3,NA是阿伏加德罗常数的值,则该晶胞中原子空间占有率为______________________×100%。
(2)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2a pm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ),则m的原子分数坐标为__________,距离Hg最近的Ag有____个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为M g·ml-1,该晶体的密度为__________ g·cm-3(用代数式表示)。
A原子在晶胞内,1个晶胞含有A原子数为8个;
A是I、B是Hg、C是Ag,距离Hg最近的Ag有8个。
(3)金属硼氢化物可用作储氢材料。如图是一种金属硼氢化物氨合物的晶体结构示意图。图中八面体的中心代表金属M原子,顶点代表氨分子;四面体的中心代表硼原子,顶点代表氢原子。该晶体属立方晶系,晶胞棱边夹角均为90°,棱长为a pm,密度为ρ g·cm-3,阿伏加德罗常数的值为NA。①该晶体的化学式为______________。
M(NH3)6B2H8
八面体位于顶点和面心,个数为 =4,即M原子数为4,NH3为4×6=24,四面体位于晶胞内部,有8个,B原子个数为8,H原子个数为8×4=32,因此化学式为M(NH3)6B2H8。
②金属M原子与硼原子间最短距离为______ pm。
③金属M的相对原子质量为_____________________(列出表达式)。
(4)GaN的一种六方晶胞如图所示,晶胞参数为a nm、c nm。晶体中N原子的配位数为____;晶体密度ρ=_______________ g·cm-3(设阿伏加德罗常数的值为NA,用a、c、NA的代数式表示)。
1个N周围有4个与之等距且最近的Ga原子,所以N的配位数是4;
(5)一种金属间化合物的晶胞结构如图所示:
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ),则C点原子在z轴方向上的分数坐标z=_____(用含c、s的代数式表示);设Mg、Cu和Al原子半径分别为rMg pm、rCu pm、rAl pm,则金属原子的空间占有率为________________________________(列出计算表达式)。
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为_________________;设阿伏加德罗常数的值为NA,晶胞参数为a cm,磷化硼晶体的密度为____________g·cm-3(列出计算式);
若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实心圆点画出B原子的投影位置。
答案 或
磷化硼晶胞中,P原子分布在面心和顶点,由此可确定空间堆积方式为面心立方最密堆积;
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 题型专攻3 物质结构与性质选择题课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 题型专攻3 物质结构与性质选择题课件PPT,共50页。PPT课件主要包含了高考化学二轮复习策略,核心精讲,第一电离能FN,电负性CHSi,真题演练,B正确,考向预测等内容,欢迎下载使用。
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题1 物质的组成、分类 化学用语课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题1 物质的组成、分类 化学用语课件PPT,共60页。PPT课件主要包含了高考化学二轮复习策略,专题强化练等内容,欢迎下载使用。
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题7 化学与传统文化课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题7 化学与传统文化课件PPT,共40页。PPT课件主要包含了核心精讲,性铜盐,K2CO3,CaCO3,蛋白质,铜单质,氧化还原,蒸发结晶,真题演练,考向预测等内容,欢迎下载使用。












