






还剩8页未读,
继续阅读
成套系列资料,整套一键下载
2023九年级化学下册第九单元溶液单元整合课件新版新人教版
展开
这是一份2023九年级化学下册第九单元溶液单元整合课件新版新人教版,共16页。
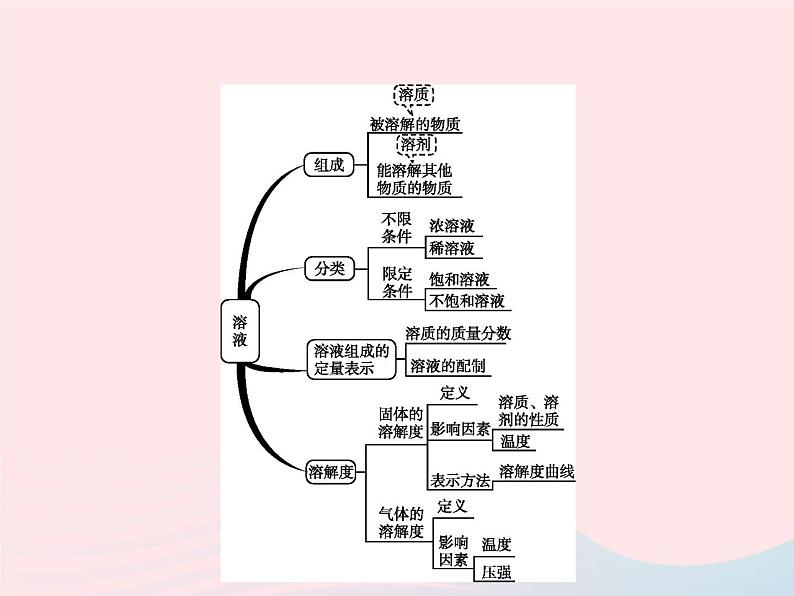
单元整合67891012345专题一、溶液和物质的溶解度1.下列有关溶液的说法不正确的是( )A.蔗糖溶液是均一的、稳定的混合物B.硝酸钾在20 ℃时溶解度是31.6 g,则100 g硝酸钾溶液中含有硝酸钾31.6 gC.在鱼池中设立水泵,把水喷向空中可以增加水中氧气的溶解量D.降温或蒸发溶剂都能使接近饱和的氯化钠溶液达到饱和 答案解析678910123452.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )A.由饱和溶液变为不饱和溶液B.溶质质量不变C.溶液质量不变D.溶质的质量分数减小 答案解析678910123453.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见表)。通过分析她得出以下结论,其中不正确的是( )A.温度和溶剂种类对NaOH的溶解度都有影响B.NaOH易溶于水,也易溶于酒精C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多 答案解析678910123454.通过如图所示的实验(不考虑水分蒸发),得到相应的五种溶液。下列叙述不正确的是( )A.t1 ℃时,溶液①是不饱和溶液B.t2 ℃时,溶液④是饱和溶液C.t1 ℃时,溶液⑤是饱和溶液D.t2 ℃时,溶液③是不饱和溶液 答案解析67891012345专题二、溶解度曲线的应用5.如图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是 ( )A.20 ℃时,甲物质的溶解度比乙物质的溶解度小B.甲物质中混有少量乙物质,采用蒸发结晶的方法提纯甲物质C.40 ℃时,甲、乙两种物质的饱和溶液中溶质质量相等D.60 ℃时,将80 g甲物质放入100 g水中,所得溶液中溶质质量与溶剂质量之比是4∶5 答案解析678910123456.如图是四种物质的溶解度曲线,下列说法中正确的是( )A.20 ℃时,分别配制四种物质的饱和溶液,硫酸铵需要水的质量最少B.40 ℃时,向硫酸铵饱和溶液中加入适量氯化钾固体会析出硫酸钾晶体C.氯化钾饱和溶液的溶质质量分数一定小于氯化铵饱和溶液的溶质质量分数D.用30 g硫酸钾固体最多可配制150 g 80 ℃的硫酸钾饱和溶液 答案解析678910123457.甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )①甲的溶解度随温度的升高而增大②40 ℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法③20 ℃时,向125 g溶质质量分数为20%的乙溶液中加入15 g乙固体并振荡,有固体不溶解④将相同质量的甲和乙的饱和溶液分别从40 ℃降温至10 ℃,甲析出晶体的质量大A.①② B.③④ C.①③④ D.②③④ 答案解析678910123458.t2 ℃时,将甲、乙各80 g分别放入盛有100 g水的两个烧杯中,充分溶解后,恢复到t2 ℃,现象如图1。甲和乙的溶解度曲线如图2。请结合图示回答下列问题:67891012345(1)固体甲对应的溶解度曲线是 (填“a”或“b”)。 (2)M点的含义 。 (3)向烧杯①的溶液中继续加入15 g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出。你认为“全部溶解”的原因是 。 (4)将t2 ℃等质量的甲、乙饱和溶液分别降温到t1 ℃时,所得溶液的有关说法正确的是 (填字母)。 A.甲溶液仍为饱和溶液B.两溶液质量甲<乙C.两溶液中溶剂质量甲=乙D.两溶液溶质的质量分数甲>乙答案:(1)a (2)t1℃时,甲、乙两物质的溶解度相等 (3)甲溶于水放热,使甲的溶解度增大 (4)ABD67891012345解析:(1)t2 ℃时,将甲、乙各80 g分别放到盛有100 g水的两个烧杯中,充分溶解后,恢复到t2 ℃,甲完全溶解,乙有剩余,说明t2 ℃时,甲的溶解度比乙的大,a为甲的溶解度曲线。(2)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。故M点的含义是t1 ℃时,甲、乙两物质的溶解度相等。(3)甲的溶解度随温度升高而增大,所以充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出,“全部溶解”的原因是甲溶于水放热,使甲的溶解度增大,降温后因溶解度变小又析出。(4)将t2 ℃等质量的甲、乙饱和溶液分别降温到t1 ℃时,甲的溶解度减小析出晶体,得饱和溶液;由于甲析出晶体溶液质量减小,而乙不析出晶体,溶液的质量不变,所以两溶液质量甲<乙;t2 ℃时,甲溶解度比乙的大,等质量两种物质的饱和溶液中,甲溶液溶剂比乙的少;t1 ℃时,甲溶解度比乙t2 ℃时的溶解度大,所以降温到t1 ℃,两溶液溶质质量分数甲>乙。67891012345专题三、有关溶质质量分数的计算与溶液的配制 9.a、b、c三种物质的溶解度曲线如右图所示。取等质量t2 ℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2 ℃。下列说法不正确的是( )A.原饱和溶液中,溶质的质量分数a>b=cB.恢复至t2 ℃时,析出溶质的质量a>b=cC.恢复至t2 ℃时,三种溶液一定都是饱和溶液D.若继续降温至t1 ℃,三种溶液一定都是饱和溶液 答案解析6789101234510.氯化钠是一种重要的资源,在海水中储量很丰富。(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质的质量相等的溶液是 (填编号);与B溶液中溶质质量分数相等的溶液是 (填编号)。 (2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。据图回答下列问题:溶解度变化受温度影响最大的是 。t ℃时,溶解度最小的是 。t ℃时,将25 g硒酸镉加入 g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液中溶质的质量分数,可进行的操作是 。 67891012345(3)硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 。答案: (1)A CD(2)硝酸钾 氯化钠 50 降低温度并加入硒酸镉(3)降温结晶(或冷却热饱和溶液)解析: (1)在A到B海水蒸发过程中,溶液由不饱和变为饱和,溶质质量不变。由B到C再到D是结晶过程,结晶后的母液是饱和溶液,溶质的质量分数不变。(2)溶解度受温度影响最大的物质的溶解度曲线斜率最大,受温度影响最小的物质的溶解度曲线最平缓。(3)硝酸钾的溶解度受温度影响大,而氯化钠的溶解度受温度影响小。硝酸钾溶液中含有少量氯化钠杂质,应选择降温结晶,将硝酸钾结晶析出。 67891012345
单元整合67891012345专题一、溶液和物质的溶解度1.下列有关溶液的说法不正确的是( )A.蔗糖溶液是均一的、稳定的混合物B.硝酸钾在20 ℃时溶解度是31.6 g,则100 g硝酸钾溶液中含有硝酸钾31.6 gC.在鱼池中设立水泵,把水喷向空中可以增加水中氧气的溶解量D.降温或蒸发溶剂都能使接近饱和的氯化钠溶液达到饱和 答案解析678910123452.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )A.由饱和溶液变为不饱和溶液B.溶质质量不变C.溶液质量不变D.溶质的质量分数减小 答案解析678910123453.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见表)。通过分析她得出以下结论,其中不正确的是( )A.温度和溶剂种类对NaOH的溶解度都有影响B.NaOH易溶于水,也易溶于酒精C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多 答案解析678910123454.通过如图所示的实验(不考虑水分蒸发),得到相应的五种溶液。下列叙述不正确的是( )A.t1 ℃时,溶液①是不饱和溶液B.t2 ℃时,溶液④是饱和溶液C.t1 ℃时,溶液⑤是饱和溶液D.t2 ℃时,溶液③是不饱和溶液 答案解析67891012345专题二、溶解度曲线的应用5.如图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是 ( )A.20 ℃时,甲物质的溶解度比乙物质的溶解度小B.甲物质中混有少量乙物质,采用蒸发结晶的方法提纯甲物质C.40 ℃时,甲、乙两种物质的饱和溶液中溶质质量相等D.60 ℃时,将80 g甲物质放入100 g水中,所得溶液中溶质质量与溶剂质量之比是4∶5 答案解析678910123456.如图是四种物质的溶解度曲线,下列说法中正确的是( )A.20 ℃时,分别配制四种物质的饱和溶液,硫酸铵需要水的质量最少B.40 ℃时,向硫酸铵饱和溶液中加入适量氯化钾固体会析出硫酸钾晶体C.氯化钾饱和溶液的溶质质量分数一定小于氯化铵饱和溶液的溶质质量分数D.用30 g硫酸钾固体最多可配制150 g 80 ℃的硫酸钾饱和溶液 答案解析678910123457.甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )①甲的溶解度随温度的升高而增大②40 ℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法③20 ℃时,向125 g溶质质量分数为20%的乙溶液中加入15 g乙固体并振荡,有固体不溶解④将相同质量的甲和乙的饱和溶液分别从40 ℃降温至10 ℃,甲析出晶体的质量大A.①② B.③④ C.①③④ D.②③④ 答案解析678910123458.t2 ℃时,将甲、乙各80 g分别放入盛有100 g水的两个烧杯中,充分溶解后,恢复到t2 ℃,现象如图1。甲和乙的溶解度曲线如图2。请结合图示回答下列问题:67891012345(1)固体甲对应的溶解度曲线是 (填“a”或“b”)。 (2)M点的含义 。 (3)向烧杯①的溶液中继续加入15 g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出。你认为“全部溶解”的原因是 。 (4)将t2 ℃等质量的甲、乙饱和溶液分别降温到t1 ℃时,所得溶液的有关说法正确的是 (填字母)。 A.甲溶液仍为饱和溶液B.两溶液质量甲<乙C.两溶液中溶剂质量甲=乙D.两溶液溶质的质量分数甲>乙答案:(1)a (2)t1℃时,甲、乙两物质的溶解度相等 (3)甲溶于水放热,使甲的溶解度增大 (4)ABD67891012345解析:(1)t2 ℃时,将甲、乙各80 g分别放到盛有100 g水的两个烧杯中,充分溶解后,恢复到t2 ℃,甲完全溶解,乙有剩余,说明t2 ℃时,甲的溶解度比乙的大,a为甲的溶解度曲线。(2)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。故M点的含义是t1 ℃时,甲、乙两物质的溶解度相等。(3)甲的溶解度随温度升高而增大,所以充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出,“全部溶解”的原因是甲溶于水放热,使甲的溶解度增大,降温后因溶解度变小又析出。(4)将t2 ℃等质量的甲、乙饱和溶液分别降温到t1 ℃时,甲的溶解度减小析出晶体,得饱和溶液;由于甲析出晶体溶液质量减小,而乙不析出晶体,溶液的质量不变,所以两溶液质量甲<乙;t2 ℃时,甲溶解度比乙的大,等质量两种物质的饱和溶液中,甲溶液溶剂比乙的少;t1 ℃时,甲溶解度比乙t2 ℃时的溶解度大,所以降温到t1 ℃,两溶液溶质质量分数甲>乙。67891012345专题三、有关溶质质量分数的计算与溶液的配制 9.a、b、c三种物质的溶解度曲线如右图所示。取等质量t2 ℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2 ℃。下列说法不正确的是( )A.原饱和溶液中,溶质的质量分数a>b=cB.恢复至t2 ℃时,析出溶质的质量a>b=cC.恢复至t2 ℃时,三种溶液一定都是饱和溶液D.若继续降温至t1 ℃,三种溶液一定都是饱和溶液 答案解析6789101234510.氯化钠是一种重要的资源,在海水中储量很丰富。(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质的质量相等的溶液是 (填编号);与B溶液中溶质质量分数相等的溶液是 (填编号)。 (2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。据图回答下列问题:溶解度变化受温度影响最大的是 。t ℃时,溶解度最小的是 。t ℃时,将25 g硒酸镉加入 g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液中溶质的质量分数,可进行的操作是 。 67891012345(3)硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 。答案: (1)A CD(2)硝酸钾 氯化钠 50 降低温度并加入硒酸镉(3)降温结晶(或冷却热饱和溶液)解析: (1)在A到B海水蒸发过程中,溶液由不饱和变为饱和,溶质质量不变。由B到C再到D是结晶过程,结晶后的母液是饱和溶液,溶质的质量分数不变。(2)溶解度受温度影响最大的物质的溶解度曲线斜率最大,受温度影响最小的物质的溶解度曲线最平缓。(3)硝酸钾的溶解度受温度影响大,而氯化钠的溶解度受温度影响小。硝酸钾溶液中含有少量氯化钠杂质,应选择降温结晶,将硝酸钾结晶析出。 67891012345
相关资料
更多









