



人教版 (2019)必修 第一册第二节 金属材料教案配套ppt课件
展开基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
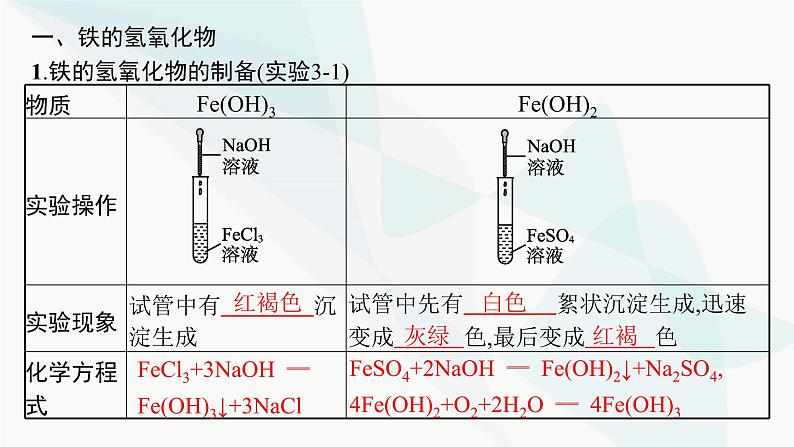
一、铁的氢氧化物1.铁的氢氧化物的制备(实验3-1)
FeCl3+3NaOH ══ Fe(OH)3↓+3NaCl
FeSO4+2NaOH ══ Fe(OH)2↓+Na2SO4, 4Fe(OH)2+O2+2H2O ══ 4Fe(OH)3
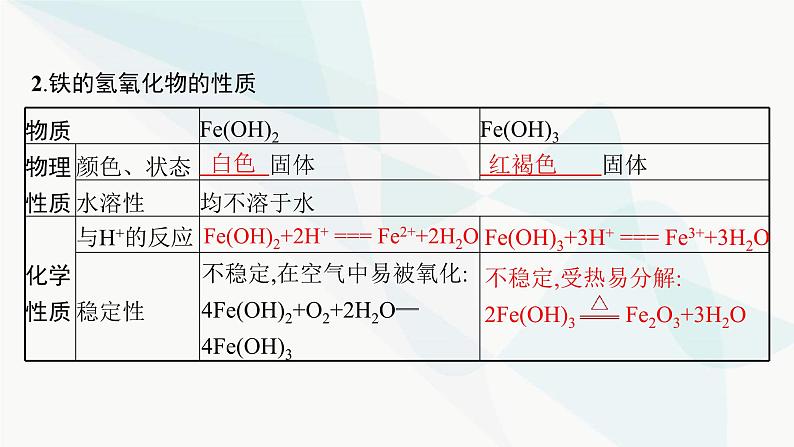
2.铁的氢氧化物的性质
Fe(OH)2+2H+ === Fe2++2H2O
Fe(OH)3+3H+ === Fe3++3H2O
不稳定,受热易分解:2Fe(OH)3 Fe2O3+3H2O
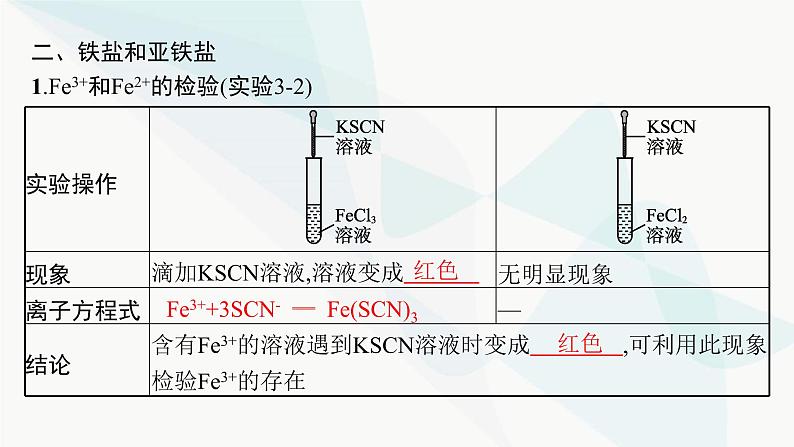
二、铁盐和亚铁盐1.Fe3+和Fe2+的检验(实验3-2)
Fe3++3SCN- ══ Fe(SCN)3
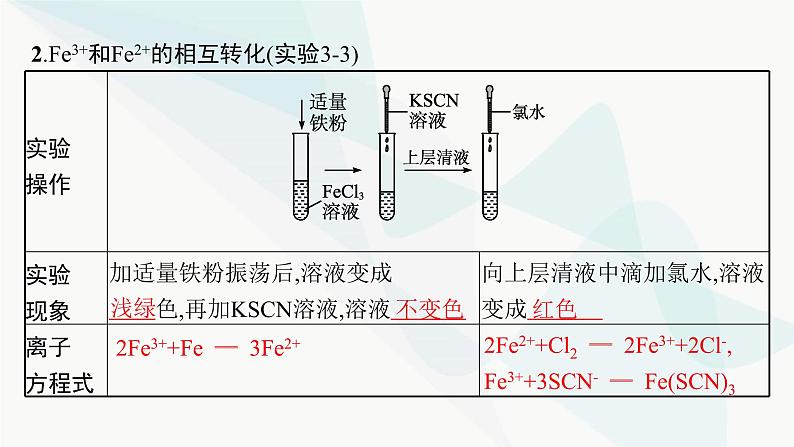
2.Fe3+和Fe2+的相互转化(实验3-3)
2Fe3++Fe ══ 3Fe2+
2Fe2++Cl2 ══ 2Fe3++2Cl-,Fe3++3SCN- ══ Fe(SCN)3
归纳总结Fe(OH)3和Fe(OH)2的制备(1)制备Fe(OH)3和Fe(OH)2时,利用可溶性的铁盐、亚铁盐与碱溶液发生复分解反应。(2)制备Fe(OH)2的关键是隔绝空气中的O2,防止被氧化。
教材拓展(1)Fe(OH)2中Fe元素显+2价,具有较强还原性,与HNO3等氧化性酸发生氧化还原反应:3Fe(OH)2+10HNO3(稀) ══ 3Fe(NO3)3+NO↑+8H2O。(2)Fe(OH)3中Fe元素显+3价,具有较强氧化性,与HI等还原性酸发生氧化还原反应:2Fe(OH)3+6HI ══ I2+2FeI2+6H2O。
易错警示Fe3+和Fe2+的检验(1)向含Fe3+的溶液中滴加KSCN溶液,溶液变成红色,并非生成红色沉淀。(2)检验待测液中是否含有Fe2+时,要先加入KSCN溶液,再滴加氯水,试剂加入顺序不能颠倒,氯水可用H2O2溶液代替。(3)利用酸性KMnO4溶液检验Fe2+时,溶液中不能含有还原性离子,如Cl-、I-等。
深度思考某溶液中滴加KSCN溶液,溶液变成红色,据此能否判断Fe3+、Fe2+的存在?
提示 一定含Fe3+,可能含有Fe2+。
易错辨析(1)Fe与稀硫酸、CuSO4溶液反应均可转化为FeSO4。( )(2)FeSO4被稀硫酸氧化转化为Fe2(SO4)3。( )(3)向Fe2(SO4)3溶液中加入铁粉,可转化为FeSO4。( )(4)向Fe(OH)2、Fe(OH)3中分别加入稀硫酸可生成FeSO4、Fe2(SO4)3。( )
提示 (2)稀硫酸不具有强氧化性,不与FeSO4发生反应。
探究一 探究氢氧化亚铁的制备
实验表明,Fe(OH)2很不稳定,容易被空气中的O2氧化。小倩同学查阅资料,设计如图所示装置来制取Fe(OH)2沉淀和观察Fe(OH)2在空气中被O2氧化时的颜色变化。
(1)实验开始时,如何排出装置内的空气,防止Fe(OH)2被氧化?(2)装置A中反应一段时间后,如何操作可制取Fe(OH)2白色沉淀?(3)取下装置B的橡胶塞,使空气进入装置B,观察到什么现象?写出反应的化学方程式。
提示 先打开活塞E,再打开分液漏斗活塞滴入6 ml·L-1硫酸,利用反应产生的H2排出装置内的空气。
提示 关闭活塞E,利用产生的H2使装置A中压强增大,将A中溶液压入装置B中,在B中生成Fe(OH)2白色沉淀。
提示 白色絮状沉淀迅速变成灰绿色,过一段时间后还会有红褐色物质生成;4Fe(OH)2+O2+2H2O ══ 4Fe(OH)3。
方法突破1.实验室制备Fe(OH)2的两种方法
2.实验室制备Fe(OH)2的注意事项(1)亚铁盐必须是新制的,并加入铁粉,防止Fe2+被空气中的O2氧化为Fe3+;(2)要除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液;(3)长胶头滴管末端伸入试管内亚铁盐溶液的液面以下,再挤出NaOH溶液;(4)必要时,可在溶液上方加少量煤油、植物油、苯等密度小于水的有机溶剂进行液封,以隔绝空气。
1.在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是( )
解析 NaOH溶液滴入FeSO4溶液中,二者在FeSO4液面处生成Fe(OH)2, Fe(OH)2迅速被O2氧化,不能较长时间保存,A错误;NaOH溶液与FeCl3溶液反应生成红褐色沉淀Fe(OH)3,不能制取Fe(OH)2,B错误;先滴加稀硫酸,铁粉与稀硫酸反应生成H2,利用产生的H2排出装置内空气,再滴加NaOH溶液,反应生成白色沉淀Fe(OH)2,并能较长时间保存,C正确;NaOH溶液通过长胶头滴管滴入FeCl2溶液中,在液体内部生成Fe(OH)2,未隔绝空气,不能较长时间保存Fe(OH)2,D错误。
【变式设问】若对装置D进行改进,如何操作可达到预期实验目的?
提示 预先将NaOH溶液煮沸、冷却,向FeCl2溶液中加少量铁粉,并在FeCl2溶液表面加少量煤油、苯等有机化合物隔绝空气。
2.实验室可以用如图所示装置制备氢氧化亚铁,下列说法错误的是( )A.实验前应把稀硫酸和氢氧化钠溶液均煮沸处理B.实验开始阶段,应把弹簧夹C和D都打开C.一段时间后,关闭弹簧夹C和D,在B中生成白色絮状沉淀
D.实验结束后关闭弹簧夹D,可以长时间保存氢氧化亚铁
解析 实验前,把稀硫酸和氢氧化钠溶液均煮沸处理,排出溶液中溶解的O2,防止Fe(OH)2被氧化,A正确;实验开始阶段,把弹簧夹C和D都打开,利用装置A中产生的H2排出装置内的空气,B正确;一段时间后,关闭弹簧夹C,将装置A中生成的FeSO4溶液压入装置B中,在B中生成白色絮状沉淀,不能关闭弹簧夹D,否则A中溶液不能进入B,C错误;实验结束后关闭弹簧夹D,空气不能进入B,可以长时间保存氢氧化亚铁,D正确。
探究二 探究溶液中Fe2+和Fe3+的检验
菠菜、芹菜、黑木耳、蛋黄和动物内脏等食品中富含铁元素,某研究小组设计实验,检验菠菜中铁元素,实验步骤如下:(1)取新鲜的菠菜10 g,将菠菜剪碎后研磨,然后倒入烧杯中,加入30 mL蒸馏水,搅拌。将上述浊液过滤,得到的滤液作为试验样品。(2)取少许试验样品加入试管中,然后滴加几滴KSCN溶液,再加入少量氯水,振荡,观察现象。
回答下列问题:(1)剪碎后的菠菜放在 中研磨,过滤浊液时用到的玻璃仪器有 。 (2)试验样品中滴加KSCN溶液,无明显现象,再加入少量氯水,溶液变成红色,据此得出什么结论?
提示 研钵 漏斗、玻璃棒、烧杯
提示 菠菜中含有铁元素,且以Fe2+形式存在。
方法突破 Fe2+和Fe3+的检验方法
名师点拨 (1)待测液滴加KSCN溶液,溶液变为红色,证明含有Fe3+,不能判断是否含有Fe2+。(2)检验Fe2+时,要先滴加KSCN溶液,后滴加氯水(或H2O2溶液),加入试剂的顺序不能颠倒。(3)利用酸性KMnO4溶液检验Fe2+时,待测液中不能含有Cl-等其他还原性离子,否则将影响Fe2+的检验。
1.能验证某溶液中含有Fe2+不含Fe3+的实验事实是( )A.向溶液中滴加KSCN溶液,溶液变红B.向溶液中滴加KSCN溶液,无明显变化;再滴加几滴氯水,溶液变红C.向溶液中依次滴加氯水、KSCN溶液,溶液变红D.向溶液中滴加少量NaOH溶液,产生红褐色沉淀
解析 向溶液中滴加KSCN溶液,溶液变红,说明含Fe3+,A错误。向溶液中滴加KSCN溶液,无明显变化,说明不含Fe3+;再滴加几滴氯水,溶液变红,说明Fe2+被氯气氧化为Fe3+,B正确。氯水能把Fe2+氧化为Fe3+,向溶液中依次滴加氯水、KSCN溶液,溶液变红,说明溶液中含有Fe2+或Fe3+,C错误。Fe3+和OH-反应生成红褐色氢氧化铁沉淀,向溶液中滴加少量NaOH溶液,产生红褐色沉淀,证明含有Fe3+,D错误。
2.[2023湖北鄂州高一期中]为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其结论正确的是( )A.滴加KSCN溶液,溶液变红,说明铁粉变质B.滴加KSCN溶液,溶液未变红,说明铁粉未变质C.依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质D.滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质
解析 取少量样品溶于盐酸,滴加KSCN溶液,溶液变红,则含有Fe3+,说明铁粉变质,A正确;滴加KSCN溶液,溶液未变红,则不含Fe3+,但还原铁粉有可能被氧化为Fe2+,B错误;依次滴加氯水、KSCN溶液,溶液变红,不能判断铁粉是否全部变质,C错误;滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明溶液中含有Fe2+,Fe2+可能是Fe与盐酸反应,D错误。
1.向FeSO4溶液中加入NaOH溶液,生成的白色沉淀迅速变成灰绿色,一段时间后沉淀变成红褐色,该红褐色沉淀对应化合物中铁元素的化合价为( )A.+3价B.+2价C.+1价D.0价
解析 FeSO4溶液与NaOH溶液反应生成Fe(OH)2白色沉淀,后变为灰绿色,最后变为红褐色Fe(OH)3沉淀,故铁元素的化合价为+3价。
2.电子工业中利用FeCl3溶液作为“腐蚀液”制作印刷电路板,检验浸泡过覆铜板的“腐蚀液”是否有Fe3+剩余,可选用的试剂是( )A.氯水B.酸性KMnO4溶液C.KSCN溶液D.双氧水
解析 检验“腐蚀液”是否有Fe3+剩余,可滴加KSCN溶液,若溶液变为红色,说明有Fe3+剩余,若不变色,则Fe3+无剩余。
3.某化学兴趣小组在学习铁及其化合物知识时,做了如下探究实验:
下列说法不正确的是( )A.现象1有淡红色,说明有少量的Fe2+被氧化了B.现象2溶液变红色,说明Fe2+被氧化为Fe3+,同时双氧水被还原为氧气C.现象3红色褪去,说明发生了反应:2Fe3++Fe ══ 3Fe2+D.由现象4可推测加入过量的双氧水后SCN-可能被氧化生成了气体
解析 向氯化亚铁溶液滴加KSCN溶液,有淡红色,说明该溶液含少量Fe3+,有少量的Fe2+被氧化,A正确;H2O2被还原,元素化合价应降低,不可能生成O2,B错误;加入过量铁粉,发生反应:2Fe3++Fe ══ 3Fe2+,溶液的红色褪去,C正确;加入过量双氧水,可能是过量H2O2将SCN-氧化生成气体,溶液变为黄色,有少量气泡产生,D正确。
4.[2023湖南衡阳高一期中]电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
(1)物质A的化学式是 。 (2)取少量滤液B于试管中,滴加NaOH溶液,产生的现象是 。 请写出此过程中属于氧化还原反应的化学方程式: 。
(3)写出步骤(Ⅱ)中生成FeCl3的离子方程式: 。 (4)将FeCl3饱和溶液滴入 中,并继续煮沸至红褐色,可制得Fe(OH)3胶体。 (5)将一定量的铜粉加入FeCl3溶液中,完全反应后,所得溶液中的Cu2+和Fe3+的物质的量恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为 。
答案 (1)Fe(2)生成的白色沉淀迅速变成灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O ══ 4Fe(OH)3(3)2Fe2++Cl2 ══ 2Fe3++2Cl-(4)沸水(5)2∶1
解析 由流程可知,废液(主要含FeCl3、FeCl2、CuCl2)中加入过量铁,铁和氯化铁生成氯化亚铁、和氯化铜生成铜和氯化亚铁,故过量A是铁,滤液B中含有氯化亚铁,固体中含有过量的铁和生成的铜;固体中加入过量盐酸,盐酸和铜不反应、和铁反应生成氢气和氯化亚铁,故D为氢气、滤液C中含有过量盐酸和生成的氯化亚铁;滤液B与滤液C混合后通入氯气,氯气和氯化亚铁反应得到氯化铁溶液。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物教学课件ppt,共59页。PPT课件主要包含了课前·基础认知,课堂·重难突破,随堂训练,2化学性质,答案C等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料作业ppt课件: 这是一份人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料作业ppt课件,共29页。PPT课件主要包含了答案D等内容,欢迎下载使用。
高中化学必修一 3.1.2 铁的氢氧化物 铁盐和亚铁盐课件新: 这是一份高中化学必修一 3.1.2 铁的氢氧化物 铁盐和亚铁盐课件新,共18页。













