






所属成套资源:全套人教B版高中化学必修第一册课时教学课件
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物授课ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 氯及其化合物授课ppt课件,共50页。PPT课件主要包含了目录索引,探究二氯离子的检验等内容,欢迎下载使用。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
一、氯气的实验室制法1.制取原理在实验室中,通常用浓盐酸与MnO2加热反应来制取氯气,化学方程式为 ,离子方程式为 。 微点归纳 该反应中,HCl有两种作用:一是作还原剂(被氧化生成Cl2);二是起酸的作用,生成相应盐(MnCl2)。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
(1)反应条件: 。 (2)收集方法: 。 (3)烧杯中NaOH溶液反应的化学方程式为 ,其作用是 。
2NaOH+Cl2===NaCl+NaClO+H2O
吸收尾气Cl2,防止污染环境
微点归纳 该实验中两个要点:(1)必须使用浓盐酸,MnO2与稀盐酸不反应;(2)必须加热,常温下不反应。
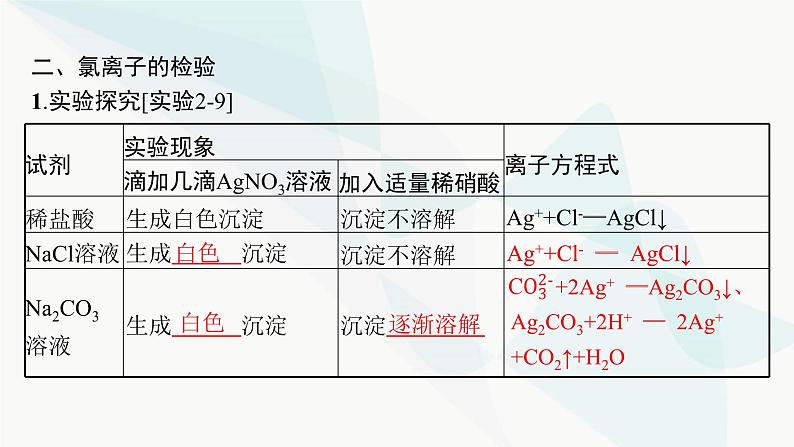
二、氯离子的检验1.实验探究[实验2-9]
Ag++Cl- ══ AgCl↓
+2Ag+ ══Ag2CO3↓、Ag2CO3+2H+ ══ 2Ag+ +CO2↑+H2O
教材拓展实验室制取氯气的其他方法(1)实验室利用强氧化剂[如KMnO4、KClO3、K2Cr2O7、Ca(ClO)2等]与浓盐酸反应制取氯气。(2)制取原理①2KMnO4+16HCl(浓) ══ 2KCl+2MnCl2+5Cl2↑+8H2O;②KClO3+6HCl(浓) ══ KCl+3Cl2↑+3H2O。
教材拓展氯气的工业生产工业上采用离子膜电解槽电解饱和食盐水制取Cl2,化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
归纳总结(1)过量MnO2与浓盐酸反应时,随着反应的进行,盐酸浓度减小,变成稀盐酸,反应停止。(2)加热时,为减少浓盐酸的挥发,温度不宜过高。(3)制得的Cl2中混有挥发出的HCl和H2O(g),依次通过盛有饱和NaCl溶液、浓硫酸的洗气瓶,分别除去HCl、H2O(g)。
深度思考向某待测液中滴加AgNO3溶液,产生白色沉淀,则该溶液中一定含有Cl-,该观点是否正确?为什么?
提示 不正确;待测液中滴加AgNO3溶液,产生白色沉淀,该沉淀可能是AgCl、Ag2CO3等,故无法判断是否含有Cl-。
探究一 氯气的实验室制法
1774年的一天瑞典化学家舍勒把软锰矿(主要成分是MnO2)和浓盐酸混合加热时,惊奇地看到一种黄绿色的气体冒出,其反应原理为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。目前,实验室制取氯气仍沿用200多年前舍勒制取氯气的方法,下图是实验室制取氯气的典型装置:
(1)利用上述装置制得的氯气中混有哪些杂质?如何除去这些杂质?(2)实验室中能否用排水法收集Cl2?你的判断依据是什么?(3)某同学利用澄清石灰水代替NaOH溶液进行尾气处理,同时制得漂白粉,你认为该同学的想法是否合理?为什么?
提示 Cl2中混有HCl、水蒸气;通过饱和食盐水除去HCl,通过浓硫酸除去水蒸气。
提示 不能;氯气能溶于水,且与水发生反应。
提示 不合理;Ca(OH)2微溶于水,澄清石灰水中Ca(OH)2的浓度较小,不能保证Cl2被完全吸收;制取漂白粉应该利用氯气与石灰乳反应。
方法突破实验室制取氯气的反应原理、除杂、收集和尾气处理
1.[2023广东深圳高一期中]实验室用如图所示装置制取氯气,并用氯气进行实验,D中为红色湿布条,E中为蘸有NaBr溶液的棉花团。已知溴水为橙黄色,实验中观察到E中棉花团变黄色,F中棉花团变蓝色。下列说法错误的是( )
A.装置A中反应的离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2OB.装置B中盛有饱和食盐水,C中试剂的作用是除去Cl2中H2O(g)C.装置D中红色布条褪色,原因是Cl2与水反应生成了HClOD.根据装置E和F中实验现象,可得出氧化性:Cl2>Br2>I2
答案 D解析 装置B中盛有饱和食盐水以除去HCl杂质,装置C中用浓硫酸干燥氯气,装置G用于吸收尾气,B正确;氯气与水反应生成的HClO具有漂白性,则D中布条褪色,C正确;E中氯气与NaBr反应生成溴,则E中棉花团变黄,F中可能是氯气与KI反应生成I2,淀粉遇碘变蓝,F中棉花团变蓝,则该实验不能比较Br2、I2的氧化性强弱,D错误。
2.某实验小组进行Cl2的制备和性质探究,下列装置和药品能实现相应实验目的的是( )
A.利用甲制备Cl2B.利用乙除去Cl2中混有的HCl杂质C.利用丙探究Cl2无漂白性D.利用丁观察Cl2和H2燃烧反应的火焰颜色
解析 MnO2与浓盐酸在常温下不反应,必须加热,甲装置缺少酒精灯,A错误;制取的Cl2中混有HCl,将其通过盛有饱和NaCl溶液的洗气瓶除去HCl,B正确;鲜花中含有水分,能与Cl2反应生成HCl和HClO,故鲜花褪色,不能证明Cl2无漂白性,C错误;Cl2不能燃烧,应将点燃的H2通过导管伸入盛有Cl2的集气瓶中,D错误。
小明家里养了两条金鱼,中午饭期间小明直接给鱼缸添加自来水,但闻到自来水有股刺激性气味。下午放学回家,小明发现金鱼已经死亡。妈妈告诉小明,自来水用氯气进行了消毒,养金鱼时,要将自来水在日光下晒三天,再将其倒入鱼缸中。
小明为了验证妈妈的这种说法,用矿泉水瓶盛装自来水,第二天带到学校实验室进行检验。(1)你认为小明妈妈的推测是否合理?依据是什么?
提示 合理;氯气具有刺激性气味,用氯气消毒的自来水也有刺激性气味。
(2)请你帮助小明设计实验验证自来水可能用氯气进行了消毒处理。
提示 取少量自来水放入试管中,先滴加稀硝酸酸化,再加入AgNO3溶液,产生白色沉淀,证明自来水中含有Cl-,可能用氯气进行了消毒处理。(其他合理方案均可)
方法突破1.氯离子的检验原理及注意事项
2.氯离子检验的答题规范
1.下列离子检验的方法正确的是( )
解析 待测液中加入AgNO3溶液,产生白色沉淀,该沉淀可能是AgCl、Ag2CO3等,不能判断原溶液中是否含Cl-,A错误;待测液中加入BaCl2溶液,产生白色沉淀,该沉淀可能是BaSO4、BaCO3或AgCl等,故不能判断原溶液是否含有 ,B错误;待测液中加入NaOH溶液,产生蓝色沉淀,该沉淀是Cu(OH)2,则原溶液中含有Cu2+,C正确;待测液中加入稀硫酸,产生无色无味气体,该气体是CO2,则原溶液中可能含有 ,D错误。
2.下列检验硫酸钠溶液中含有氯离子的方法正确的是( )A.先加BaCl2溶液,过滤,再加AgNO3溶液B.先加AgNO3溶液,再加稀硝酸溶液C.先加足量的Ba(NO3)2溶液,过滤,再加AgNO3溶液D.先加足量的Ba(OH)2溶液,过滤,再加AgNO3溶液
解析 先加BaCl2溶液,引入了氯离子,最终无法确定原溶液中是否有氯离子,A错误; 与Ag+能生成Ag2SO4沉淀,对Cl-的检验有干扰,B错误;先加足量Ba(NO3)2溶液,除去硫酸根离子,过滤,再加AgNO3溶液,生成白色沉淀,证明有Cl-存在,C正确;先加Ba(OH)2溶液,除去 的同时引入了大量OH-, Ag+与OH-反应,对后续Cl-的检验有干扰,D错误。
探究三 氯及其化合物的研究思路和方法的建构
我们可以运用分类的方法,根据物质所属的类别或利用有关反应规律预测物质的性质。基于核心元素Cl的化合价认识物质,是研究氯及其化合物的重要视角,为我们认识氯及其化合物的性质和实现转化提供了思路。氯及其化合物的“价—类”二维图如下:
(1)从物质类别和元素价态角度推测ClO2可能具有的化学性质。(2)NaClO溶液、KClO3溶液中分别加入浓盐酸均可产生Cl2,试写出反应的离子方程式。
提示 ClO2属于非金属氧化物,具有非金属氧化物的通性;Cl元素显+4价,处于中间价态,推测ClO2既具有氧化性又具有还原性。
提示 ClO-+Cl-+2H+ ══ Cl2↑+H2O、 +5Cl-+6H+ ══ 3Cl2↑+3H2O。
方法突破 氯及其化合物的研究思路和方法的建构
1.下图为氯及其化合物的“价—类”二维图,下列叙述错误的是( )
A.常温下,a的稀溶液与二氧化锰反应可制取bB.理论上a溶液和e混合可制得bC.c和f均可用于环境杀菌消毒D.d见光易分解
解析 由题图可知,a为HCl,b为Cl2,常温下,稀盐酸与MnO2不发生反应,A错误;e为+5价氯的含氧酸盐,具有较强氧化性,可与浓盐酸发生“价态归中”的氧化还原反应生成Cl2,B正确;c为ClO2,f为次氯酸盐,都具有强氧化性,可用于环境杀菌消毒,C正确;d是HClO,见光分解生成HCl和O2,D正确。
2.“价—类”二维图是学习元素及其化合物知识的重要模型。氯元素的“价—类”二维图如图所示,下列说法不正确的是( )A.a是HCl,从元素价态看,HCl只具有还原性B.b与水反应可以得到dC.c对应的含氧酸能与NaOH溶液反应D.可溶性e中的阴离子可用AgNO3溶液和稀硝酸检验
解析 由题图可知,a是HCl,H元素显+1价,处于最高价态,故HCl具有氧化性,A错误;b是Cl2,d是HClO,Cl2与水反应可得到HClO,B正确;c是Cl2O7,对应的含氧酸为HClO4,能与NaOH溶液发生中和反应,C正确;e中阴离子为Cl-,检验时先加稀硝酸酸化,再滴加AgNO3溶液,若生成白色沉淀则含有Cl-,D正确。
1.实验室用下列装置制取干燥氯气并处理尾气,其中不能达到实验目的的是( )
答案A解析 MnO2与浓盐酸反应制取Cl2,要在加热条件下进行,缺少加热装置。
2.实验室用如图所示装置来制取少量氯气,下列说法正确的是( )
A.圆底烧瓶中加入的是稀盐酸B.C瓶的作用是收集氯气C.F中加入NaOH溶液用于吸收多余的氯气D.用该装置制取氯气前无须检查装置的气密性
解析 实验室利用MnO2固体与浓盐酸在加热条件下反应制取Cl2,圆底烧瓶中应加入浓盐酸,A错误;C瓶中饱和食盐水的作用是除去Cl2中的HCl,B错误;F中盛有NaOH溶液,用于吸收Cl2尾气,防止污染环境,C正确;制取Cl2的装置,在加入药品前要先检验装置的气密性,D错误。
3.下列是对“某溶液”进行离子检测的方法和结论,其中说法正确的是( )A.加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定含有B.先加入稀盐酸,再加入AgNO3溶液,有白色沉淀产生,则溶液中一定含有Cl-C.加入BaCl2溶液,有白色沉淀产生,则溶液中一定含有D.加入HNO3酸化后,再加入AgNO3溶液,有白色沉淀产生,则溶液中一定含有Cl-
解析 加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该气体是CO2,则溶液中含有 、 中至少一种,A错误;先加入稀盐酸,再加入AgNO3溶液,有白色沉淀产生,该沉淀为AgCl,由于加入稀盐酸引入Cl-,不能判断原溶液中是否含Cl-,B错误;加入BaCl2溶液,有白色沉淀产生,该沉淀可能是BaSO4、BaCO3、AgCl等,故不能判断原溶液中是否含 ,C错误。
4.[2023广西桂林高一期中]实验室用如图所示装置制取并收集氯气。下列说法正确的是( )
A.该实验的反应原理为MnO2+4HCl ══ MnCl2+Cl2↑+2H2OB.该图所示的过程中只存在2处明显错误C.实验室还可以用排饱和食盐水的方法收集Cl2D.收集氯气时可用干燥的蓝色石蕊试纸验满
解析 实验室利用二氧化锰和浓盐酸在加热条件下反应制取Cl2,A错误;图示存在4处错误,第一处错误是应该用浓盐酸,第二处错误是发生装置要加热,第三处错误是氯气密度比空气大,收集装置应长管进短管出,第四处错误是氯气有毒不能直接排放到空气中,B错误;可用排饱和食盐水或向上排空气法收集氯气,C正确;氯气不能使干燥的蓝色石蕊试纸变色,应用湿润的蓝色石蕊试纸,D错误。
5.科学家舍勒和戴维对氯气的制取和研究作出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:Ⅰ.氯气的制备(装置如图所示)
(1)装置G的名称为 ,装置F的作用为 。
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为 (填写仪器下方字母)。
Ⅱ.漂白粉的制备(装置如图所示)
查阅资料可知:①氯气与碱反应放出热量;②6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O。(3)装置C中发生反应的化学方程式为 。 (4)多孔球泡的作用是 ,使用冰水浴的目的是 。
相关课件
这是一份高中第二节 氯及其化合物示范课ppt课件,共42页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 氯及其化合物作业课件ppt,共24页。
这是一份化学必修 第一册第二节 氯及其化合物作业课件ppt,共26页。PPT课件主要包含了答案D等内容,欢迎下载使用。









