





还剩24页未读,
继续阅读
所属成套资源:全套鲁科版高中化学选择性必修1课时分层作业课件
成套系列资料,整套一键下载
鲁科版高中化学选择性必修1第1章化学反应与能量转化分层作业4化学电源课件
展开
这是一份鲁科版高中化学选择性必修1第1章化学反应与能量转化分层作业4化学电源课件,共32页。
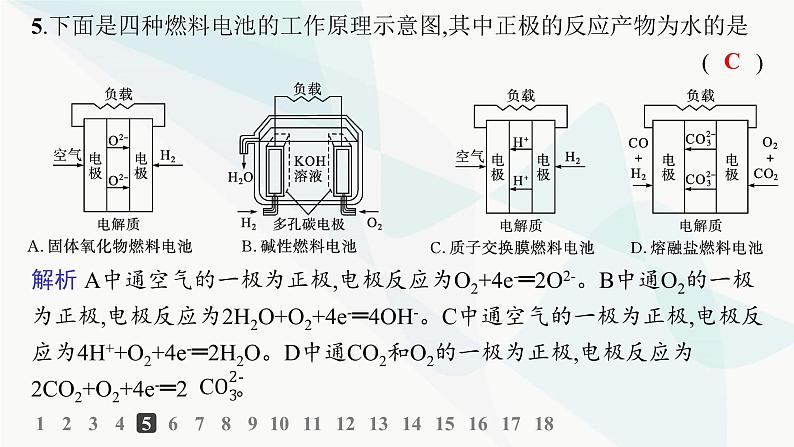
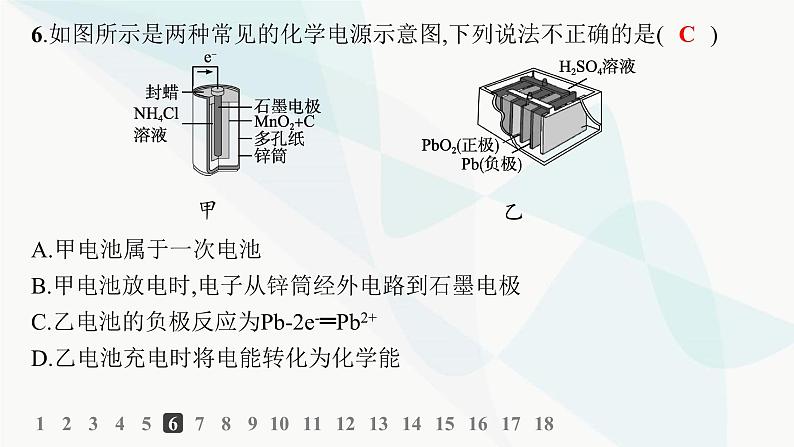
分层作业4 化学电源1234567891011121314151617181.下列说法正确的是( )A.碱性锌锰电池是二次电池B.铅蓄电池是一次电池C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生D.燃料电池的活性物质大量储存在电池内部C解析 碱性锌锰电池是一次电池,铅蓄电池是二次电池,A、B错误;燃料电池的活性物质不需要储存在电池内部,D错误。1234567891011121314151617182.下列有关电池的说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极B解析 铜锌原电池中,电子从负极锌沿外电路流向正极铜。 1234567891011121314151617183.在超市里经常会看到一种外壳为纸层包装的电池,印有如图所示的文字。下列有关说法错误的是( )A.该电池是一次电池B.该电池工作时,电子由负极通过外电路流入正极C.该电池含有的金属元素中毒性最大的是HgD.该电池工作时,外电路中每通过0.2 mol电子,锌的质量理论上减少3.25 gD解析 锌锰干电池工作时,锌失去电子,电极反应为Zn-2e-═Zn2+,所以外电路中每通过0.2 mol电子,锌的质量理论上应减少6.5 g,所以D项错误。1234567891011121314151617184.生产铅蓄电池时,在两极板上的铅锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )A.理论上需要定期补充硫酸B.电池工作时铅是负极,PbO2是正极C.电池工作时负极上发生的反应是D.电池工作时电解质的密度减小A123456789101112131415161718解析 铅蓄电池放电时相当于原电池,Pb是负极,PbO2是正极,负极发生的反应是Pb失去电子生成Pb2+,Pb2+与溶液中的 生成PbSO4沉淀;放电时消耗的硫酸与充电时生成的硫酸相等,在制备电池时,PbSO4的量是一定的,制成膏状,干燥后再安装,则理论上H2SO4不用补充;放电时,H2SO4被消耗,溶液中H2SO4的物质的量浓度减小,所以溶液的密度也随之减小。1234567891011121314151617185.下面是四种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )C1234567891011121314151617186.如图所示是两种常见的化学电源示意图,下列说法不正确的是( )甲 乙A.甲电池属于一次电池B.甲电池放电时,电子从锌筒经外电路到石墨电极C.乙电池的负极反应为Pb-2e-═Pb2+D.乙电池充电时将电能转化为化学能C123456789101112131415161718解析 甲电池是锌锰干电池,属于一次电池,A正确;甲电池中,锌作负极,放电时失去电子,电子从锌筒经外电路到石墨电极,B正确;乙电池的负极反应为Pb-2e-+ ═PbSO4,C错误;乙电池充电时是电解池装置,将电能转化为化学能,D正确。1234567891011121314151617187.如图为以Pt为电极的氢氧燃料电池的工作原理示意图,以稀硫酸为电解质溶液。下列有关说法不正确的是( )A.a极为负极,电子由a极经外电路流向b极B.a极的电极反应:H2-2e-═2H+C.电池工作一段时间后,装置中c(H2SO4)增大D.若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多C123456789101112131415161718解析 a极通入的H2发生氧化反应,则a极为负极,电子由a极经外电路流向b极,以稀硫酸为电解质溶液时,负极上H2被氧化为H+,A、B正确;电池总反应为2H2+O2═2H2O,则电池工作一段时间后,装置中c(H2SO4)减小,则C错误;根据电池总反应:2H2+O2═2H2O和CH4+2O2═CO2+2H2O可知,消耗等物质的量的H2和CH4时,CH4消耗O2较多,D正确。1234567891011121314151617188.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。下列有关说法正确的是( )A.电子通过外电路从b极流向a极B.b极上的电极反应为O2+2H2O+4e-═4OH-C.每转移0.1 mol电子,消耗1.12 L的H2D.H+由a极通过固体电解质传递到b极D123456789101112131415161718解析 由电池总反应及原电池原理可知,充入H2的一极即a极是负极,充入O2的一极即b极是正极;电子由负极经外电路流向正极;电池内部H+移向正极,正极的电极反应为O2+4H++4e-═2H2O,故A项、B项错误,D项正确。C项没有指明标准状况,错误。1234567891011121314151617189.经过长时间的研发和多次展示后,科技工作者开发出了甲醇燃料电池,该电池反应为2CH3OH+3O2+4KOH═2K2CO3+6H2O。请回答下列问题:(1)该燃料电池的电解质是________________。 (2)由电池反应可知,放电时该电池的负极反应物为___________________,该物质发生________________反应,负极的电极反应式为________________________________。 (3)电池使用过程中,当有0.5 mol电子转移时,消耗甲醇的质量是________ (结果保留两位小数)g。 (4)放电一段时间后,通入O2的电极附近溶液的pH____________ (填“升高” “不变”或“降低”)。 KOH CH3OH(或甲醇) 氧化 2.67 升高 123456789101112131415161718解析 (1)由电池反应可知,该电池的电解质是KOH。(2)放电时负极上CH3OH发生氧化反应,正极上O2发生还原反应。正极的电极反应为O2+2H2O+4e-═4OH-,负极的电极反应为CH3OH+8OH--6e-═ +6H2O。(3)根据负极的电极反应可得CH3OH~6e-,因此转移0.5 mol 电子时,消耗甲醇的质量约2.67 g。(4)根据放电时正极的电极反应可知,放电一段时间后,通入氧气的电极附近溶液的碱性增强,pH升高。12345678910111213141516171810.如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是( )A.电流由呼气所在的铂电极流出B.H+通过质子交换膜流向氧气所在的铂电极C.电路中流过2 mol电子时,消耗标准状况下O2 22.4 LD.该电池的负极反应为CH3CH2OH+3H2O-12e-═2CO2↑+12H+B123456789101112131415161718解析 呼气所在电极发生乙醇转化为醋酸的反应,故此电极为负极,而电流由正极流出,A项错误;H+通过质子交换膜流向正极(通入氧气的铂电极),B项正确;正极反应为O2+4e-+4H+═2H2O,电路中流过2 mol电子时,消耗0.5 mol O2,在标准状况下体积为11.2 L,C项错误;该电池的负极反应为CH3CH2OH+H2O-4e-═CH3COOH+4H+,D项错误。12345678910111213141516171811.以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示。下列说法不正确的是( )A.b电极为负极,发生氧化反应B.a电极的电极反应为N2+8H++6e-═2C.A溶液中所含溶质为NH4ClD.当反应消耗1 mol N2时,则消耗的H2为67.2 LD123456789101112131415161718解析 N2+3H2 2NH3,反应中氢元素的化合价升高,H2失去电子,因此b电极为负极,发生氧化反应,故A项正确;a电极为正极,电解质溶液含盐酸,因此电极反应为N2+8H++6e-═2 ,故B项正确;A溶液中所含溶质为NH4Cl,故C项正确;未告知温度和压强,不能确定H2的体积,故D项错误。12345678910111213141516171812.热激活电池可应用于特殊环境。一种热激活电池的工作原理如图所示,该电池的总反应为2Li+FeS2═Fe+Li2S2。下列说法正确的是( ) A.放电时Li+向a极移动B.正极的电极反应为FeS2+2e-═Fe+ C.电子由a电极经熔融介质流向b电极D.放电时,若有0.2 mol e-转移,则正极质量增加6.4 gB12345678910111213141516171812345678910111213141516171813.一种熔融碳酸盐燃料电池原理如图所示。下列有关该电池的说法正确的是( )D12345678910111213141516171812345678910111213141516171814.(2022湖南化学,8)海水电池在海洋能源领域备受关注,一种锂—海水电池构造示意图如下。下列说法错误的是( )A.海水起电解质溶液作用B.N极仅发生的电极反应:2H2O+2e-═2OH-+H2↑C.玻璃陶瓷具有传导离子和防水的功能D.该锂?海水电池属于一次电池B123456789101112131415161718解析 锂—海水电池的总反应为2Li+2H2O═2LiOH+H2↑,M极上Li失去电子发生氧化反应,则M电极为负极,电极反应为Li-e-═Li+,N极为正极,电极反应为2H2O+2e-═2OH-+H2↑,同时氧气也可以在N极得电子,电极反应为O2+4e-+2H2O═4OH-,故B错误;海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;该电池不可充电,属于一次电池,故D正确。12345678910111213141516171815.某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2下列推断中正确的是( )①放电时,Fe为正极,Ni2O3为负极 ②放电时,负极电极反应为Fe+2OH--2e-═Fe(OH)2 ③放电时,Ni2O3在正极反应 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中A.①②③ B.①②④ C.①③④ D.②③④D解析 放电时Fe被氧化,Ni2O3被还原,Fe作为负极,Ni2O3作为正极。放电时负极反应为Fe+2OH--2e-═Fe(OH)2,Ni2O3在正极上发生反应。由于放电时的产物均为碱性物质,故应用碱性电解质溶液。12345678910111213141516171816.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下。下列说法错误的是( )A.电极a为电池的负极B.电极b上发生的电极反应:O2+4H++4e-═2H2OC.电路中每通过4 mol电子,在正极消耗44.8 L H2SD.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区C123456789101112131415161718解析 根据燃料电池的特点分析,通氧气的一极为正极,故电极b为正极,电极a为负极,A正确;电极b为正极,氧气得电子结合H+生成水,B正确;从装置图可以看出,电池总反应为2H2S+O2═S2+2H2O,电路中每通过4 mol电子,正极应该消耗1 mol O2,负极应该有2 mol H2S反应,但是题目中没有说明是标准状况下,所以H2S的体积不一定是44.8 L,C错误;17 g H2S即0.5 mol H2S,每0.5 mol H2S参与反应会消耗0.25 mol O2,根据正极反应O2+4H++4e-═2H2O可知,有1 mol H+经质子膜进入正极区,D正确。12345678910111213141516171817.某新型可充电电池能长时间保持稳定的放电电压,该电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,电解质溶液为强碱溶液。(1)放电时负极反应为__________________________。 (2)放电时K2FeO4发生________________ (填“氧化”或“还原”)反应。 (3)放电时电子由_________ (填“正”或“负”,下同)极流向_________极。 (4)放电时1 mol K2FeO4发生反应,转移电子的物质的量为____________。Zn-2e-+2OH-═Zn(OH)2 还原 负 正 3 mol 解析 放电时锌在负极发生氧化反应,因为电解质是强碱,故负极反应是Zn-2e-+2OH-═Zn(OH)2。电子由负极流出,通过外电路流向正极,1 mol K2FeO4发生反应转移电子3 mol,放电时K2FeO4得电子发生还原反应。12345678910111213141516171818.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含的SO2快速启动,其装置示意图如图:①质子的流动方向为________________ (填“从A到B”或“从B到A”)。 ②负极的电极反应式为________________________________。 从A到B 123456789101112131415161718(2)NH3—O2燃料电池的结构如图所示: ①a极为电池的____________ (填“正”或“负”)极。 ②当生成1 mol N2时 ,电路中流过电子的物质的量为____________。 负 6 mol 123456789101112131415161718解析 (1)①根据题给图示,A为燃料电池的负极,B为燃料电池的正极,在原电池电解质溶液中,质子(H+)由负极向正极移动,即从A到B。(2)①a极通入氨气,是负极,b极通入氧气,是正极。②氨气中N元素的化合价由-3价变成0价,当生成1 mol N2时,转移电子的物质的量为6 mol。
分层作业4 化学电源1234567891011121314151617181.下列说法正确的是( )A.碱性锌锰电池是二次电池B.铅蓄电池是一次电池C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生D.燃料电池的活性物质大量储存在电池内部C解析 碱性锌锰电池是一次电池,铅蓄电池是二次电池,A、B错误;燃料电池的活性物质不需要储存在电池内部,D错误。1234567891011121314151617182.下列有关电池的说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极B解析 铜锌原电池中,电子从负极锌沿外电路流向正极铜。 1234567891011121314151617183.在超市里经常会看到一种外壳为纸层包装的电池,印有如图所示的文字。下列有关说法错误的是( )A.该电池是一次电池B.该电池工作时,电子由负极通过外电路流入正极C.该电池含有的金属元素中毒性最大的是HgD.该电池工作时,外电路中每通过0.2 mol电子,锌的质量理论上减少3.25 gD解析 锌锰干电池工作时,锌失去电子,电极反应为Zn-2e-═Zn2+,所以外电路中每通过0.2 mol电子,锌的质量理论上应减少6.5 g,所以D项错误。1234567891011121314151617184.生产铅蓄电池时,在两极板上的铅锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )A.理论上需要定期补充硫酸B.电池工作时铅是负极,PbO2是正极C.电池工作时负极上发生的反应是D.电池工作时电解质的密度减小A123456789101112131415161718解析 铅蓄电池放电时相当于原电池,Pb是负极,PbO2是正极,负极发生的反应是Pb失去电子生成Pb2+,Pb2+与溶液中的 生成PbSO4沉淀;放电时消耗的硫酸与充电时生成的硫酸相等,在制备电池时,PbSO4的量是一定的,制成膏状,干燥后再安装,则理论上H2SO4不用补充;放电时,H2SO4被消耗,溶液中H2SO4的物质的量浓度减小,所以溶液的密度也随之减小。1234567891011121314151617185.下面是四种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )C1234567891011121314151617186.如图所示是两种常见的化学电源示意图,下列说法不正确的是( )甲 乙A.甲电池属于一次电池B.甲电池放电时,电子从锌筒经外电路到石墨电极C.乙电池的负极反应为Pb-2e-═Pb2+D.乙电池充电时将电能转化为化学能C123456789101112131415161718解析 甲电池是锌锰干电池,属于一次电池,A正确;甲电池中,锌作负极,放电时失去电子,电子从锌筒经外电路到石墨电极,B正确;乙电池的负极反应为Pb-2e-+ ═PbSO4,C错误;乙电池充电时是电解池装置,将电能转化为化学能,D正确。1234567891011121314151617187.如图为以Pt为电极的氢氧燃料电池的工作原理示意图,以稀硫酸为电解质溶液。下列有关说法不正确的是( )A.a极为负极,电子由a极经外电路流向b极B.a极的电极反应:H2-2e-═2H+C.电池工作一段时间后,装置中c(H2SO4)增大D.若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多C123456789101112131415161718解析 a极通入的H2发生氧化反应,则a极为负极,电子由a极经外电路流向b极,以稀硫酸为电解质溶液时,负极上H2被氧化为H+,A、B正确;电池总反应为2H2+O2═2H2O,则电池工作一段时间后,装置中c(H2SO4)减小,则C错误;根据电池总反应:2H2+O2═2H2O和CH4+2O2═CO2+2H2O可知,消耗等物质的量的H2和CH4时,CH4消耗O2较多,D正确。1234567891011121314151617188.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。下列有关说法正确的是( )A.电子通过外电路从b极流向a极B.b极上的电极反应为O2+2H2O+4e-═4OH-C.每转移0.1 mol电子,消耗1.12 L的H2D.H+由a极通过固体电解质传递到b极D123456789101112131415161718解析 由电池总反应及原电池原理可知,充入H2的一极即a极是负极,充入O2的一极即b极是正极;电子由负极经外电路流向正极;电池内部H+移向正极,正极的电极反应为O2+4H++4e-═2H2O,故A项、B项错误,D项正确。C项没有指明标准状况,错误。1234567891011121314151617189.经过长时间的研发和多次展示后,科技工作者开发出了甲醇燃料电池,该电池反应为2CH3OH+3O2+4KOH═2K2CO3+6H2O。请回答下列问题:(1)该燃料电池的电解质是________________。 (2)由电池反应可知,放电时该电池的负极反应物为___________________,该物质发生________________反应,负极的电极反应式为________________________________。 (3)电池使用过程中,当有0.5 mol电子转移时,消耗甲醇的质量是________ (结果保留两位小数)g。 (4)放电一段时间后,通入O2的电极附近溶液的pH____________ (填“升高” “不变”或“降低”)。 KOH CH3OH(或甲醇) 氧化 2.67 升高 123456789101112131415161718解析 (1)由电池反应可知,该电池的电解质是KOH。(2)放电时负极上CH3OH发生氧化反应,正极上O2发生还原反应。正极的电极反应为O2+2H2O+4e-═4OH-,负极的电极反应为CH3OH+8OH--6e-═ +6H2O。(3)根据负极的电极反应可得CH3OH~6e-,因此转移0.5 mol 电子时,消耗甲醇的质量约2.67 g。(4)根据放电时正极的电极反应可知,放电一段时间后,通入氧气的电极附近溶液的碱性增强,pH升高。12345678910111213141516171810.如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是( )A.电流由呼气所在的铂电极流出B.H+通过质子交换膜流向氧气所在的铂电极C.电路中流过2 mol电子时,消耗标准状况下O2 22.4 LD.该电池的负极反应为CH3CH2OH+3H2O-12e-═2CO2↑+12H+B123456789101112131415161718解析 呼气所在电极发生乙醇转化为醋酸的反应,故此电极为负极,而电流由正极流出,A项错误;H+通过质子交换膜流向正极(通入氧气的铂电极),B项正确;正极反应为O2+4e-+4H+═2H2O,电路中流过2 mol电子时,消耗0.5 mol O2,在标准状况下体积为11.2 L,C项错误;该电池的负极反应为CH3CH2OH+H2O-4e-═CH3COOH+4H+,D项错误。12345678910111213141516171811.以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示。下列说法不正确的是( )A.b电极为负极,发生氧化反应B.a电极的电极反应为N2+8H++6e-═2C.A溶液中所含溶质为NH4ClD.当反应消耗1 mol N2时,则消耗的H2为67.2 LD123456789101112131415161718解析 N2+3H2 2NH3,反应中氢元素的化合价升高,H2失去电子,因此b电极为负极,发生氧化反应,故A项正确;a电极为正极,电解质溶液含盐酸,因此电极反应为N2+8H++6e-═2 ,故B项正确;A溶液中所含溶质为NH4Cl,故C项正确;未告知温度和压强,不能确定H2的体积,故D项错误。12345678910111213141516171812.热激活电池可应用于特殊环境。一种热激活电池的工作原理如图所示,该电池的总反应为2Li+FeS2═Fe+Li2S2。下列说法正确的是( ) A.放电时Li+向a极移动B.正极的电极反应为FeS2+2e-═Fe+ C.电子由a电极经熔融介质流向b电极D.放电时,若有0.2 mol e-转移,则正极质量增加6.4 gB12345678910111213141516171812345678910111213141516171813.一种熔融碳酸盐燃料电池原理如图所示。下列有关该电池的说法正确的是( )D12345678910111213141516171812345678910111213141516171814.(2022湖南化学,8)海水电池在海洋能源领域备受关注,一种锂—海水电池构造示意图如下。下列说法错误的是( )A.海水起电解质溶液作用B.N极仅发生的电极反应:2H2O+2e-═2OH-+H2↑C.玻璃陶瓷具有传导离子和防水的功能D.该锂?海水电池属于一次电池B123456789101112131415161718解析 锂—海水电池的总反应为2Li+2H2O═2LiOH+H2↑,M极上Li失去电子发生氧化反应,则M电极为负极,电极反应为Li-e-═Li+,N极为正极,电极反应为2H2O+2e-═2OH-+H2↑,同时氧气也可以在N极得电子,电极反应为O2+4e-+2H2O═4OH-,故B错误;海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;该电池不可充电,属于一次电池,故D正确。12345678910111213141516171815.某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2下列推断中正确的是( )①放电时,Fe为正极,Ni2O3为负极 ②放电时,负极电极反应为Fe+2OH--2e-═Fe(OH)2 ③放电时,Ni2O3在正极反应 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中A.①②③ B.①②④ C.①③④ D.②③④D解析 放电时Fe被氧化,Ni2O3被还原,Fe作为负极,Ni2O3作为正极。放电时负极反应为Fe+2OH--2e-═Fe(OH)2,Ni2O3在正极上发生反应。由于放电时的产物均为碱性物质,故应用碱性电解质溶液。12345678910111213141516171816.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下。下列说法错误的是( )A.电极a为电池的负极B.电极b上发生的电极反应:O2+4H++4e-═2H2OC.电路中每通过4 mol电子,在正极消耗44.8 L H2SD.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区C123456789101112131415161718解析 根据燃料电池的特点分析,通氧气的一极为正极,故电极b为正极,电极a为负极,A正确;电极b为正极,氧气得电子结合H+生成水,B正确;从装置图可以看出,电池总反应为2H2S+O2═S2+2H2O,电路中每通过4 mol电子,正极应该消耗1 mol O2,负极应该有2 mol H2S反应,但是题目中没有说明是标准状况下,所以H2S的体积不一定是44.8 L,C错误;17 g H2S即0.5 mol H2S,每0.5 mol H2S参与反应会消耗0.25 mol O2,根据正极反应O2+4H++4e-═2H2O可知,有1 mol H+经质子膜进入正极区,D正确。12345678910111213141516171817.某新型可充电电池能长时间保持稳定的放电电压,该电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,电解质溶液为强碱溶液。(1)放电时负极反应为__________________________。 (2)放电时K2FeO4发生________________ (填“氧化”或“还原”)反应。 (3)放电时电子由_________ (填“正”或“负”,下同)极流向_________极。 (4)放电时1 mol K2FeO4发生反应,转移电子的物质的量为____________。Zn-2e-+2OH-═Zn(OH)2 还原 负 正 3 mol 解析 放电时锌在负极发生氧化反应,因为电解质是强碱,故负极反应是Zn-2e-+2OH-═Zn(OH)2。电子由负极流出,通过外电路流向正极,1 mol K2FeO4发生反应转移电子3 mol,放电时K2FeO4得电子发生还原反应。12345678910111213141516171818.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含的SO2快速启动,其装置示意图如图:①质子的流动方向为________________ (填“从A到B”或“从B到A”)。 ②负极的电极反应式为________________________________。 从A到B 123456789101112131415161718(2)NH3—O2燃料电池的结构如图所示: ①a极为电池的____________ (填“正”或“负”)极。 ②当生成1 mol N2时 ,电路中流过电子的物质的量为____________。 负 6 mol 123456789101112131415161718解析 (1)①根据题给图示,A为燃料电池的负极,B为燃料电池的正极,在原电池电解质溶液中,质子(H+)由负极向正极移动,即从A到B。(2)①a极通入氨气,是负极,b极通入氧气,是正极。②氨气中N元素的化合价由-3价变成0价,当生成1 mol N2时,转移电子的物质的量为6 mol。
相关资料
更多









