






化学第4节 金属的腐蚀与防护作业课件ppt
展开1.下列关于金属腐蚀的叙述正确的是( )A.金属被腐蚀的本质是M+nH2O═M(OH)n+B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D.常温下,置于空气中的金属主要发生化学腐蚀
解析 金属腐蚀包括化学腐蚀和电化学腐蚀,其本质为M-ne-═Mn+,A错误;镀锡铁镀层破损后Sn、Fe构成原电池,铁先被腐蚀,主要发生反应Fe-2e-═Fe2+,B错误;常温下,置于空气中的金属主要发生电化学腐蚀中的吸氧腐蚀,难以和非金属单质等反应发生化学腐蚀,C正确,D错误。
2.2024年的奥运会将在法国巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,以下说法不正确的是( )
A.连接铁片的铆钉应该用铜质的B.为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆C.巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈D.可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率
解析 连接铁片的铆钉若用铜质的,由于铁比铜的性质活泼,铜为原电池正极,铁为原电池负极,会导致铁制品本身被腐蚀,故A错误;在铁塔表面涂上一层特制的油漆,可以隔绝空气中的氧气,能有效保护金属,故B正确;潮湿环境比干燥环境更易引起钢铁的吸氧腐蚀,故C正确;在铁塔上镶嵌锌片,利用的是牺牲阳极保护法,铁为原电池的正极被保护,锌为原电池负极,因此能够减慢钢铁的腐蚀速率,故D正确。
3.(2023江苏南通高二期末统考)保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中不正确的是( )A.铁栅栏上涂上油漆B.铁闸与直流电源正极相连C.轮船底部焊接镁块D.家用铁锅水洗后及时擦干
解析 铁栅栏上涂上油漆可以防止铁与碳形成原电池,有利于减缓铁栅栏的腐蚀,保护方法正确,故A不符合题意;与直流电源正极相连的铁闸为电解池的阳极,会加快铁闸的腐蚀,保护方法不正确,故B符合题意;轮船底部焊接镁块,铁、镁在溶液中形成原电池,镁为原电池的负极被损耗,铁为正极被保护,保护方法正确,故C不符合题意;家用铁锅水洗后及时擦干可以防止铁与碳形成原电池,有利于减缓铁锅的腐蚀,保护方法正确,故D不符合题意。
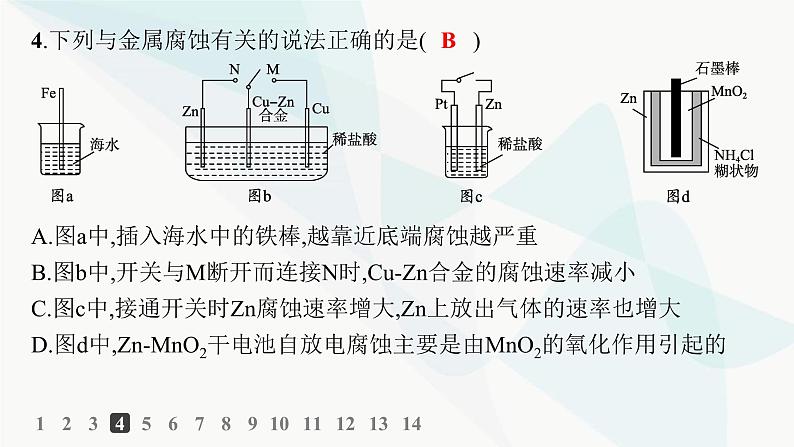
4.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图b中,开关与M断开而连接N时,Cu-Zn合金的腐蚀速率减小C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
解析 题图a中,液面处氧气的浓度大且与海水接触,故在液面处铁棒腐蚀最严重,A错误;题图b中,开关与M断开而连接N时,由于Zn比Cu活泼,Cu-Zn合金的腐蚀速率减小,B正确;题图c中,接通开关后,形成原电池,Zn腐蚀速率增大,H+在Pt电极上放电产生H2,C错误;题图d中,干电池自放电腐蚀是由NH4Cl产生的H+得电子引起的,D错误。
5.我国有多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应B.通电时,阴极上的电极反应为2H2O+2e-═H2↑+2OH-C.断电时,锌环上的电极反应为Zn2++2e-═ZnD.断电时,仍能防止铁帽被腐蚀
解析 锌环与电源的正极相连,为阳极,阴极水电离产生的H+放电生成H2,A、B均正确;断电时,Zn比铁活泼,为负极,电极反应为Zn-2e-═Zn2+,铁仍受到保护,C错误,D正确。
6.下列情形中,相同材质的铁最不易被腐蚀的是( )
解析 题图中的铁勺和铜盆以及食醋一同构成原电池,铁勺为原电池的负极,发生氧化反应,腐蚀较快,A项错误;铁为负极、合金中的碳等材料为正极,食盐水为电解质溶液,形成原电池,铁发生电化学腐蚀,B项错误;铁球表面有铜镀层,内部铁不与食盐水接触,可以起到防腐蚀的作用,C项正确;酸雨为电解质溶液,可以和金属铁反应,金属铁发生化学腐蚀,D项错误。
7.支撑海港码头基础的钢管桩,常用外加电流阴极保护法进行防腐,工作原理如图所示。其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面的腐蚀电流接近于零B.通电后,外电路电子从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为阳极材料被损耗和传递电流D.该保护装置属于电解池
解析 钢管桩作为被保护的阴极,外加电流使得其表面腐蚀发生的电子迁移得到抑制,使其表面腐蚀电流接近于零,从而避免或减弱腐蚀的发生,故A正确;高硅铸铁作为阳极,电子经导线流入电源正极,再从电源负极经导线流入阴极,即被保护的钢管桩,故B正确;高硅铸铁为惰性辅助阳极,不会损耗,而是由海水中的Cl-在阳极失去电子发生氧化反应,故C错误;用外加电流阴极保护法进行防腐,属于电解池装置,故D正确。
【易错提醒】解答本题应注意理解“高硅铸铁为惰性辅助阳极”,即相当于惰性电极,反应过程中高硅铸铁本身不发生反应,应该是海水中的Cl-放电发生氧化反应。
8.某城市为了减少钢管因锈蚀而造成的损失,拟用如图所示方法保护埋在酸性土壤中的钢管。下列有关说法正确的是( )
A.在潮湿的酸性土壤中钢管主要发生吸氧腐蚀B.在潮湿的酸性土壤中金属棒M中的电子通过导线流向钢管C.在潮湿的酸性土壤中H+向金属棒M移动,抑制H+与铁的反应D.钢管与金属棒M也可用导线分别连接直流电源正、负极以达到减缓腐蚀钢管的目的
解析 在酸性环境下,钢铁主要发生析氢腐蚀,A项错误;金属棒M、钢管在酸性土壤中形成原电池,其中金属棒M为负极,失去电子,失去的电子通过导线流向钢管,钢管为正极被保护,B项正确;在潮湿的酸性土壤中,存在大量H+,H+移动到正极上得电子被还原,即移动到钢管上得电子,抑制H+与铁的反应,C项错误;若钢管与金属棒M用导线分别连接直流电源正、负极,则钢管为阳极,使腐蚀速率加快,D项错误。
9.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了如下图所示的快速、易行的方法:
首先检查制取氧气的装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续加热3 min左右后,观察到的实验现象为:①直形管B中干燥的团状铁丝表面依然光亮,没有发生锈蚀;②直形管B中潮湿的团状铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状铁丝表面依然光亮。试回答下列问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同的类型,本实验中铁生锈属于___________ (填“化学腐蚀”或“电化学腐蚀”)。能表示其原理的电极反应为___________________________________________________。 (2)仪器A的名称为_____________,其中装的药品可以是_______________,其作用是________________。 (3)由实验可知,铁生锈的条件为_________________。决定铁生锈快慢的一个重要因素是_________________。
负极:2Fe-4e-═2Fe2+,正极:2H2O+O2+4e-═4OH-
碱石灰(或无水CaCl2)
解析 (1)根据题中环境可知铁的腐蚀属于电化学腐蚀。该过程中负极电极反应为2Fe-4e-═2Fe2+,正极电极反应为2H2O+O2+4e-═4OH-。(2)仪器A是球形干燥管,其中的药品干燥剂可以是碱石灰或无水CaCl2,作用是干燥O2。(3)根据实验可知,铁生锈的条件是必须与O2和水接触;且铁生锈的快慢取决于氧气浓度的大小。
10.下列关于装置图的说法正确的是( )
A.装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大B.装置①中K键闭合时,片刻后可观察到滤纸a附近变红色C.装置②中铁腐蚀的速率由大到小的顺序是只闭合K1>只闭合K3>只闭合K2>都断开D.装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025NA
解析 装置①K键闭合后,形成原电池,锌为负极,铜为正极,原电池中阴离子向负极移动,则Cl-向ZnSO4溶液移动,A项错误;装置①中K键闭合时,a极为阴极,阴极水电离产生的H+放电生成H2,同时生成OH-能使酚酞溶液变红,所以a附近变红色,B项正确;Fe为阳极被腐蚀,为阴极被保护,所以铁腐蚀的速率由大到小的顺序是只闭合K1>只闭合K3>都断开>只闭合K2,C项错误;装置③中铁制品上发生的反应为Cu2++2e-═Cu,析出1.6 g铜即0.025 ml 时,电源负极输出的电子数为0.05NA,D项错误。
11.一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法不正确的是( )
A.在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4H++4e-═2H2OB.在pH<4的溶液中,碳钢主要发生析氢腐蚀C.在pH>6的溶液中,碳钢主要发生吸氧腐蚀D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓
解析 pH>14的溶液为碱性,正极反应为O2+2H2O+4e-═4OH-,故A项错误; pH<4的溶液为酸性溶液,碳钢主要发生析氢腐蚀,正极反应为2H++2e-═H2↑,故B项正确;pH>6的溶液中,碳钢主要发生吸氧腐蚀,正极反应为O2+2H2O+4e-═4OH-,故C项正确;在碱性溶液中碳钢发生吸氧腐蚀,煮沸除氧气后,腐蚀速率会减慢,故D项错误。
12.利用如图装置,完成很多电化学实验。下列有关此装置的叙述正确的是( ) A.若X为镁棒,Y为NaCl溶液,开关K置于M处,铁表面因积累大量电子而被保护B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀C.若X为碳棒,开关K置于M处,与海水相比,当Y为河水时,Fe腐蚀快D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
解析 若X为镁棒,Y为NaCl溶液,开关K置于M处,则构成原电池,由于金属活动性:Mg>Fe,则Mg为负极,失去电子,被氧化变为金属阳离子进入溶液,电子由导线经外电路流向正极Fe,铁表面因积累大量电子而被保护,A正确;若X为碳棒,Y为NaCl溶液,开关K置于N处,装置为电解池,X为阳极,Fe棒为阴极,铁表面因积累大量电子而得到保护,B错误;若X为碳棒,开关K置于M处,当Y为河水或海水时,均构成原电池,Fe为负极,被腐蚀。由于河水中离子浓度比海水小,溶液导电能力弱,因此相对海水,Fe在河水中腐蚀要慢些,C错误;若X为铜棒,Y为硫酸铜溶液,开关K置于N处,装置为电解池,Cu为阳极,被氧化变为Cu2+进入溶液,在阴极Fe上,溶液中的Cu2+得到电子被还原,因此可用于铁表面镀铜,但溶液中Cu2+浓度不变,D错误。
13.某同学利用如图所示装置探究金属的腐蚀与防护条件{已知Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀}。
下列说法不合理的是( )A.①区Cu电极上产生气泡,Fe电极附近滴加K3[Fe(CN)6]溶液后出现蓝色沉淀,Fe被腐蚀B.②区Cu电极附近滴加酚酞后变成红色,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,Fe被腐蚀C.③区Zn电极的电极反应为Zn-2e-═Zn2+,Fe电极附近滴加K3[Fe(CN)6]溶液未出现蓝色沉淀,Fe被保护D.④区Zn电极的电极反应为2H2O+2e-═H2↑+2OH-,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,Fe被腐蚀
解析 ①区发生吸氧腐蚀,Cu为正极,电极反应为O2+2H2O+4e-═4OH-,Cu电极上不产生气泡,A项错误;②区Cu为阴极,电极反应为2H2O+2e-═ H2↑+2OH-,Cu电极附近溶液碱性增强,滴加酚酞后变成红色,Fe为阳极,被腐蚀,电极反应为Fe-2e-═Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,B项正确;③区Zn为负极,电极反应为Zn-2e-═Zn2+,Fe为正极,被保护,C项正确;④区Zn为阴极,电极反应为2H2O+2e-═H2↑+2OH-,Fe为阳极,被腐蚀,电极反应为Fe-2e-═Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,D项正确。
14.铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。(1)①某原电池装置如下图所示,右侧烧杯中的电极反应为_____________,左侧烧杯中的c(Cl-)____________(填“增大”“减小”或“不变”)。
2H++2e-═H2↑
②已知下列甲、乙两装置的总反应均为Fe+H2SO4═FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“石墨”)。
解析 ①原电池反应中Fe作为负极,石墨作为正极,右侧电极反应为2H++2e-═H2↑。由于平衡电荷的需要,盐桥中的Cl-向负极迁移,故NaCl溶液中c(Cl-)增大。②装置乙是电解装置,阴极(右侧)产生H2,同时根据总反应可知Fe只能作为阳极(左侧)。由已知条件知,在装置甲中,Fe作为原电池的负极,在左侧,石墨作原电池的正极,在右侧。
(2)下列丙图反应过程中,易生锈的是_____ (填“a”或“b”)点。丁图所示实验过程中可观察到的实验现象是_________________________________。
生铁屑表面生成红棕色锈斑,试管内液面上升
化学选择性必修1第4节 金属的腐蚀与防护多媒体教学课件ppt: 这是一份化学选择性必修1第4节 金属的腐蚀与防护多媒体教学课件ppt,共46页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,原电池,较活泼,失去电子,电化学腐蚀,电解池,答案B等内容,欢迎下载使用。
化学选择性必修1第4节 金属的腐蚀与防护教案配套课件ppt: 这是一份化学选择性必修1第4节 金属的腐蚀与防护教案配套课件ppt,共32页。PPT课件主要包含了目录索引,必备知识,自我检测,探究一金属的腐蚀等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护备课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护备课课件ppt,共37页。PPT课件主要包含了内容索引,知识铺垫,必备知识,自我检测,问题探究,归纳拓展,应用体验,答案B等内容,欢迎下载使用。













