






所属成套资源:全套鲁科版高中化学选择性必修1课时分层作业课件
鲁科版 (2019)选择性必修1第1节 化学反应的方向作业ppt课件
展开
这是一份鲁科版 (2019)选择性必修1第1节 化学反应的方向作业ppt课件,共34页。
1.运用“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成无污染的物质。下列对此反应的叙述中正确的是( )A.使用光催化剂不改变反应速率B.改变压强对反应速率无影响C.升高温度能加快反应速率D.该反应生成NO2和C,控制了大气污染
2.下列说法不正确的是( )A.具有较高能量的反应物分子称为活化分子B.升高温度增大了活化分子百分数C.催化剂能够改变化学反应的途径D.缩小体积增大压强能提高活化分子的浓度
解析 能量高不一定是活化分子;温度升高,可使一部分分子变成活化分子,增大了活化分子百分数;催化剂能降低反应所需的活化能,所以改变了化学反应途径;增大压强,体积缩小,所以提高了活化分子浓度但不会改变活化分子百分数。
3.决定化学反应速率的主要因素是( )①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质A.①②③④⑤ B.⑤C.①④D.①②③④
解析 决定化学反应速率的主要因素是反应物本身的性质,温度、压强、催化剂和浓度均为影响化学反应速率的外因,B正确。
4.研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是( )A.降低了反应的活化能B.减缓了反应的速率C.降低了反应的焓变D.增大了反应的平衡常数
解析 CuCl作为催化剂降低了反应的活化能,从而加快金属的腐蚀。
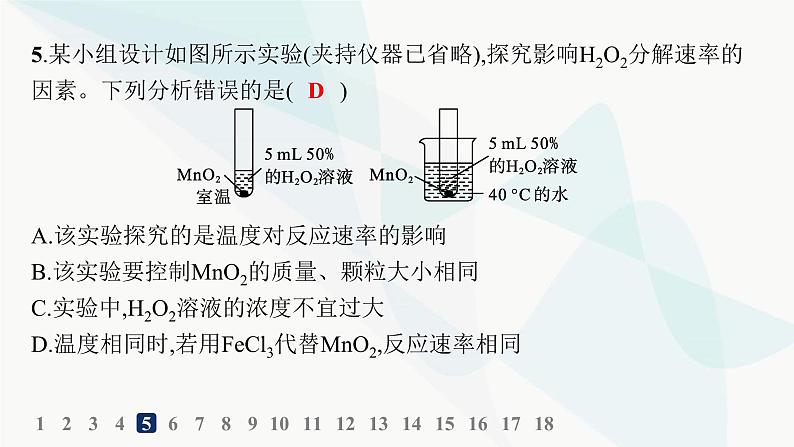
5.某小组设计如图所示实验(夹持仪器已省略),探究影响H2O2分解速率的因素。下列分析错误的是( )
A.该实验探究的是温度对反应速率的影响B.该实验要控制MnO2的质量、颗粒大小相同C.实验中,H2O2溶液的浓度不宜过大D.温度相同时,若用FeCl3代替MnO2,反应速率相同
解析 两个装置的温度不同,其他条件相同,所以该实验探究的是温度对反应速率的影响,A项正确;由于二氧化锰是催化剂,且探究的是温度对反应速率的影响,所以该实验要控制MnO2的质量、颗粒大小相同,B项正确;H2O2溶液的浓度过大,反应速率过快,不易控制,所以实验中H2O2溶液的浓度不宜过大,C项正确;温度相同时,若用FeCl3代替MnO2,则反应速率不同,D项错误。
6.(2023河北邯郸魏县五中高二期中)一定量的锌粉和6 ml·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸A.①②⑤B.①③⑤C.③④⑤D.①③④
解析 ①石墨、锌及盐酸可构成原电池,锌是负极,能加快反应速率,生成H2的总量不变,符合题意;②氧化铜溶于盐酸生成氯化铜,CuCl2和锌发生置换反应,生成铜,Zn、Cu与盐酸构成原电池,加快反应速率,但由于与盐酸反应的Zn减少,生成的氢气减少,不符合题意;③Zn、Cu与盐酸构成原电池,加快反应速率,生成H2的总量不变,符合题意;④铁能和盐酸反应产生氢气,产生H2总量增多,不符合题意;⑤增大氢离子浓度,反应速率增大,生成H2的总量不变,符合题意;答案选B。
7.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实: 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列叙述错误的是( )A.使用Cu-Zn-Fe催化剂可大大提高生产效率B.反应需在300 ℃下进行可推测该反应是吸热反应C.充入大量CO2气体可提高H2的转化率D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
解析 使用催化剂可加快反应速率,提高生产效率,A正确;只根据反应所需温度无法确定该反应是吸热反应还是放热反应,B错误;增大反应物CO2的浓度,可提高H2的转化率,C正确;从平衡混合气体中分离出CH3CH2OH和H2O,减小反应产物的浓度,可使平衡正向移动,提高CO2和H2的利用率,D正确。
8.在一定条件下,容积为2 L的密闭容器中,将2 ml L气体和3 ml M气体混合,发生如下反应:2L(g)+3M(g)═xQ(g)+3R(g),10 s末,生成2.4 ml R,并测得Q的浓度为0.4 ml·L-1。计算:(1)10 s末L的物质的量浓度为_____________。 (2)前10 s内用M表示的化学反应速率为_____________。 (3)化学方程式中x值为________。 (4)在恒温恒容条件下,往容器中加入1 ml氦气,反应速率________ (填“增大”“减小”或“不变”,下同)。 (5)在恒温恒压条件下,往容器中加入1 ml氦气,反应速率________。
0.2 ml·L-1
0.12 ml·L-1·s-1
解析 根据题给信息可得: 2L(g)+3M(g)═xQ(g)+3R(g)起始/ml23 0010 s末/ml0.40.6 0.82.4
(4)恒温、恒容条件下通入He,反应物和反应产物的浓度均不变,反应速率不变。(5)恒温、恒压条件下通入He,容器容积增大,反应物和反应产物的浓度减小,反应速率减小。
9.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH甲;丙、丁相比较,丁温度高,反应速率丁>丙;甲与丁相比较,甲反应物浓度大,反应速率甲>丁,故C项正确。
12.对于化学反应A(s)+aB(g) bC(g)在不同温度和压强(p1b ④ab,③正确;综上C项正确。
13.相同温度下,有容积相同的甲、乙两个恒容容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述中错误的是( )A.化学反应速率:乙>甲B.平衡后N2的浓度:乙>甲C.H2的平衡转化率:乙>甲D.平衡混合气体中H2的体积分数:乙>甲
解析 因为乙容器中的原料投入量正好是甲的2倍,故A项正确;假设开始时乙容器的容积也是甲的2倍(如图所示),则此时甲、乙两容器中达到的平衡是等效平衡。再将乙容器的容积压缩至与甲相等(如图中丙),则在此过程中化学平衡要向正反应方向移动,即N2、H2的平衡转化率增大,它们在平衡混合气体中的体积分数减小,故C项正确、D项错误;平衡后,丙中N2、H2、NH3的浓度分别比甲中N2、H2、NH3浓度大,但丙中N2、H2的浓度要分别小于甲中N2、H2浓度的2倍,而丙中NH3的浓度要大于甲中NH3浓度的2倍,B项正确。
14.如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2 ml SO2和1 ml O2,在一定条件下发生可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH1=-Q kJ·ml-1(Q>0),一段时间后活塞已保持静止,SO2的反应速率为v0。再往A内迅速充入2 ml SO2和1 ml O2,当活塞再次保持静止时,SO2的反应速率为v,在此过程中,下列说法正确的是( )
A.活塞先下移,后上移到原静止位置,v>v0B.活塞先下移,后上移但不到原静止位置,v>v0C.活塞先下移,后上移到原静止位置,v=v0D.活塞先下移,后上移但不到原静止位置,v=v0
解析 再往A内充入2 ml SO2和1 ml O2后,压强增大,先将弹簧压下,随着反应的进行,压强减小(平衡正向移动),弹簧又伸长,但最终压强比原来大,所以反应速率比原来大。
15.向某密闭容器中加入0.3 ml A、0.1 ml C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段为使用催化剂。下列说法正确的是( )
A.若t1=15,反应产物C在t0~t1时间段的反应速率为0.04 ml·L-1·s-1B.t4~t5阶段改变的条件为降低反应温度C.B的起始物质的量为0.02 mlD.t5~t6阶段可能是升高温度
16.如图表示25 ℃时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答下列问题:
(1)若反应中生成2 ml NH3,则反应______ (填“吸热”或“放热”) ______kJ。(2)图中曲线________ (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是___________________________________。
降低了合成氨反应的活化能
(3)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500 ℃,则曲线b对应的温度可能是________ (填字母)。
A.600 ℃B.550 ℃C.500 ℃D.450 ℃
解析 (1)由题图中能量状态可知N2(g)与3H2(g)具有的总能量高于2NH3(g)所具有的能量,故该反应为放热反应,并且反应N2(g)+3H2(g) 2NH3(g)每生成2 ml NH3放出热量(600-508) kJ=92 kJ。(2)合成氨反应中,加入铁触媒后,使反应的活化能降低,从而加快了反应速率,故曲线b代表加催化剂后的能量变化曲线。(3)对于合成氨反应,当其他条件不变时,升高温度,平衡向逆反应方向移动,平衡混合物中NH3的体积分数降低。题图中,当压强不变时,曲线b对应的温度下平衡混合物中NH3的体积分数大于曲线a对应的NH3的体积分数,所以曲线b对应的温度低于曲线a对应的温度。
17.反应2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7 g N2,放出166 kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2═N2+H2O2(慢) ②H2O2+H2═2H2O(快)T ℃时测得有关实验数据如下:
下列说法错误的是( )A.整个反应速率由第①步反应决定B.正反应的活化能一定是①②,B错误;比较实验Ⅰ、Ⅱ数据可知,NO浓度不变,实验Ⅱ氢气浓度增大一倍,反应速率增大一倍,比较实验Ⅲ、Ⅳ数据可知,H2浓度不变,实验Ⅳ中NO浓度增大一倍,反应速率增大四倍,据此得到速率方程:v=kc2(NO)·c(H2),依据实验Ⅰ中数据计算k=5 000,则题给反应的速率表达式为v=5 000 c2(NO)·c(H2),C正确;反应2NO(g)+2H2(g)═N2(g)+ 2H2O(g)中,每生成7 g N2放出166 kJ的热量,生成28 g N2应放热664 kJ,则热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g) ΔH=-664 kJ·ml-1,D正确。
18.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
(1)过氧化氢分解的化学方程式为________________________________。 (2)实验①的目的是________________________________。实验中滴加FeCl3溶液的目的是____________________________________________。 (3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______________________ (用实验中所提供的几种试剂)。
研究温度对H2O2分解速率的影响
加快H2O2分解速率,使实验现象易于观察
将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1 ml·L-1FeCl3溶液,观察产生气泡的速率
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是________。
相关课件
这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向评课课件ppt,共42页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。
这是一份高中化学第1节 化学反应的方向作业课件ppt,共36页。PPT课件主要包含了3mol,mol,CO2等内容,欢迎下载使用。
这是一份高中第1节 化学反应的方向作业ppt课件,共33页。PPT课件主要包含了OH-与H+结合,向右移动,逐渐变浅直至无色,BCE等内容,欢迎下载使用。










