





化学选择性必修1第二节 电解池作业课件ppt
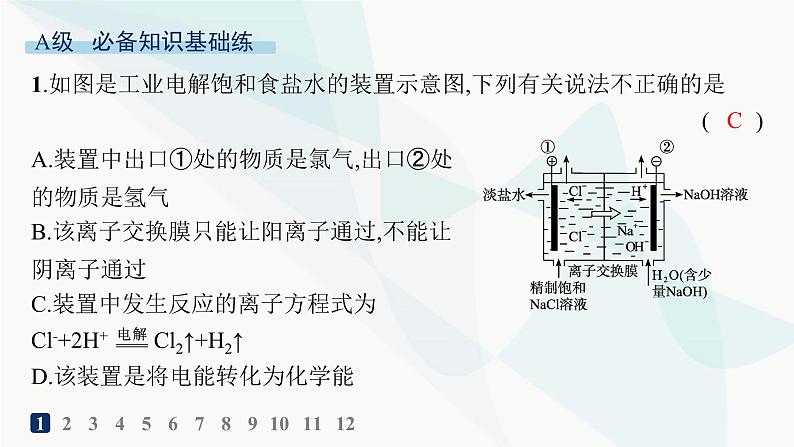
展开1.如图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是( )
A.装置中出口①处的物质是氯气,出口②处的物质是氢气B.该离子交换膜只能让阳离子通过,不能让阴离子通过C.装置中发生反应的离子方程式为Cl-+2H+ Cl2↑+H2↑D.该装置是将电能转化为化学能
解析 由题图看出①处为电解池的阳极产生氯气,②处为电解池的阴极产生氢气,A正确;该离子交换膜只能让阳离子通过,不能让阴离子通过,能防止氯气与碱反应,且在阴极区得到浓度较高的烧碱溶液,B正确;电解饱和食盐水的离子方程式应为2Cl-+2H2O H2↑+Cl2↑+2OH-,C错误;电解装置是将电能转化为化学能的装置,D正确。
2.用石墨棒作阳极、铁棒作阴极电解熔融的氯化钠,下列说法正确的是( )A.石墨棒周围有大量的Na+B.铁棒质量增加C.电子通过熔融电解质由石墨棒流向铁棒D.阴极发生氧化反应
解析 阴离子移向阳极(石墨棒),发生氧化反应2Cl--2e-===Cl2↑,阳离子移向阴极,发生还原反应2Na++2e-===2Na,A、D项错误,B项正确;电子不能通过熔融电解质,熔融电解质是由于其内部自由移动的离子定向移动而导电的,C项错误。
3.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )A.a为正极,b为负极;消毒液主要成分为NaClO和NaClB.a为负极,b为正极;消毒液主要成分为NaClO和NaClC.a为阳极,b为阴极;消毒液主要成分为HClO和NaClD.a为阴极,b为阳极;消毒液主要成分为HClO和NaCl
解析 制取消毒液的有关反应有2NaCl+2H2O 2NaOH+H2↑+Cl2↑,Cl2+2NaOH===NaCl+NaClO+H2O,因阳极生成Cl2,阴极生成NaOH,为使二者充分反应,Cl2应在下端产生,从而推知电源b为正极,a为负极,消毒液的主要成分是NaClO和NaCl。
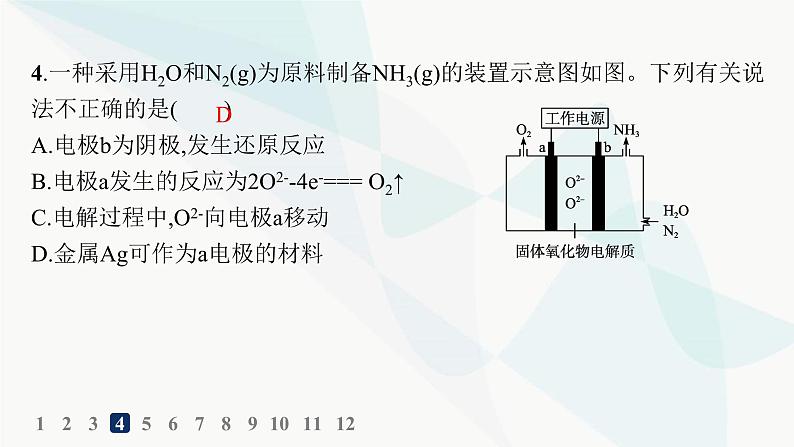
4.一种采用H2O和N2(g)为原料制备NH3(g)的装置示意图如图。下列有关说法不正确的是( )A.电极b为阴极,发生还原反应B.电极a发生的反应为2O2--4e-=== O2↑C.电解过程中,O2-向电极a移动D.金属Ag可作为a电极的材料
解析 a电极上O2-失去电子生成O2,电极反应为2O2--4e-===O2↑,a电极为阳极,故B正确;b电极为阴极,b电极上N2和H2O反应生成NH3,电极反应为N2+3H2O+6e-===2NH3+3O2-,N2得到电子被还原,故A正确;固体氧化物电解质中的O2-移向a电极,故C正确;a为阳极,电解池中若用Ag作阳极,则电极自身失去电子,故不能用金属Ag作为a电极的材料,故D错误。
5.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )A.通电后,Ag+向阳极移动B.银片与电源负极相连C.该电解池的阴极反应可表示为Ag++e-=== AgD.当电镀一段时间后,将电源反接,铜牌一定能恢复如初
解析 铜牌上镀银,银片为阳极,Ag+向阴极移动,阴极反应为Ag++e-===Ag。将电源反接,开始时铜牌表面的Ag溶解,当反应一段时间,内部的Cu暴露出来后,则阳极上Cu溶解,因此铜牌不可能恢复如初。
6.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )A.电解时以纯铜作阳极B.电解时阴极发生氧化反应C.粗铜连接电源负极,其电极反应是Cu-2e-=== Cu2+D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
解析 电解精炼铜时,粗铜应作阳极,纯铜作阴极,故A错误;阳极与电池的正极相连,发生氧化反应,阴极与电池的负极相连,发生还原反应,故B错误;粗铜连接电源的正极,发生氧化反应,故C错误;金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,因此Ag、Pt不会放电,以单质形式在阳极附近沉积下来,故D正确。
7.化学研究人员开发出一种生产石灰乳的绿色工艺,其装置如图所示。装置工作时,下列说法错误的是( )A.该装置中电能转变为化学能B.X膜为阴离子交换膜C.阴极区溶液的pH不断变大D.a极上的电极反应为2H2O-4e-=== 4H++O2↑
解析 该装置是电解池,将电能转变为化学能,A项正确;根据图中信息,a极为阳极,电极反应为2H2O-4e-===4H++O2↑,产生的H+可溶解碳酸钙,生成的Ca2+向中间移动,则X膜为阳离子交换膜,B项错误,D项正确;b极为阴极,电极反应为2H2O+2e-===H2↑+2OH-,阴极区OH-不断向中间移动,水中H+不断被消耗,溶液的pH变大,C项正确。
8.在水中加入等物质的量的Ag+、Pb2+、Na+、 、Cl-,将该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为( )A.35.5∶108B.16∶207C.8∶1D.108∶35.5
解析 加入等物质的量的Ag+、Pb2+、Na+、 、Cl-,将有氯化银、硫酸铅沉淀生成,此时所得的溶液为硝酸钠溶液。电解该溶液的实质是电解水,阳极发生氧化反应得到氧气,电极反应为2H2O-4e-===O2↑+4H+,阴极发生还原反应得到氢气,电极反应为2H2O+2e-===H2↑+2OH-,根据电子守恒得氧化产物(O2)与还原产物(H2)的物质的量之比为1∶2,则质量比为8∶1,C项正确。
9.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阴极上析出红色固体B.装置②的待镀铁制品应与电源正极相连C.装置③闭合电键后,外电路电子由b极流向a极D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
解析 装置①中阳极上Cl-放电生成Cl2,阴极Cu2+放电生成Cu,故A正确;装置②是电镀装置,待镀铁制品作阴极,应与电源负极相连,故B错误;装置③闭合电键后,a极是负极,因此外电路电子由a极流向b极,故C错误;装置④的离子交换膜只允许阳离子自由通过,故D错误。
10.在如图串联装置中,通电片刻后发现乙装置左侧Pt电极表面出现红色固体,则下列说法不正确的是( )
A.丙中Ag电极连接的是电源的正极B.向乙中加入适量的Cu(OH)2固体,一定能使溶液恢复到电解前的状态C.电解过程中丙中c(Ag+)无变化D.标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量可能增加21.6 g
解析 由题干信息可知,通电片刻后即发现乙装置左侧电极表面出现红色固体,即乙池中左侧电极为阴极,电极反应为Cu2++2e-===Cu,乙池中右侧电极为阳极,电极反应为2H2O-4e-===4H++O2↑,甲池中左侧电极为阴极,电极反应为2H2O+2e-===H2↑+2OH-,右侧电极为阳极,电极反应为2Cl--2e-===Cl2↑,丙池中左侧Cu电极为阴极,电极反应为Ag++e-Ag,右侧Ag电极为阳极,电极反应为Ag-e-===Ag+,Ag电极连接的是电源的正极,A正确;乙池是用惰性电极电解CuSO4溶液,当CuSO4溶液没有被完全电解时,加入CuO可以使溶液恢复到电解前的状态,B错误;丙池为电镀池,电解过程中丙中AgNO3溶液的浓度保持不变,c(Ag+)无变化,C正确;标准状况下当甲中产生4.48 L气体时,
=0.1 ml,转移电子的物质的量为0.2 ml,根据电极反应式,丙中Cu电极质量增加0.2 ml×108 g·ml-1=21.6 g,D正确。
11.用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是( )
A.电解过程中,Ca2+向阳极移动B.阳极的电极反应为C+2O2--4e-=== CO2↑C.在制备金属钛前后,整套装置中CaO的总量减小D.若用铅酸蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
解析 根据电解原理,阳离子向阴极移动,阴离子向阳极移动,故A错误;根据装置示意图,阳极上石墨失去电子转化成CO2,电极反应为C+2O2--4e-===CO2↑,故B正确;阴极的电极反应为Ca2++2e-===Ca,然后用Ca还原TiO2,反应的化学方程式为2Ca+TiO2===Ti+2CaO,因此整套装置中CaO的总量不变,故C错误;铅酸蓄电池中Pb作负极,PbO2作正极,因此“+”接线柱连接的是PbO2电极,故D错误。
12.如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙装置中溶液的体积和浓度都相同(假设通电前、后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F电极附近呈红色。
请回答:(1)B极是电源的 ,一段时间后,甲装置中溶液颜色 ,丁装置中X电极附近的颜色逐渐变浅,Y电极附近的颜色逐渐变深,这表明 ,在电场作用下向Y电极移动。 (2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。 (3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。常温下,当乙装置中溶液的pH是13时(此时乙溶液体积为500 mL),丙装置中镀件上析出银的质量为 ,甲装置中
氢氧化铁胶体粒子带正电荷
溶液的pH (填“变大”“变小”或“不变”)。 (4)若将C电极换为铁,其他装置都不变,则甲装置中发生的总反应的离子方程式是 。
Fe+Cu2+ Cu+Fe2+
化学选择性必修1第二节 电解池集体备课课件ppt: 这是一份化学选择性必修1第二节 电解池集体备课课件ppt,共4页。PPT课件主要包含了第二节电解池,新课情景呈现,课前素能奠基,饱和氯化钠溶液,氢气和氯气,抗腐蚀,CuSO4,硫酸铜溶液,金属离子,活泼金属等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池课文课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池课文课件ppt,共59页。PPT课件主要包含了课前·基础认知,课堂·重难突破,随堂训练,放出气体溶液变红,试纸变蓝等内容,欢迎下载使用。
高中人教版 (2019)第二节 电解池背景图课件ppt: 这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













