



还剩19页未读,
继续阅读
所属成套资源:全套人教版高中化学选择性必修1教学课件
成套系列资料,整套一键下载
人教版高中化学选择性必修1第3章微专题3pH的计算课件
展开
这是一份人教版高中化学选择性必修1第3章微专题3pH的计算课件,共27页。
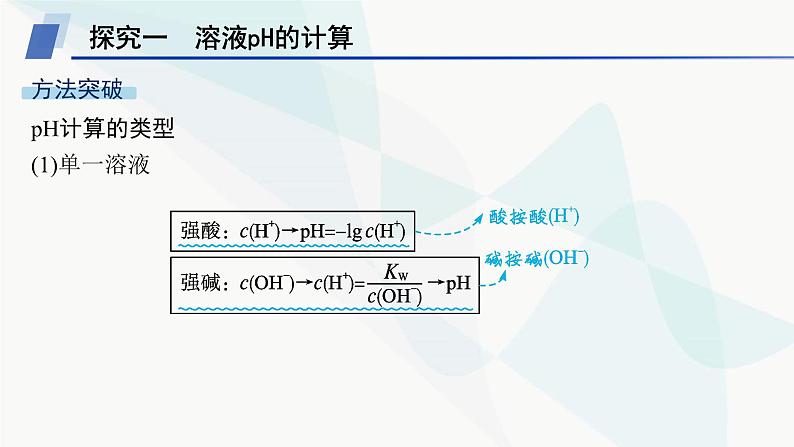
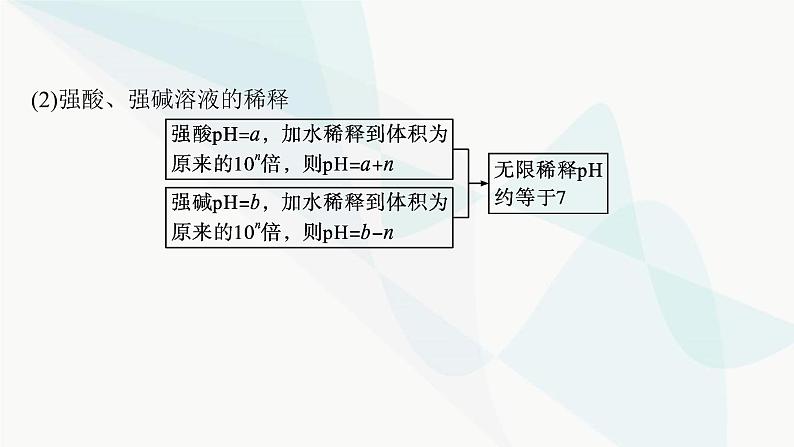
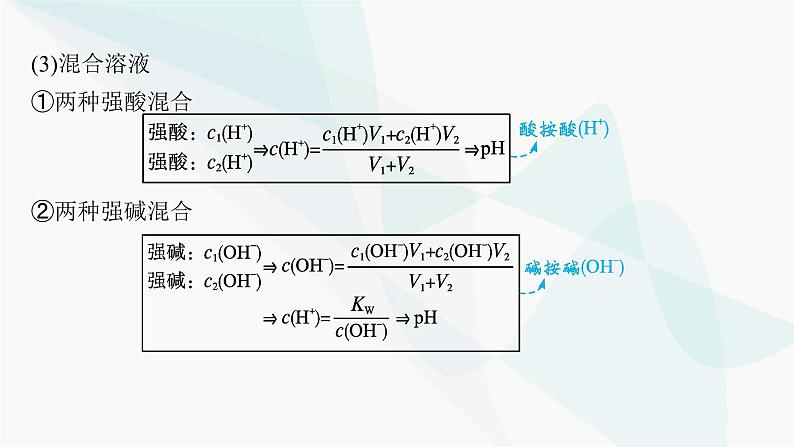
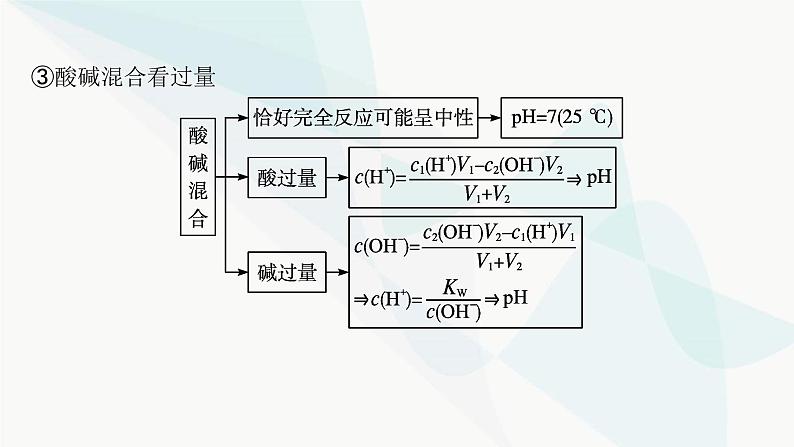
第三章 微专题3 pH的计算探究一 溶液pH的计算pH计算的类型(1)单一溶液(2)强酸、强碱溶液的稀释 (3)混合溶液①两种强酸混合②两种强碱混合 ③酸碱混合看过量 (4)计算溶液pH的口诀酸按酸(H+)——酸性溶液先计算混合后的c(H+)。碱按碱(OH-)——碱性溶液先计算混合后的c(OH-)。同强相混弱点三——即25 ℃时两强酸溶液等体积混合:pH=pH小+0.3;两强碱溶液等体积混合:pH=pH大-0.3。异强相混看过量——强酸强碱混合先判断过量。无限稀释“7”为限——酸、碱无限稀释,最终溶液都接近中性。名师点拨 计算溶液pH时注意的几个问题(1)外界条件是否为25 ℃。(2)水电离出来的c(H+)何时忽略不计,何时不能忽略。(3)两种pH不同的碱溶液混合时,若两碱溶液中水的电离程度不同,则混合后溶液中水的电离平衡必发生移动,因此不可将两溶液中H+的物质的量相加作为混合溶液中H+的物质的量。视角1溶液稀释的计算1.将pH=5的H2SO4溶液加水稀释到体积为原来的500倍,则稀释后溶液中B归纳总结 ①溶液稀释过程中,溶质的物质的量不变,因此存在计算公式c1V1=c2V2。②本题中pH=5的硫酸稀释到体积为原来的500倍后,硫酸电离出的H+浓度为2×10-8 mol·L-1,已经小于纯水中H+浓度10-7 mol·L-1,该情况下水电离出的H+已经不能忽略,因此H+浓度近似等于水电离出的H+浓度。视角2两种碱溶液混合的计算2.在常温下,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH最接近( )A.8+lg 2 B.9-lg 2C.9 D.10-lg 2D解析 两种碱溶液混合,混合后溶液中c(OH-)接近0.5×10-4 mol·L-1,故c(H+)会接近2×10-10 mol·L-1,pH=10-lg 2,故答案选D。视角3酸碱溶液混合的计算3.将0.1 mol·L-1 HCl溶液和0.06 mol·L-1的Ba(OH)2溶液等体积混合后,则该溶液的pH是( )A.1.7 B.12.3 C.12 D.1C解析 强酸和强碱溶液混合,要先判断混合后溶液的酸碱性。酸中c(H+)=0.1 mol·L-1,碱中c(OH-)=0.12 mol·L-1,等体积混合后碱过量,混合溶液中4.已知某温度下纯水的pH=6。(1)该温度下pH=7的溶液呈 (填“酸性”“中性”或“碱性”)。 (2)该温度下,0.1 mol·L-1的盐酸的pH= 。 (3)该温度下,0.05 mol·L-1的Ba(OH)2溶液的pH= 。 (4)该温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= 。 碱性 1119∶11 解析 根据题意可知,该温度下,KW=c(H+)·c(OH-)=10-12。(1)pH=7时,c(H+)=10-7 mol·L-1,c(OH-)=10-5 mol·L-1,c(H+)7B.若10x=y,且a+b=13,则pH=7C.若ax=by,且a+b=13,则pH=7D.若x=10y,且a+b=14,则pH>7D 视角2酸碱混合后溶液酸碱性的判断2.在室温下,等体积的酸和碱的溶液混合后,pH一定大于7的是( )A.pH=3的硝酸跟pH=11的氢氧化钾溶液B.pH=3的盐酸跟pH=11的氨水C.pH=3的硫酸跟pH=11的氢氧化钠溶液D.pH=3的磷酸跟pH=11的氢氧化钾溶液B解析 A、C两项中都是强酸与强碱中和,等体积混合时酸溶液中H+的物质的量和碱溶液中OH-的物质的量相等,即pH(强酸)+pH(强碱)=14,二者恰好完全中和,混合溶液pH=7;B项,pH(强酸)+pH(弱碱)=14,由于是弱碱,则混合后碱过量,pH>7;D项,pH(弱酸)+pH(强碱)=14,由于是弱酸,则混合后酸过量,pH<7。探究三 溶液稀释后pH的变化规律1.pH相等的强酸、弱酸(或强碱、弱碱)的稀释规律 2.浓度相等的强酸、弱酸(或强碱、弱碱)的稀释规律 视角1酸碱溶液稀释的图像考查 1.将pH=13的两种碱M、N的溶液各10 mL分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )A.若a=12时,M为强碱B.若M、N都是弱碱,则a大于12,且N的碱性弱于MC.稀释后M的溶液中水的电离程度比N的溶液中大D.向稀释后的两种碱溶液加同浓度的盐酸至完全中和,消耗盐酸的体积V(M)>V(N)D 解析 将pH=13的碱溶液稀释到体积为原来的10倍,若pH变为12,则说明M为强碱,N为弱碱,故A正确;若M、N都是弱碱,稀释到体积为原来的10倍,由于稀释过程中弱碱要不断电离,导致OH-的浓度大于原来的 ,则a大于12,碱性越弱,稀释相同倍数,pH变化越小,M的碱性比N强,故B正确;稀释后,M溶液中c(OH-)小,对水的抑制程度小,则M溶液中水的电离程度大,故C正确;pH=13的M、N两种碱的溶液,M的碱性比N强,则N的浓度大于M,体积相同时,N的物质的量大于M,所以N消耗同浓度的盐酸多,故D错误。2.常温下,pH均为2、体积均为V0的HA、HB、HC三种酸溶液,分别加水稀释至体积为V,溶液pH随 的变化关系如图所示,下列叙述错误的是( ) A.常温下:Ka(HB)>Ka(HA) C.酸的物质的量浓度:b点Ka(HA),A项正确;弱电解质的电离是吸热过程,温度升高,平衡向电离的方向移动。当 =4时,给三种酸溶液同时升高到相同温度,HC溶液中c(C-)不变,HA溶液中c(A-)增大,则 减小,B项正确;三种酸的酸性HC>HB>HA,起始溶液pH相等,则三种酸的起始浓度HA>HB>HC,则加水稀释相同倍数时a点HA的浓度比b点的HB浓度大,C项正确;b点和c点的pH相同,对水电离的抑制作用相同,D项错误。视角2酸碱溶液稀释规律的考查3.常温下,现有体积均为1 L、pH均为3的盐酸和醋酸,下列说法正确的是( )A.分别与1 L pH=11氢氧化钠溶液混合,混合液的pH:盐酸>醋酸B.分别加水稀释到10 L后溶液的pH均变为4C.分别中和等物质的量的氢氧化钠,消耗酸的体积:盐酸<醋酸D.等体积的两种酸溶液分别与足量的锌粒反应,产生气体的体积相等A解析 向1 L pH=11的氢氧化钠溶液中加入1 L pH为3的盐酸,二者恰好完全中和,溶液呈中性;向1 L pH=11的氢氧化钠溶液中加入1 L pH为3的醋酸,醋酸过量,溶液呈酸性;因此混合溶液的pH:盐酸>醋酸,A项正确。盐酸加水稀释到10 L时,pH增大1;醋酸加水稀释到10 L过程中,原来未电离的醋酸继续电离出H+,使得醋酸中H+的浓度下降程度比盐酸小,所以醋酸稀释后pH小于4,B项错误;pH均为3的盐酸和醋酸溶液比较,醋酸的浓度比盐酸大,中和等物质的量的氢氧化钠,则消耗酸的体积:盐酸>醋酸,C项错误;pH均为3的盐酸和醋酸溶液比较,醋酸的浓度比盐酸大,醋酸所含溶质的物质的量大,与足量的锌反应,醋酸得到的氢气多,D项错误。
第三章 微专题3 pH的计算探究一 溶液pH的计算pH计算的类型(1)单一溶液(2)强酸、强碱溶液的稀释 (3)混合溶液①两种强酸混合②两种强碱混合 ③酸碱混合看过量 (4)计算溶液pH的口诀酸按酸(H+)——酸性溶液先计算混合后的c(H+)。碱按碱(OH-)——碱性溶液先计算混合后的c(OH-)。同强相混弱点三——即25 ℃时两强酸溶液等体积混合:pH=pH小+0.3;两强碱溶液等体积混合:pH=pH大-0.3。异强相混看过量——强酸强碱混合先判断过量。无限稀释“7”为限——酸、碱无限稀释,最终溶液都接近中性。名师点拨 计算溶液pH时注意的几个问题(1)外界条件是否为25 ℃。(2)水电离出来的c(H+)何时忽略不计,何时不能忽略。(3)两种pH不同的碱溶液混合时,若两碱溶液中水的电离程度不同,则混合后溶液中水的电离平衡必发生移动,因此不可将两溶液中H+的物质的量相加作为混合溶液中H+的物质的量。视角1溶液稀释的计算1.将pH=5的H2SO4溶液加水稀释到体积为原来的500倍,则稀释后溶液中B归纳总结 ①溶液稀释过程中,溶质的物质的量不变,因此存在计算公式c1V1=c2V2。②本题中pH=5的硫酸稀释到体积为原来的500倍后,硫酸电离出的H+浓度为2×10-8 mol·L-1,已经小于纯水中H+浓度10-7 mol·L-1,该情况下水电离出的H+已经不能忽略,因此H+浓度近似等于水电离出的H+浓度。视角2两种碱溶液混合的计算2.在常温下,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH最接近( )A.8+lg 2 B.9-lg 2C.9 D.10-lg 2D解析 两种碱溶液混合,混合后溶液中c(OH-)接近0.5×10-4 mol·L-1,故c(H+)会接近2×10-10 mol·L-1,pH=10-lg 2,故答案选D。视角3酸碱溶液混合的计算3.将0.1 mol·L-1 HCl溶液和0.06 mol·L-1的Ba(OH)2溶液等体积混合后,则该溶液的pH是( )A.1.7 B.12.3 C.12 D.1C解析 强酸和强碱溶液混合,要先判断混合后溶液的酸碱性。酸中c(H+)=0.1 mol·L-1,碱中c(OH-)=0.12 mol·L-1,等体积混合后碱过量,混合溶液中4.已知某温度下纯水的pH=6。(1)该温度下pH=7的溶液呈 (填“酸性”“中性”或“碱性”)。 (2)该温度下,0.1 mol·L-1的盐酸的pH= 。 (3)该温度下,0.05 mol·L-1的Ba(OH)2溶液的pH= 。 (4)该温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= 。 碱性 1119∶11 解析 根据题意可知,该温度下,KW=c(H+)·c(OH-)=10-12。(1)pH=7时,c(H+)=10-7 mol·L-1,c(OH-)=10-5 mol·L-1,c(H+)
相关资料
更多









