





人教版 (2019)选择性必修2第二节 分子的空间结构作业ppt课件
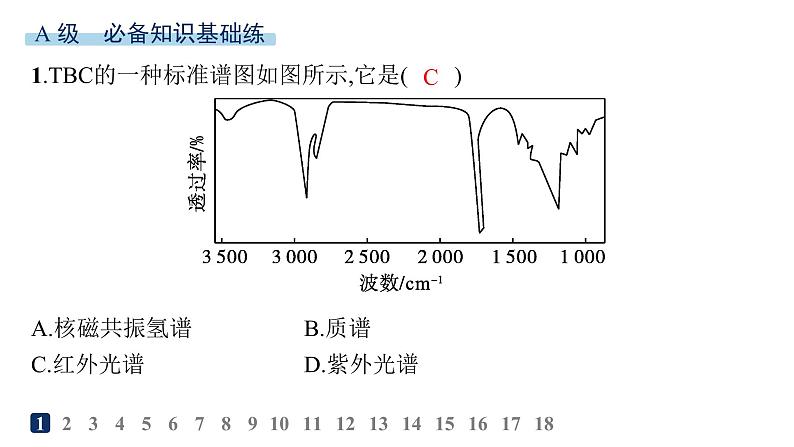
展开1.TBC的一种标准谱图如图所示,它是( )A.核磁共振氢谱B.质谱C.红外光谱D.紫外光谱
2.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室,使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到 ……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能是( )A.CH3OHD.CH4
3.下列有关价层电子对互斥理论的描述正确的是( )A.价层电子对就是σ键电子对B.孤电子对数由分子式来确定C.分子的空间结构是价层电子对互斥的结果D.孤电子对数等于π键数
解析 价层电子对数是σ键电子对数与中心原子上的孤电子对数之和,中心原子上的孤电子对数是指没有成键的价电子对数,其与中心原子价层电子总数、与中心原子结合的原子最多能接受的电子数及与中心原子结合的原子数有关,A、B、D项错误。
4.下列分子中键角最大的是( )A.H2OD.NH3
解析 H2O分子空间结构为V形,键角为105°;CO2分子空间结构为直线形,键角为180°;CH2O分子空间结构为平面三角形,键角约为120°;NH3分子空间结构为三角锥形,键角为107°。
5.用价层电子对互斥模型推测SO3的空间结构为( )A.正四面体形B.V形C.三角锥形D.平面三角形
解析 SO3分子的中心原子S的价层电子对数=3+ ×(6-3×2)=3,故VSEPR模型为平面三角形结构;由于S原子上没有孤电子对,故SO3分子为平面三角形结构。
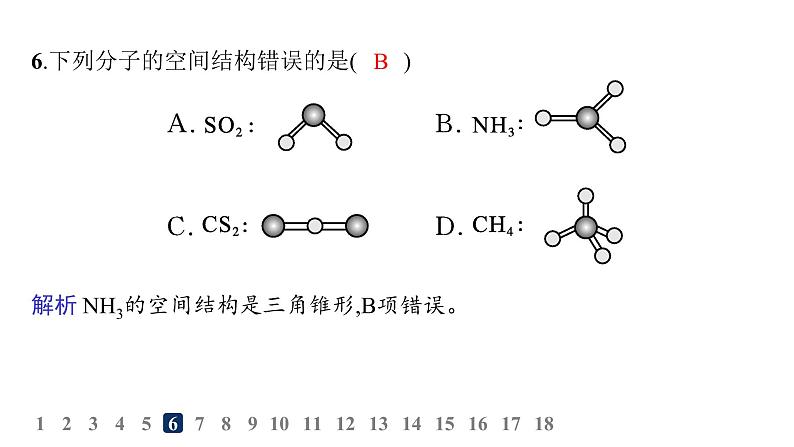
6.下列分子的空间结构错误的是( )
解析 NH3的空间结构是三角锥形,B项错误。
7.下列分子或离子中中心原子未用来成键的电子对最多的是( )
解析 中各原子的最外层电子全部参与成键,NH3中N原子的最外层上有1对电子未参与成键,H2O中O原子上有2对电子未参与成键,BCl3的中心原子为B原子,其最外层电子全部参与成键。
A.a=8 x=3 b=2B.a=6 x=3 b=2C.a=4 x=2 b=3D.a=6 x=2 b=3
9.下列叙述正确的是( )A.CH4中C—H间的键角为109°28',NH3中N—H间的键角为107°,H2O中O—H间的键角为105°,说明孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力
10.(1)在BBr3分子中,Br—B—Br的键角是 。 (2)羰基硫(COS)与CO2的结构相似,羰基硫(COS)分子的结构式为 ;光气(COCl2)各原子最外层都满足8电子稳定结构,则光气分子的空间结构为 (用文字描述)。
(5)用价层电子对互斥模型推断SnBr2分子中Sn—Br的键角 (填“>”“<”或“=”)120°。
答案 (1)120° (2)O═C═S 平面三角形(3)V形(4)平面三角形 (合理即可)(5)<解析 (1)BBr3分子中B的价层电子对数为3,没有孤电子对,所以空间结构为平面三角形,Br—B—Br的键角是120°。(2)羰基硫(COS)与CO2的结构相似,故羰基硫(COS)结构式为O═C═S;光气分子的结构式为 ,碳原子有3个σ键,没有孤电子对,故COCl2为平面三角形。
11.在白磷分子(P4)中,四个P原子分别处于正四面体的四个顶点上,结合有关P原子的成键特点,下列有关白磷分子的说法正确的是( )A.白磷分子中的键角为109°28'B.1个分子中共有4对共用电子对C.白磷分子中的键角为60°D.1个分子中有6个孤电子对
解析 根据共价键的方向性和饱和性,每个磷原子都以3个共价键与其他3个磷原子结合,从而形成正四面体结构,所以键角为60°,分子中共有6个共价单键(即6对共用电子对),4个孤电子对。
12.下列分子或离子的中心原子上带有一个孤电子对的是( )
A.①②③⑤⑥⑦B.③⑦⑧C.④⑥⑧D.③⑤
解析 根据孤电子对数= (a-xb),可以计算出各微粒中心原子上的孤电子对数分别为0、0、1、0、1、2、0、0,故含有一个孤电子对的是③⑤。
13.下列微粒的中心原子,有两个孤电子对的是( )A.H2SD.CN-
解析 H2S分子中中心原子上有两个孤电子对,BeCl2分子中中心原子上没有孤电子对,NH3和CN-中中心原子上有一个孤电子对。
14.H2O2的结构式为H—O—O—H,下列有关H2O2分子的说法不正确的是( )A.不是直线形分子B.是三角锥形分子C.H2O2分子中的1个氧原子有2个孤电子对D.氧原子的价层电子对数为4
解析 H2O2中的每个氧原子有6个价电子,形成了2个σ键,故还有4个电子没有成键,孤电子对数为2,价层电子对数为4,C项、D项正确;以氧为中心的三个原子呈V形结构,H2O2中相当于有两个V形结构,故不可能是直线形或三角锥形分子,A项正确、B项错误。
15.实验测得BH3为平面三角形(键角均为120°),NH3为三角锥形(键角为107°),推断:①甲基,②甲基碳正离子( ),③甲基碳负离子( )的键角相对大小顺序为( )A.②>①>③B.①>②>③C.③>①>②D.①=②=③
解析 ①甲基(—CH3)含有3个σ键,1个孤电子,VSEPR模型为正四面体,粒子空间结构为三角锥形结构,由于孤电子的影响小于孤电子对,故键角大于107°小于120°;
16.下列说法正确的是( )A.NCl3分子中N原子不满足8电子稳定结构B.P4和CH4都是正四面体结构且键角都为109°28'
D.NH3分子中有1个孤电子对,它对成键电子对的排斥作用较强
17.(1)利用VSEPR模型推测下列物质的分子或离子的空间结构:
AlBr3(共价分子) 。 (2)有两种活性反应中间体,它们的粒子中均含有1个碳原子和3个氢原子,依据图中给出的这两种粒子的球棍模型,写出这两种活性反应中间体的相应化学式:
(3)按要求写出由第二周期非金属元素的原子构成的中性分子的化学式。平面形分子: ; 三角锥形分子: ; 四面体形分子: 。 (4)SO2Cl2和SO2F2都属于AXmEn型分子,S与O之间以双键结合,S与Cl、S与F之间以单键结合。请你预测SO2Cl2和SO2F2分子的空间结构: ,SO2Cl2分子中∠Cl—S—Cl (选填“<”“>”或“=”)SO2F2分子中∠F—S—F。 (5)O3分子的空间结构为 。
18.硼砂有广泛的用途,可用作清洁剂、化妆品、杀虫剂,也可用于配制缓冲溶液和制取其他硼化合物等。市售硼砂往往已经部分风化。硼砂毒性较高,世界各国多禁用其作食品添加物。人体若摄入过多的硼,会引发多脏器的蓄积性中毒。硼砂是含结晶水的四硼酸钠,以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据模型回答有关问题:
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中的2号硼原子的价层电子对数为 ,m= (填数字)。 (2)硼可以与氮形成BN,其中B的化合价为 ,请解释原因: 。(3)BF3和过量NaF作用可生成NaBF4, 的空间结构为 ;NaBF4的电子式为 。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构备课ppt课件,共60页。PPT课件主要包含了分子结构的测定,化学性质,红外光谱,晶体X射线衍射,振动频率,吸收峰,化学键,应用体验,直线形,四原子分子等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件,共44页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子的空间结构教案配套课件ppt: 这是一份人教版 (2019)选择性必修2第二节 分子的空间结构教案配套课件ppt,文件包含人教版高中化学选择性必修2第2章第2节基础课时6分子结构的测定多样的分子空间结构价层电子对互斥模型课件ppt、人教版高中化学选择性必修2第2章第2节基础课时6分子结构的测定多样的分子空间结构价层电子对互斥模型学案doc等2份课件配套教学资源,其中PPT共47页, 欢迎下载使用。













