




人教版 (2019)选择性必修2第一节 共价键说课ppt课件
展开
这是一份人教版 (2019)选择性必修2第一节 共价键说课ppt课件,共31页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
1.了解共价键参数的含义,知道共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构,培养证据推理与模型认知的化学核心素养。2.通过认识键参数对物质性质的影响,探析微观结构对宏观性质的影响。
基础落实·必备知识全过关
重难探究·能力素养全提升
298.15 K、101 kPa
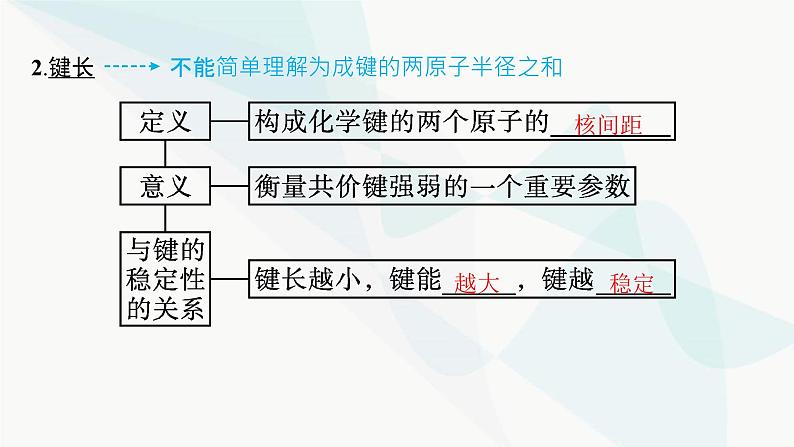
2.键长 不能简单理解为成键的两原子半径之和
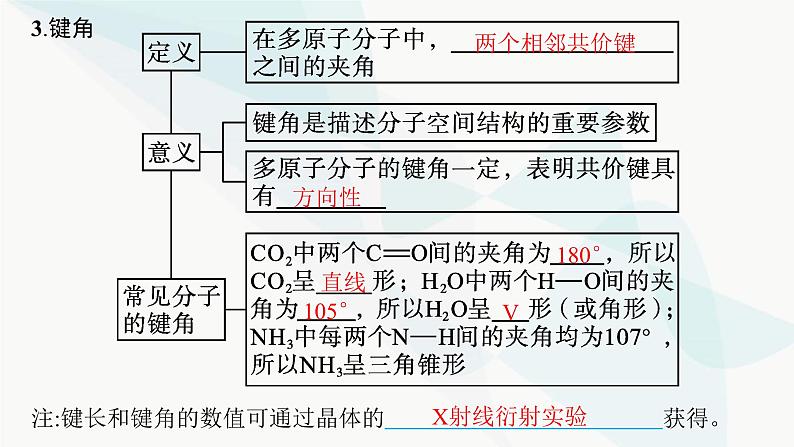
注:键长和键角的数值可通过晶体的 获得。
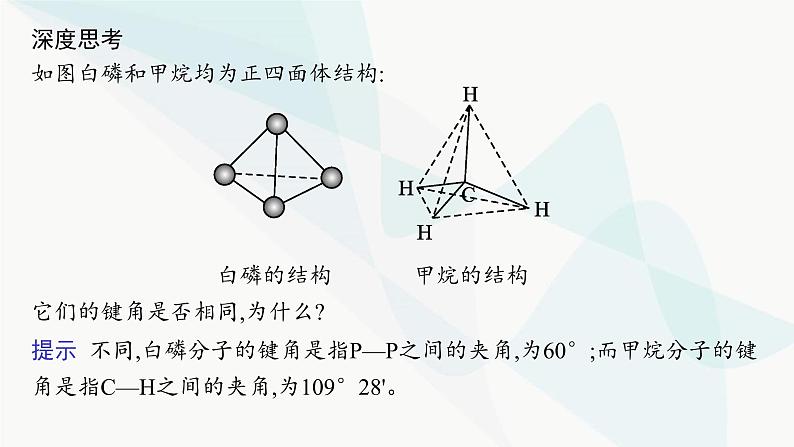
深度思考如图白磷和甲烷均为正四面体结构:
白磷的结构 甲烷的结构它们的键角是否相同,为什么?
提示 不同,白磷分子的键角是指P—P之间的夹角,为60°;而甲烷分子的键角是指C—H之间的夹角,为109°28'。
易错辨析(1)在分子中,两个成键的原子间的距离叫键长。( )(2)双原子分子中化学键键长越长,分子越稳定。( )(3)O—H的键能是指在298.15 K、101 kPa下,1 ml气态分子中1 ml O—H解离成气态原子所吸收的能量。( )(4)C═C的键能等于C—C的键能的2倍。( )(5)多原子分子的键角是一定的,表明共价键具有方向性。( )
探究 探究键能与键长的关系及其对物质性质的影响
键能与键长是衡量共价键稳定性的参数,键长和键角是描述分子空间结构的参数。一般来说,如果知道分子中的键长和键角,这个分子的空间结构就确定了。已知部分键能、键长数据如下表所示:
分析比较回答下列问题:(1)HF、HCl、HBr、HI的键长大小关系是什么?结构相似物质的键长与键能、物质稳定性的关系是什么?
(2)一般来说,键长越小,键能越大。但F—F键长比Cl—Cl键长小,而F—F键能却比Cl—Cl键能小,为什么?
提示 键长大小关系为HFF—F,故A错误;键能越大,共价键越稳定,因此表中最稳定的共价键是H—F,故B错误;原子半径:I>Br>Cl,再结合表中数据得到E(H—Br)介于E(H—I)和E(H—Cl)之间,即431.8 kJ·ml-1>E(H—Br)>298.7 kJ·ml-1,故C正确;键能越大,分子越稳定,因此表中键能数据可以说明热稳定性的强弱顺序为HF>HCl>HI,故D错误。
易错警示 一般情况下,原子半径越小,键长越短,键能越大,但是也存在特殊情况,所以解题时除了要依据普遍性结论,还要注意结合题目中的数据进行判断。
3.用“>”或“ > ②> (2)①> ②双键键长>三键键长。
视角2键参数对物质性质的影响4.下列事实不能用键能的大小来解释的是( )A.N2的化学性质很稳定B.稀有气体一般难发生反应C.HF、HCl、HBr、HI的稳定性逐渐减弱D.F2比O2更容易与H2反应
解析 由于N2分子中存在N≡N,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I原子半径逐渐增大,其氢化物分子中的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱;由于H—F的键能大于H—O的键能,所以更容易生成HF。
5.有关碳和硅的共价键键能如下表所示:
简要分析和解释下列有关事实。(1)比较通常条件下,CH4和SiH4的稳定性强弱: 。 (2)硅与碳同族,硅元素也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。 (3)SiH4的稳定性小于CH4,硅更易生成氧化物,原因是 。
答案 (1)CH4比SiH4稳定(2)C—C和C—H键能较大,所形成的烷烃较稳定,而硅烷中Si—Si和Si—H的键能较小,易断裂,导致长链硅烷难以生成(3)C—H的键能大于C—O,C—H比C—O稳定,而Si—H的键能却远小于Si—O的,所以Si—H不稳定而倾向于形成稳定性更强的Si—O解析 (1)因为C—H的键能大于Si—H的键能,所以CH4比SiH4稳定。(2)C—C和C—H的键能比Si—Si和Si—H的键能都大,因此烷烃比较稳定,而硅烷中Si—Si和Si—H的键能较小,易断裂,导致长链硅烷难以生成。(3)C—H的键能大于C—O,C—H比C—O稳定,而Si—H的键能却远小于Si—O的,所以Si倾向于形成稳定性更强的Si—O。
6.[2021河北卷]已知有关氮、磷的单键和三键的键能如下表:
从能量角度看,氮以N2而白磷以P4(结构式可表示为 )形式存在的原因是 。
答案 1个N≡N的键能大于3个N—N的键能之和,而6个P—P的键能之和大于2个P≡P的键能之和解析 根据题给键能数据,可知1个N≡N的键能大于3个N—N的键能之和,因此氮以N2形式存在,而6个P—P的键能之和大于2个P≡P的键能之和,因此白磷以P4形式存在。
【变式设问】(1)元素的非金属性N>P,为什么N2的化学性质非常稳定,而白磷P4的化学性质非常活泼。请分析原因。
(2)根据元素周期律可知,NH3的稳定性强于PH3,你能利用键参数进行解释吗?
提示 N2分子中存在N≡N,该键键能大,破坏该共价键需要很大的能量;而P4分子中的P—P的键能较小,破坏该共价键所需能量较小。
提示 N原子的半径比P原子的半径小,故键长N—H比P—H小,则N—H的键能比P—H的键能大,N—H更难被破坏,NH3更稳定。
相关课件
这是一份高中第二章 分子结构与性质第一节 共价键课文配套ppt课件,共38页。PPT课件主要包含了第一节共价键,mol,kJ·mol-1,反应物,生成物,正误判断,深度思考,应用体验,kJmol,键长和键角等内容,欢迎下载使用。
这是一份化学第一节 共价键作业ppt课件,共26页。
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键优秀习题课件ppt,共26页。PPT课件主要包含了kJ•mol-1,平均值,键能的应用,根据原子半径判断,键长判断方法,断共价键的稳定性,判断分子的空间结构等内容,欢迎下载使用。









