

所属成套资源:高考化学一轮复习讲练卷 (含解析)
高考化学一轮复习讲练 第7章 专题突破26 化学反应原理在物质制备中的调控作用 (含解析)
展开
这是一份高考化学一轮复习讲练 第7章 专题突破26 化学反应原理在物质制备中的调控作用 (含解析),共4页。试卷主要包含了化学反应方向的判定,控制反应条件的目的,控制反应条件的基本措施等内容,欢迎下载使用。
专题突破26 化学反应原理在物质制备中的调控作用1.化学反应方向的判定(1)自发反应在一定条件下无需外界帮助就能自发进行的反应称为自发反应。(2)熵和熵变的含义①熵的含义熵是衡量一个体系混乱度的物理量。用符号S表示。同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是S(g)>S(l)>S(s)。②熵变的含义熵变是反应前后体系熵的变化,用ΔS表示,化学反应的ΔS越大,越有利于反应自发进行。(3)判断化学反应方向的判据ΔG=ΔH-TΔSΔG<0时,反应能自发进行;ΔG=0时,反应达到平衡状态;ΔG>0时,反应不能自发进行。2.控制反应条件的目的(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应速率,提高反应物的转化率,从而促进有利的化学反应进行。(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。3.控制反应条件的基本措施(1)控制化学反应速率的措施通过改变反应体系的温度、溶液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化剂等途径调控反应速率。(2)提高转化率的措施通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。如:以工业合成氨为例,理解运用化学反应原理选择化工生产中的适宜条件①反应原理:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。② ③从反应快慢和反应限度两个角度选择反应条件
③从反应快慢和反应限度两个角度选择反应条件 ④综合考虑——选择适宜的生产条件a.温度:400~500 ℃b.压强:10~30 MPac.投料比:=d.以铁触媒作催化剂e.采用循环操作提高原料利用率
④综合考虑——选择适宜的生产条件a.温度:400~500 ℃b.压强:10~30 MPac.投料比:=d.以铁触媒作催化剂e.采用循环操作提高原料利用率![]() 1.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)下列叙述错误的是( )A.使用Cu—Zn—Fe催化剂可大大提高生产效率B.升高温度,该反应平衡常数K一定增大C.充入大量CO2气体可提高H2的转化率D.从平衡混合气体中分离出CH3CH2OH和H2O,可提高CO2和H2的利用率答案 B解析 因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故A正确;反应需在300 ℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,所以K不一定增大,故B错误;充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C正确;从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D正确。2.(2020·武汉高三模拟)化学反应原理在科研和生产中有广泛应用。(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0(Ⅰ)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________(填“>”“<”或“=”)T2。上述反应体系中循环使用的物质是________。
1.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)下列叙述错误的是( )A.使用Cu—Zn—Fe催化剂可大大提高生产效率B.升高温度,该反应平衡常数K一定增大C.充入大量CO2气体可提高H2的转化率D.从平衡混合气体中分离出CH3CH2OH和H2O,可提高CO2和H2的利用率答案 B解析 因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故A正确;反应需在300 ℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,所以K不一定增大,故B错误;充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C正确;从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D正确。2.(2020·武汉高三模拟)化学反应原理在科研和生产中有广泛应用。(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0(Ⅰ)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________(填“>”“<”或“=”)T2。上述反应体系中循环使用的物质是________。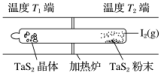 (2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是_______________________。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是_______________________。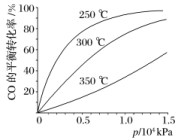 答案 (1)< I2(2)< 在1.3×104 kPa下,CO的转化率已较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失解析 (1)由题意知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2===TaI4+S2,②TaI4+S2===TaS2+2I2,即反应(Ⅰ)先在温度T2端正向进行,后在温度T1端逆向进行,反应(Ⅰ)的ΔH大于0,因此温度T1小于T2,该过程中循环使用的物质是I2。(2)从图像来看,随着温度的升高,CO的转化率变小,则ΔH<0,综合温度、压强对CO转化率的影响来看,在题给压强下,CO的转化率已经很大,不必再增大压强。3.苯乙烯(
答案 (1)< I2(2)< 在1.3×104 kPa下,CO的转化率已较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失解析 (1)由题意知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2===TaI4+S2,②TaI4+S2===TaS2+2I2,即反应(Ⅰ)先在温度T2端正向进行,后在温度T1端逆向进行,反应(Ⅰ)的ΔH大于0,因此温度T1小于T2,该过程中循环使用的物质是I2。(2)从图像来看,随着温度的升高,CO的转化率变小,则ΔH<0,综合温度、压强对CO转化率的影响来看,在题给压强下,CO的转化率已经很大,不必再增大压强。3.苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:![]()
![]() ==CH2(g)+H2(g) ΔH=+123.5 kJ·mol-1。工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1∶10,N2不参与反应),控制反应温度为600 ℃,并保持体系总压为0.1 MPa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图为
==CH2(g)+H2(g) ΔH=+123.5 kJ·mol-1。工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1∶10,N2不参与反应),控制反应温度为600 ℃,并保持体系总压为0.1 MPa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图为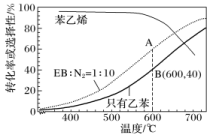 (1)A、B两点对应的正反应速率较大的是________。(2)掺入N2能提高乙苯的平衡转化率,解释说明该事实________________________________________________________________________。(3)用平衡分压代替平衡浓度计算600 ℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)(4)控制反应温度为600 ℃的理由是_________________________________________。答案 (1)B (2)正反应方向气体分子数增加,加入氮气稀释,相当于减压 (3)0.019 (4)600 ℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大解析 (1)由图可知,A、B两点对应的温度和压强都相同,A点是乙苯和氮气的混合气体,B点是纯乙苯,则B点乙苯浓度大于A点,浓度越大反应速率越大,则正反应速率B点大于A点。(2)该反应正反应气体分子数增加,加入氮气稀释,相当于减压,减小压强,化学平衡正向移动,乙苯的转化率增大。(3)由图可知,反应温度为600 ℃,并保持体系总压为0.1 MPa时,乙苯转化率为40%,设乙苯起始物质的量为1 mol,则依据题意可建立如下三段式:
(1)A、B两点对应的正反应速率较大的是________。(2)掺入N2能提高乙苯的平衡转化率,解释说明该事实________________________________________________________________________。(3)用平衡分压代替平衡浓度计算600 ℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)(4)控制反应温度为600 ℃的理由是_________________________________________。答案 (1)B (2)正反应方向气体分子数增加,加入氮气稀释,相当于减压 (3)0.019 (4)600 ℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大解析 (1)由图可知,A、B两点对应的温度和压强都相同,A点是乙苯和氮气的混合气体,B点是纯乙苯,则B点乙苯浓度大于A点,浓度越大反应速率越大,则正反应速率B点大于A点。(2)该反应正反应气体分子数增加,加入氮气稀释,相当于减压,减小压强,化学平衡正向移动,乙苯的转化率增大。(3)由图可知,反应温度为600 ℃,并保持体系总压为0.1 MPa时,乙苯转化率为40%,设乙苯起始物质的量为1 mol,则依据题意可建立如下三段式: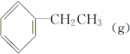
![]() ==CH2(g)+H2(g)起始量/mol 1 0 0变化量/mol 0.4 0.4 0.4平衡量/mol 0.6 0.4 0.4平衡时总物质的量为1.4 mol,乙苯的平衡分压为×0.1 MPa,苯乙烯和氢气的平衡分压为×0.1 MPa,则600 ℃时的平衡常数Kp=≈0.019。
==CH2(g)+H2(g)起始量/mol 1 0 0变化量/mol 0.4 0.4 0.4平衡量/mol 0.6 0.4 0.4平衡时总物质的量为1.4 mol,乙苯的平衡分压为×0.1 MPa,苯乙烯和氢气的平衡分压为×0.1 MPa,则600 ℃时的平衡常数Kp=≈0.019。
相关试卷
这是一份新高考化学一轮复习考点过关练习第29练 化学反应的调控(含解析),共14页。试卷主要包含了合成氨反应中催化剂的作用是,不符合工业合成氨生产实际的是,下图为工业合成氨的流程图等内容,欢迎下载使用。
这是一份2022年高考化学一轮复习讲义第7章第36讲 微专题19 化学反应速率、平衡原理在物质制备中的调控作用 (含解析),共6页。试卷主要包含了化学反应方向的判定,控制反应条件的目的,控制反应条件的基本措施等内容,欢迎下载使用。
这是一份高考化学一轮复习第7章化学反应速率和化学平衡第4讲化学反应原理在物质制备中的调控作用训练含解析,共5页。








