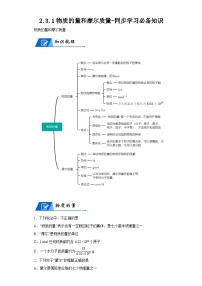
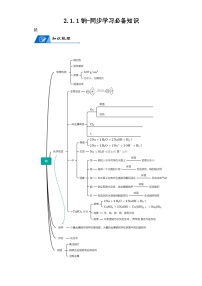
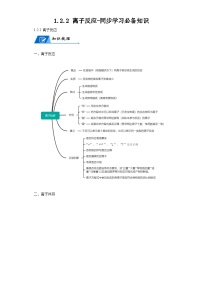
人教版 (2019)必修 第一册第三节 物质的量学案
展开2.3.3物质的量浓度和配制溶液-同步学习必备知识
物质的量浓度和配制溶液
例题1、
1.下列各溶液中,Cl-浓度最大的是
A.0.5L 0.2mol/L的NaCl溶液
B.0.1L 0.3mol/L的NaCl溶液
C.0.5L 0.3mol/L的FeCl3溶液
D.0.1L 0.4mol/L的MgCl2溶液
例题2、
2.下列说法中,正确的是
A.标准状况下,1.0 mol SO2体积约为22.4 L
B.63g HNO3含有的原子总数约为6.02×1023
C.标准状况下,18 g H2O的体积约为22.4 L
D.0.1 mol/L MgCl2溶液中含有0.2 mol Cl-
例题3、
3.从1L 1mol/L HCl溶液中取出200mL,下列叙述不正确的是
A.物质的量浓度为0.2 mol/L
B.含溶质的物质的量为0.2mol
C.含溶质7.3g
D.与1L 0.2 mol/L NaOH溶液恰好中和
随练1、
4.1mol/L H2SO4的含义是
A.1L水中溶解1mol H2SO4
B.1L溶液中含有1molH+
C.将98g H2SO4溶于1L水中配成溶液
D.1L H2SO4溶液中含有98g H2SO4
随练2、
5.下列有关500mL0.2mol/LBaCl2溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2mol/L
B.500mL溶液中Ba2+离子浓度为0.2mol/L
C.500mL溶液中Cl-离子总数为0.2NA
D.该溶液中Cl-离子浓度与0.4mol·L-1的KCl溶液中Cl-离子浓度相同
随练3、
6.下列物质所含分子数最多的是
A.10000亿个水分子 B.3.6g水
C.标况下6.72L CO D.500mL 1mol/L蔗糖溶液
随练4、
7.填空:
(1)标准状况下,44.8LCO2的物质的量为__________________;
(2)2molH+含有_________个H+;
(3)1molH2O的质量为______________;
(4)将20gNaOH溶于水配成500mL溶液,该溶液中溶质的物质的量浓度为_________;
(5)同温、同压下,等体积的N2和O2的质量比为________。
例题1、
8.将60mL 0.25mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为
A.0.3mol/L B.0.03mol/L C.0.05mol/L D.0.04mol/L
例题2、
9.将cmol/L的AlCl3溶液V1mL加水稀释至V2mL,稀释后溶液中Cl―物质的量浓度为
A. B.
C. D.
例题3、
10.溶液中含a克,若把此溶液取一半加水稀释至2VmL,则稀释后溶液中的物质的量浓度为
A. B. C. D.
例题4、
11.现有浓度为2 mol/L的HCl溶液VL,欲使其浓度变为4 mol/L,下列方法可行的是( )
A.通入标准状况下的HCl气体44.8 L
B.将溶液加热蒸发浓缩至0.5V L
C.加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D.蒸发掉0.5 L水
随练1、
12.将4gNaOH固体完全溶解在水里,配成100mL溶液,从中取出10mL,加水稀释至50mL,所得溶液的物质的量浓度是
A.1mol/L B.0.1 mol/L C.0.2 mol/L D.0.02 mol/L
随练2、
13.将5mol/L的溶液a mL稀释至b mL,稀释后溶液中的物质的量浓度为
A. B. C. D.
随练3、
14.关于溶液稀释,下列说法正确的是
A.稀释过程中,离子的浓度不变 B.稀释过程中,溶液的物质的量不变
C.稀释过程中,溶质的质量及物质的量不变 D.稀释过程中,溶液的密度不变
例题1、
15.将标准状况下的气体溶于水中,得到的盐酸密度为,则该盐酸的物质的量浓度是
A. B. C. D.
例题2、
16.在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R结晶水合物Wg,从原饱和溶液中析出溶质R的质量为
A.(W-B)g B.(W-B)g C.(W-B) D.(W-B)g
随练1、
17.下列关于物质的量浓度表述正确的是
A.0.2mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D.10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
例题1、
18.配制溶液的操作如下所示。下列说法不正确的是
A.操作1前称取的质量为4.0g
B.操作2前溶液需恢复至室温
C.操作3和操作4分别为洗涤和定容
D.操作5后液面下降,需补充少量水至刻度线
例题2、
19.下面仪器中,不是配制一定物质的量浓度的溶液所需的仪器是( )
A.容量瓶 B.漏斗 C.玻璃棒 D.滴管
随练1、
20.配制100mL0.10mol·L-1的NaCl溶液,下列仪器中不必使用的是( )
A. B. C. D.
随练2、
21.下列关于容量瓶使用方法的叙述中,正确的是
①加水定容时,不小心超过刻度线,用滴管吸出多余液体;②容量瓶用蒸馏水洗净后残留少量水即使用;③在容量瓶中溶解固体溶质;④溶液需冷却至室温方可注入容量瓶;⑤使用容量瓶前要检查是否漏水;
A.①②③ B.①③④ C.③④⑤ D.②④⑤
随练3、
22.回答下列问题
(1)标况下11.2L CH4的质量是_______g,其中含有H数目为_______个。
(2)实验室需要配制0.2mol/L NaOH溶液500mL。
①实验室用到的玻璃仪器有_______。
A.500mL容量瓶 B.烧杯
C.胶头滴管 D.酒精灯
②计算。配制该溶液需取NaOH晶体_______g。
③称量。如图的称量装置有两处错误,分别是_______、_______。
④溶解、冷却。该步实验中需要使用玻璃棒,目的是_______。
⑤转移、洗涤。在转移时应使用_______引流;需要洗涤烧杯2~3次是为了_______。
⑥定容、摇匀。
⑦将配好的溶液静置一段时间后倒入指定的试剂瓶,并贴好标签,注明配制德溶液名称及浓度。
⑧在配制过程中,某同学观察定溶液面情况如图所示,所配溶液的浓度会_______(填“偏高”、“偏低”、“无影响”)。
例题1、
23.配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
A.溶解后溶液尚未冷却就转移至容量瓶中
B.转移溶液后未洗涤烧杯和玻璃棒
C.在容量瓶中定容时仰视刻度线
D.倒转摇匀后,发现液面低于刻度,再补水至刻度线
例题2、
24.实验室配制100mL0.5mol/LNa2SO4溶液。
(1)用托盘天平称量,需要称取Na2SO4固体的质量为____g。
(2)实验过程中需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和____。
(3)实验过程中其它操作均正确,只是定容时不小心加水超过了刻度线,则配制的Na2SO4溶液实际浓度比目标浓度(填“偏大”或“偏小”)_____。
(4)写出Na2SO4在水中的电离方程式_____。
(5)取出配制准确的该溶液50mL,将其稀释到500mL,此时溶液中Na+的物质的量浓度____mol/L。
例题3、
25.现用18.4 mol/L的浓来配制500 mL 0.2 mol/L的稀。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀时不需要使用的有________________(填代号),还缺少的仪器是________________。
(2)经计算,需浓的体积为________,量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)配制一定物质的量浓度NaOH溶液的实验中,如果出现以下操作:
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.定容时仰视刻度线 D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯 F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后液面不到刻度线,未加水至刻度线。
H.未冷却至室温就进行定容 I.定容时有少量水洒在容量瓶外
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有_________;偏小的有__。
随练1、
26.实验室现需配制物质的量浓度为1mol•L﹣1的NaOH溶液480mL。下列操作会使所配制溶液浓度偏大的。
A.溶解固体溶质时,未冷却至室温即转入容量瓶进行定容
B.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时观察液面仰视
随练2、
27.实验室用2.0mol/L NaCl溶液配制100mL 0.50mol/L NaCl溶液。
请回答下列问题。
(1)配制上述溶液,需要2.0mol/L NaCl溶液_______mL。
(2)容量瓶上标有_______。(填序号)
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
(3)下列主要操作步骤的正确顺序是_______。(填序号)
①量取一定体积的氯化钠溶液,放入烧杯中,用适量蒸馏水稀释;
②向容量瓶中加水至液面离容量瓶刻度线下1~2cm,改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③将溶液转移到100mL容量瓶中;
④盖好瓶塞,反复翻转,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)配制过程中出现以下情况,使所配溶液浓度偏高的是_______。
A.没有洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线
C.转移时,因操作不当使部分NaCl溶液溅出瓶外
D.定容时溶液凹液面低于容量瓶刻度线
例题1、
28.在K2SO4和Al2(SO4)3的混合溶液中,已知Al3+的浓度为0.2mol·L-1,SO的浓度为0.4mol·L-1,则该溶液中的K+浓度为
A.0.1mol·L-1 B.0.2mol·L-1
C.0.3mol·L-1 D.0.4mol·L-1
例题2、
29.某溶液中仅含有Ca2+、和M三种离子(水的电离忽略不计),三者物质的量之比为3︰5︰1,则M可能是
A.Cl﹣ B.SO C.Na+ D.H+
例题3、
30.有关物质的量的浓度说法错误的是
A.物质的量浓度为溶液中所含的物质的量是
B.溶液中含有
C.水中溶解了后,所得溶液的浓度为
D.从的硫酸溶液中取出,剩余溶液的浓度为
例题4、
31.已知25%的氨水的密度为ρ1g/cm3,5%的氨水的密度为ρ2g/ cm3,ρ1<ρ2,若将上述两种溶液等体积混合,所得氨水的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
随练1、
32.密度为1.45g·cm-3的硫酸溶液中,逐滴加入BaCl2溶液,至沉淀完全为止,生成沉淀的质量与原硫酸溶液的质量相等。则原硫酸溶液的浓度为
A.14.8mol·L-1 B.10.2mol·L-1
C.6.22mol·L-1 D.无法计算
随练2、
33.某溶液中含有Al3+、Mg2+、H+、SO已知溶液中SO的物质的量浓度为3mol•L-1,若溶液中的阳离子浓度均相同,则c(Al3+)为
A.2mol•L-1 B.1mol•L-1
C.3mol•L-1 D.1.5mol•L-1
随练3、
34.在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为ρ g•cm-1,该盐酸物质的量浓度、溶质的质量分数分别为
A.、 B.、
C.、 D.、
随练4、
35.下列关于物质的量浓度表述正确的是
A.0.2mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D.10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
人教版 (2019)选择性必修1第三节 盐类的水解学案设计: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解学案设计,文件包含思维导图人教版高中化学选修一《332溶液中离子浓度大小的比较》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修一《332溶液中离子浓度大小的比较》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共16页, 欢迎下载使用。
化学第三节 化学键导学案: 这是一份化学第三节 化学键导学案,文件包含思维导图人教版高中化学必修一《43化学键》同步学习思维导图+学练解析版docx、思维导图人教版高中化学必修一《43化学键》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共44页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量学案: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量学案,文件包含思维导图人教版高中化学必修一《322物质的量在化学方程式中的计算》同步学习思维导图+学练解析版docx、思维导图人教版高中化学必修一《322物质的量在化学方程式中的计算》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。