



高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体导学案及答案
展开3.2.1 分子晶体-同步学习必备知识
3.2.1 分子晶体
【典型例题】
1.下列说法中,错误的是
A.只含分子的晶体一定是分子晶体
B.碘晶体升华时破坏了共价键
C.几乎所有的酸都属于分子晶体
D.稀有气体中只含原子,但稀有气体的晶体属于分子晶体
2.二茂铁是一种具有芳香族性质的有机金属化合物,熔点为172℃,沸点249℃,100℃以上能升华。二茂铁属于
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
1.分子晶体的判断方法
(1)依据物质的类别判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
(2)依据组成晶体的粒子及粒子间作用判断
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
(3)依据物质的性质判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
2.分子晶体熔、沸点高低的判断
(1)组成和结构相似,不含氢键的分子晶体,相对分子质量越大,范德华力越强,熔、沸点越高,如I2>Br2>Cl2>F2,HI>HBr>HCl。
(2)组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高,如CH3OH>CH3CH3。
(3)含有分子间氢键的分子晶体的熔、沸点反常升高,如H2O>H2Te>H2Se>H2S。
(4)对于有机物中的同分异构体,支链越多,熔、沸点越低,如CH3—CH2—CH2—CH2—CH3>>。
(5)烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高,如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
(1)分子晶体具有较低的熔、沸点和较小的硬度。分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
如:H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大。苯、CCl4是非极性溶剂,则Br2、I2等非极性分子易溶于其中,而水则不溶于苯和CCl4中。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。
如碱金属熔点较低。
3.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是
A.C60摩尔质量是720
B.C60与苯互为同素异形体
C.C60晶体中仅存在范德华力
D.每个C60分子周围与它距离最近且等距离的C60分子有12个
4.下列各组物质各自形成晶体,均属于分子晶体的化合物是
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
5.下列叙述与范德华力无关的是
A.气体物质加压或降温时能凝结或凝固 B.白磷易自燃
C.干冰易升华 D.S8的熔、沸点较低
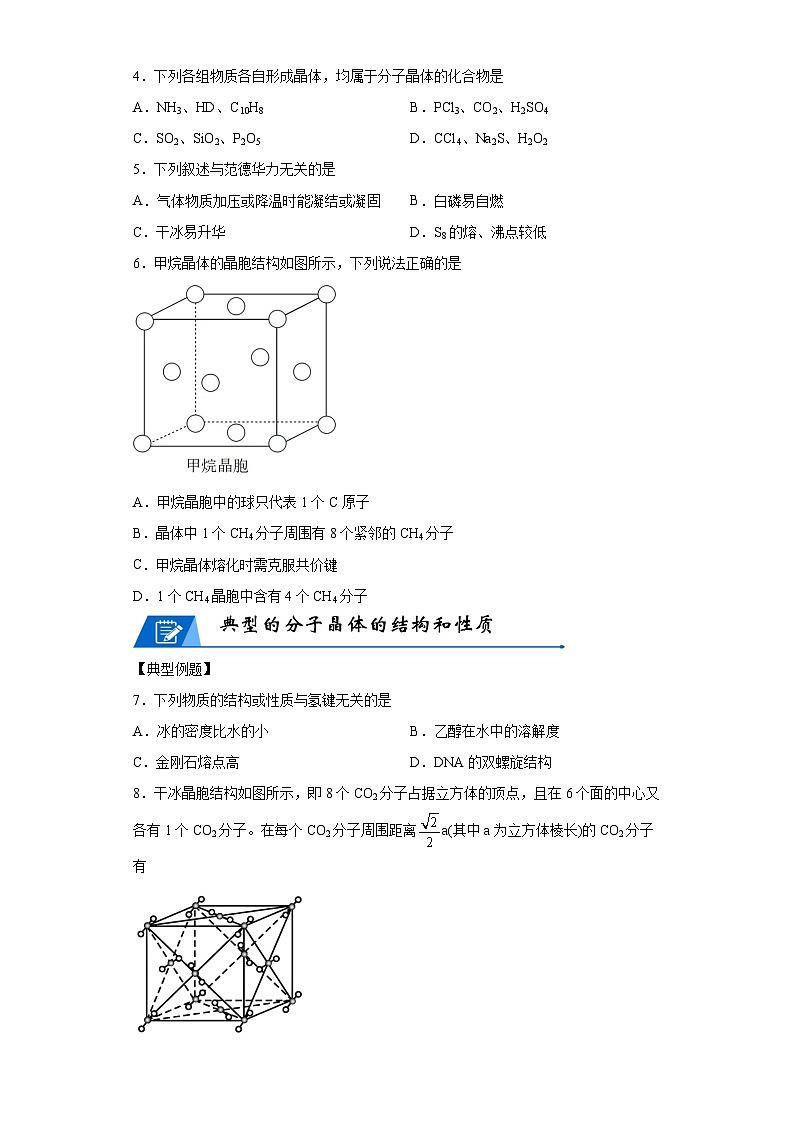
6.甲烷晶体的晶胞结构如图所示,下列说法正确的是
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有8个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有4个CH4分子
【典型例题】
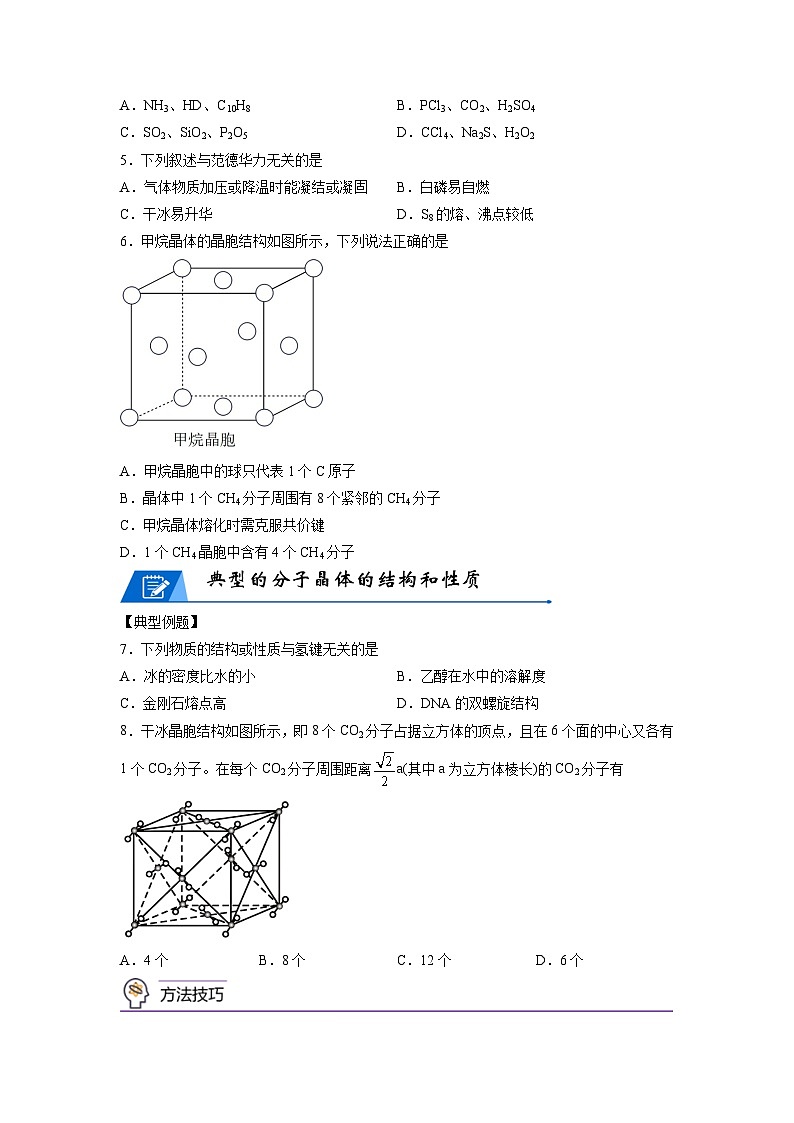
7.下列物质的结构或性质与氢键无关的是
A.冰的密度比水的小 B.乙醇在水中的溶解度
C.金刚石熔点高 D.DNA的双螺旋结构
8.干冰晶胞结构如图所示,即8个CO2分子占据立方体的顶点,且在6个面的中心又各有1个CO2分子。在每个CO2分子周围距离a(其中a为立方体棱长)的CO2分子有
A.4个 B.8个 C.12个 D.6个
(1)少数主要以氢键作用形成的分子晶体,比一般的分子晶体的熔、沸点高,如含有H—F、H—O、H—N等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、羧酸等物质的熔、沸点相对较高。
(2)组成与结构相似,分子之间不含氢键而只利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔、沸点逐渐升高。例如,常温下Cl2呈气态,Br2呈液态,而I2呈固态;CO2呈气态,CS2呈液态。
(3)相对分子质量相等或相近的极性分子构成的分子晶体,其熔、沸点一般比非极性分子构成的分子晶体的熔、沸点高,如CO的熔、沸点比N2的熔、沸点高。
(4)有机物中组成和结构相似且不存在氢键的同分异构体,相对分子质量相同,一般支链越多,分子间的相互作用力越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
9.北京2022年冬奥会采用CO2临界直冷技术,实现“水立方”变为“冰立方”。干冰晶胞如图所示。下列说法错误的是
A.冰、干冰晶体类型不同 B.“水立方”变为“冰立方”,密度减小
C.用干冰制冷比用氟利昂制冷环保 D.1个干冰晶胞的质量约为
10.如图为冰晶体的结构模型,大球代表O原子,小球代表H原子,下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H—O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
11.单质碘的熔、沸点较低,其原因是
A.碘的非金属性较弱 B.碘分子中键能较小
C.固态碘单质中碘分子间以范德华力结合 D.I-I 共价键的键长较长
12.某化学兴趣小组在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
熔点/℃
801
712
190
-68
782
沸点/℃
1465
1418
178
57
1600
根据表中数据分析,属于分子晶体的是
A. B.
C. D.
13.下列有关分子晶体的叙述正确的是
A.分子内均存在共价键
B.分子晶体的熔点较高
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
14.下列说法中,错误的是
A.只含分子的晶体一定是分子晶体
B.碘晶体升华时破坏了共价键
C.几乎所有的酸都属于分子晶体
D.稀有气体中只含原子,但稀有气体的晶体属于分子晶体
15.下列说法正确的是
A.Cl2比F2沸点高,因为其相对分子质量较大
B.分子中键长越短,键能越大,熔沸点越高
C.用纯碱溶液洗涤油脂,符合相似相溶原理
D.水加热到很高的温度都难分解,因为水分子间存在氢键
16.下列叙述与范德华力无关的是
A.CO2加压时形成干冰 B.通常状况下氯化氢为气体
C.氟、氯、溴、碘单质的熔、沸点依次升高 D.氯化钾的熔点较高
17.下列晶体属于分子晶体的是
A.SiC晶体 B.Ar晶体 C.NaCl晶体 D.NaOH晶体
18.正硼酸()是一种片层状结构的白色晶体,层内分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是
A.含的晶体中有6mol氢键
B.分子中硼原子、氧原子最外层均为的稳定结构
C.正硼酸晶体属于共价晶体
D.分子的稳定性与氢键无关
19.下列关于CO2的说法不正确的是
A.CO2是由极性键形成的非极性分子 B.CO2分子中σ键与π键的数目比为1∶1
C.干冰中一个CO2分子周围有8个紧邻分子 D.CO2的大量排放可能引起温室效应
20.富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图,下列说法错误的是
A.分子中碳原子轨道的杂化类型为sp2杂化
B.1molC60分子中σ键的数目为90NA
C.1个C60分子中含有20个五边形和12个六边形
D.C60分子晶胞是分子密堆积
21.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
22.某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构。关于该化合物的说法不正确的是
A.化学式是Al2Cl6
B.不存在离子键和非极性共价键
C.在固态时所形成的晶体是分子晶体
D.在熔融状态下能导电
23.水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间),彼此结合而形成(H2O)2。在冰中每个水分子被4个水分子包围形成变形四面体,通过“氢键”相互连接成庞大的分子晶体。
(1)1 mol冰中有_______mol“氢键”。
(2)水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是_______。
A.标准状况下把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.标准状况下把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子个数比
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为_______。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是_______。
(4)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是_______kJ·mol-1。
高中化学人教版 (2019)选择性必修3第一节 糖类学案: 这是一份高中化学人教版 (2019)选择性必修3第一节 糖类学案,文件包含思维导图人教版高中化学选修三《41糖类》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修三《41糖类》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共26页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修3第一节 卤代烃学案: 这是一份高中化学人教版 (2019)选择性必修3第一节 卤代烃学案,文件包含思维导图人教版高中化学选修三《31卤代烃》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修三《31卤代烃》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共29页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修3第二章 烃第一节 烷烃导学案及答案: 这是一份高中化学人教版 (2019)选择性必修3第二章 烃第一节 烷烃导学案及答案,文件包含思维导图人教版高中化学选修三《21烷烃》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修三《21烷烃》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共16页, 欢迎下载使用。













