



所属成套资源:高考化学一轮复习课件(含解析)
高考化学一轮复习课件19.化学平衡的移动和化学反应进行的方向(含解析)
展开
这是一份高考化学一轮复习课件19.化学平衡的移动和化学反应进行的方向(含解析),共21页。PPT课件主要包含了化学平衡移动原理,化学平衡移动,气体体积减小,气体体积增大,勒夏特列原理,随堂练习等内容,欢迎下载使用。
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其一般规律2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用
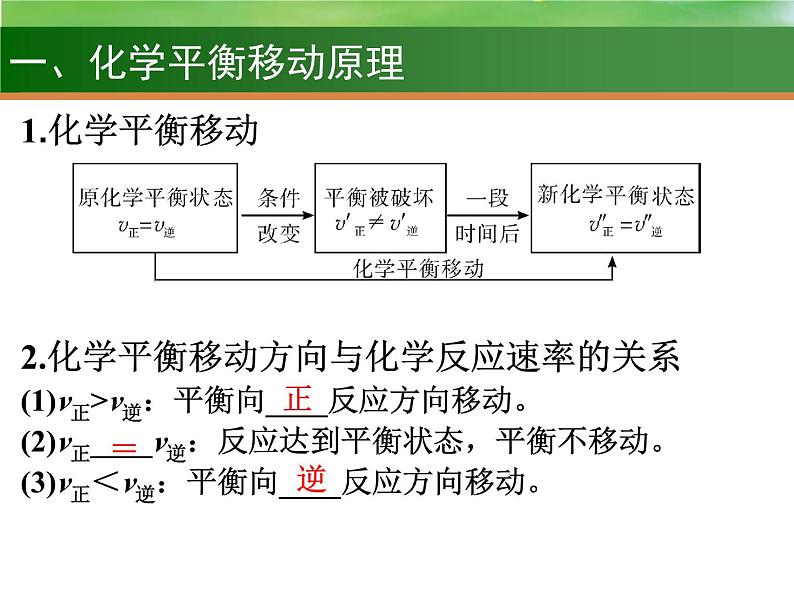
化学平衡的移动 化学反应进行的方向
2.化学平衡移动方向与化学反应速率的关系(1)v正>v逆:平衡向____反应方向移动。(2)v正____v逆:反应达到平衡状态,平衡不移动。(3)v正<v逆:平衡向____反应方向移动。
3.外界因素对化学平衡的影响
(1)浓度对化学平衡的影响
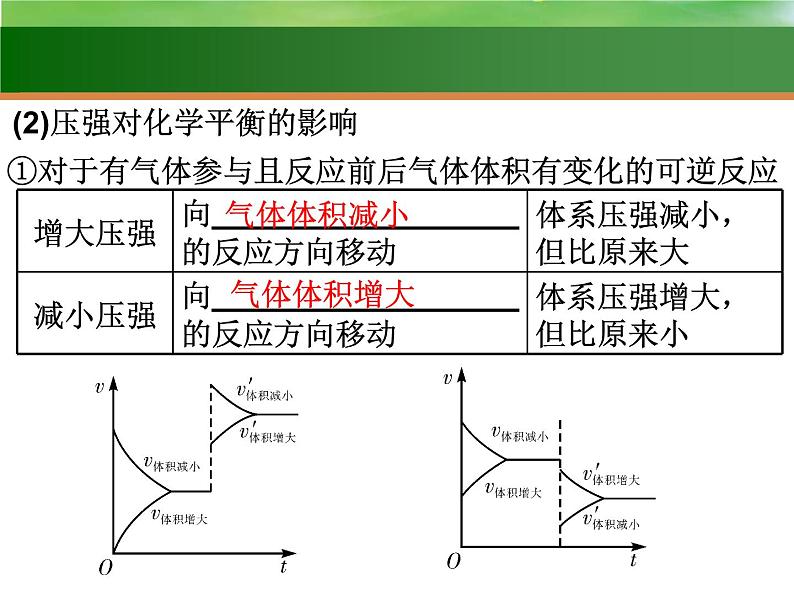
(2)压强对化学平衡的影响
①对于有气体参与且反应前后气体体积有变化的可逆反应
②对于有气体参与且反应前后气体体积相等的可逆反应
对于反应前后气体总体积相等的反应,改变压强对平衡无影响。
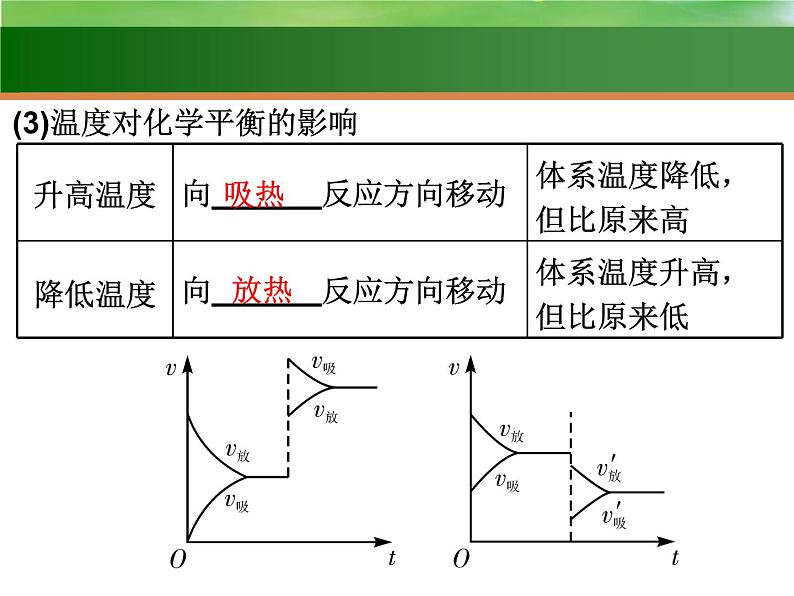
(3)温度对化学平衡的影响
(4)几种特殊情况说明:①改变固体或纯液体的量,对化学平衡无影响。②“惰性气体”对化学平衡的影响。
(1)内容:如果改变影响平衡的一个条件(浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
(2)适用范围:适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析。
(3)适用条件:一个能影响化学平衡的外界条件的变化
(4)平衡移动的结果是“减弱”外界条件的影响,而不能消除外界条件的影响。
1.已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是( )①生成物的体积分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥加入催化剂可以达到以上目的A.①②B.②⑤ C.③⑤D.④⑥
2.对可逆反应2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下达到平衡。下列有关叙述正确的是( )①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高A.①②B.④ C.③D.④⑤
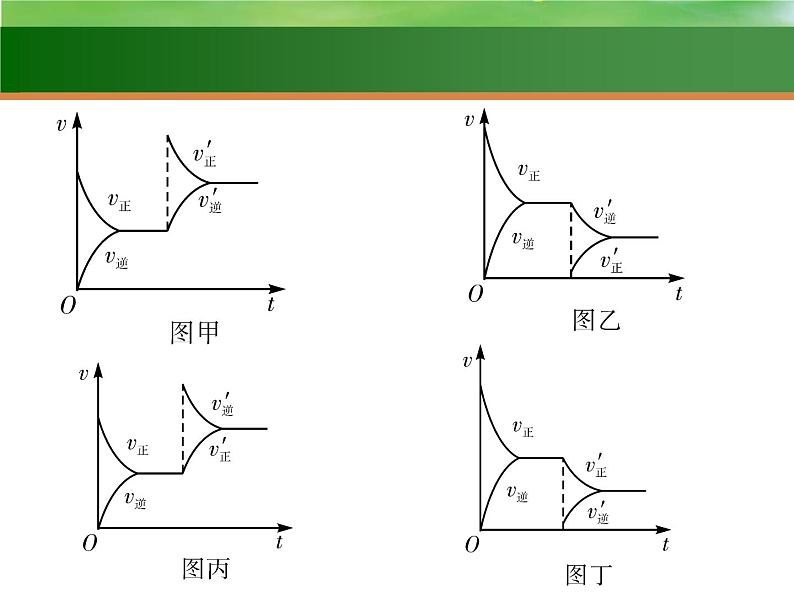
3.下图是恒温下化学反应“A(g)+B(g) C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )
A.平衡状态Ⅰ与平衡状态Ⅱ的正反应速率相等B.平衡移动的原因可能是增大了反应物浓度C.平衡移动的原因可能是增大了压强D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数大小关系为K1<K2
二、化学反应进行的方向
1.自发反应(1)含义:在温度和压强一定的条件下,无须借助外力就能自发进行的反应称为自发反应。(2)特点:①体系趋向于从______状态转变为______状态(体系对外部______或______热量)。②在密闭条件下,体系有从______转变为______的倾向性(无序体系更加稳定)。
2.判断化学反应方向的依据
(1)焓判据:放热过程中体系能量 ,∆H 0,具有自发进行的倾向,故只用焓变判断反应进行的方向不全面。
(2)熵判据:①熵的大小:同种物质的熵值:气态 液态 固态②熵判据:体系的混乱度增加(即熵增),∆S 0,反应有自发进行的倾向,但有些熵减的过程也能自发进行,故只用熵变来判断反应进行的方向也不全面。
(3)复合判据:要正确判断一个反应是否能自发进行,必须综合考虑反应的 与 。∆G=∆H-T∆S∆G>0,反应不能自发进行∆G=0,反应达到平衡状态∆G0,∆S
相关课件
这是一份2020版高考化学一轮复习考点备考课件7.3.2化学反应进行的方向 (含解析),共7页。PPT课件主要包含了速查速测,典例剖析,反思归纳,试题备选等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第3节考点2化学反应进行的方向 (含解析),共16页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,一定能,一定不能,思维深化,考点突破等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第七章化学反应速率和化学平衡第2节考点2化学平衡的移动 (含解析),共22页。PPT课件主要包含了栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。








