







高中化学人教版 (2019)必修 第一册第一节 铁及其化合物优秀课件ppt
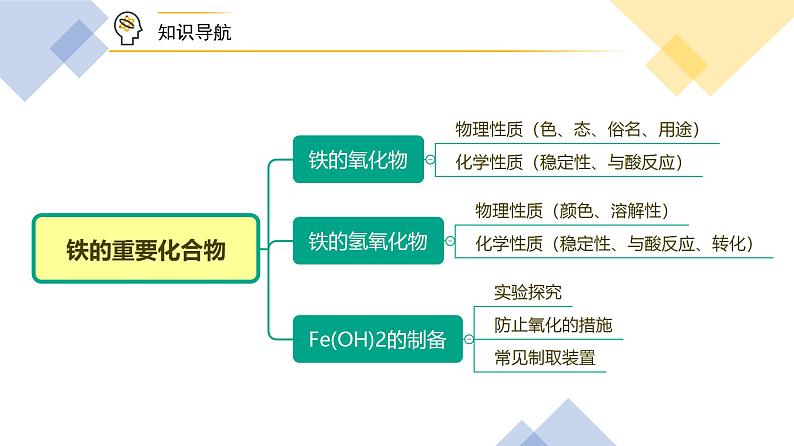
展开第21讲 铁的重要化合物
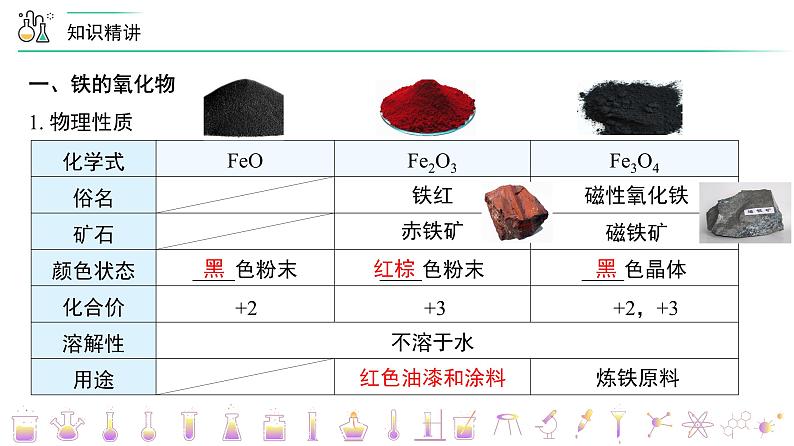
一、铁的氧化物1. 物理性质
铁红
磁性氧化铁
赤铁矿
磁铁矿
+2
+3
+2,+3
不溶于水
红色油漆和涂料
炼铁原料
黑
红棕
黑
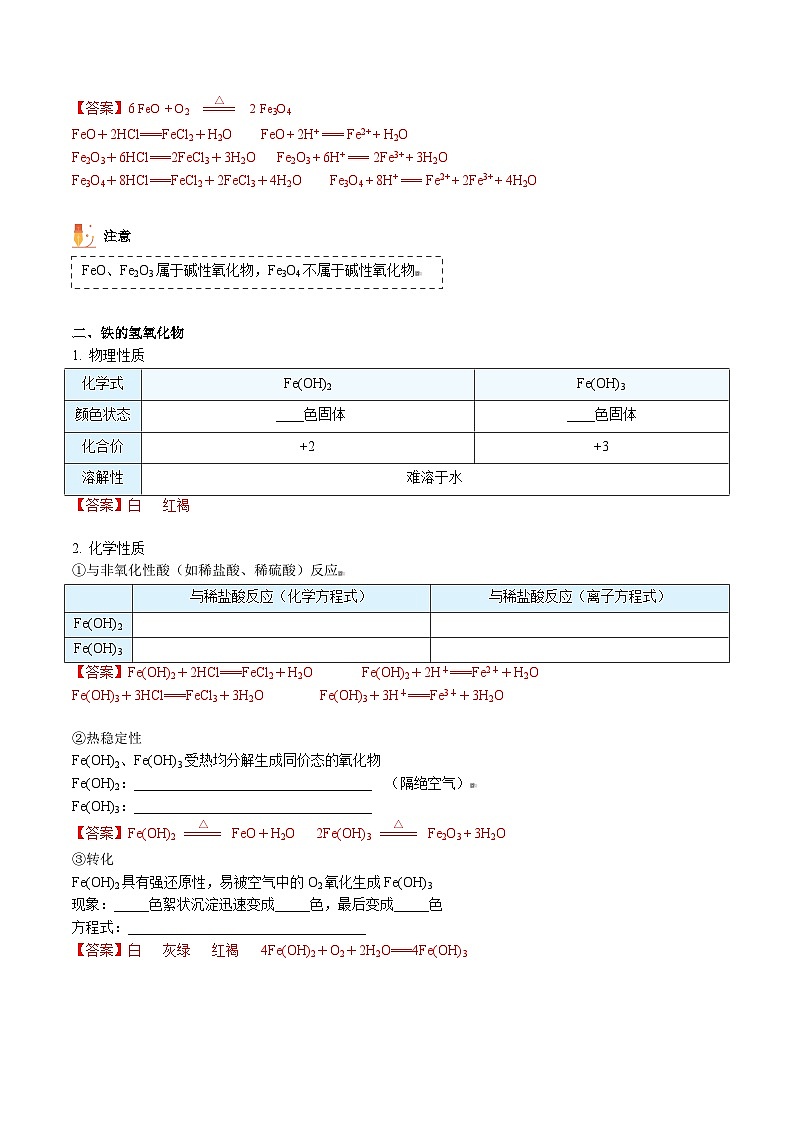
一、铁的氧化物1. 物理性质①稳定性FeO不稳定,在空气中受热:__________________________________。Fe2O3和 Fe3O4很稳定。
一、铁的氧化物1. 物理性质②与非氧化性酸(如稀盐酸、稀硫酸)反应FeO和Fe2O3属于碱性氧化物,与非氧化性酸反应生成亚铁盐和铁盐
FeO+2HCl===FeCl2+H2O
FeO + 2H+ === Fe2+ + H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3 + 6H+ === 2Fe3+ + 3H2O
Fe3O4+8HCl==FeCl2+2FeCl3+4H2O
Fe3O4 + 8H+ === Fe2+ + 2Fe3+ + 4H2O
二、铁的氢氧化物1. 物理性质
白
红褐
二、铁的氢氧化物2. 化学性质①与非氧化性酸(如稀盐酸、稀硫酸)反应
Fe(OH)2+2HCl===FeCl2+H2O
Fe(OH)2+2H+===Fe2++H2O
Fe(OH)3+3HCl===FeCl3+3H2O
Fe(OH)3+3H+===Fe3++3H2O
二、铁的氢氧化物2. 化学性质②热稳定性Fe(OH)2、Fe(OH)3受热均分解生成同价态的氧化物Fe(OH)2:__________________________________ Fe(OH)3:__________________________________
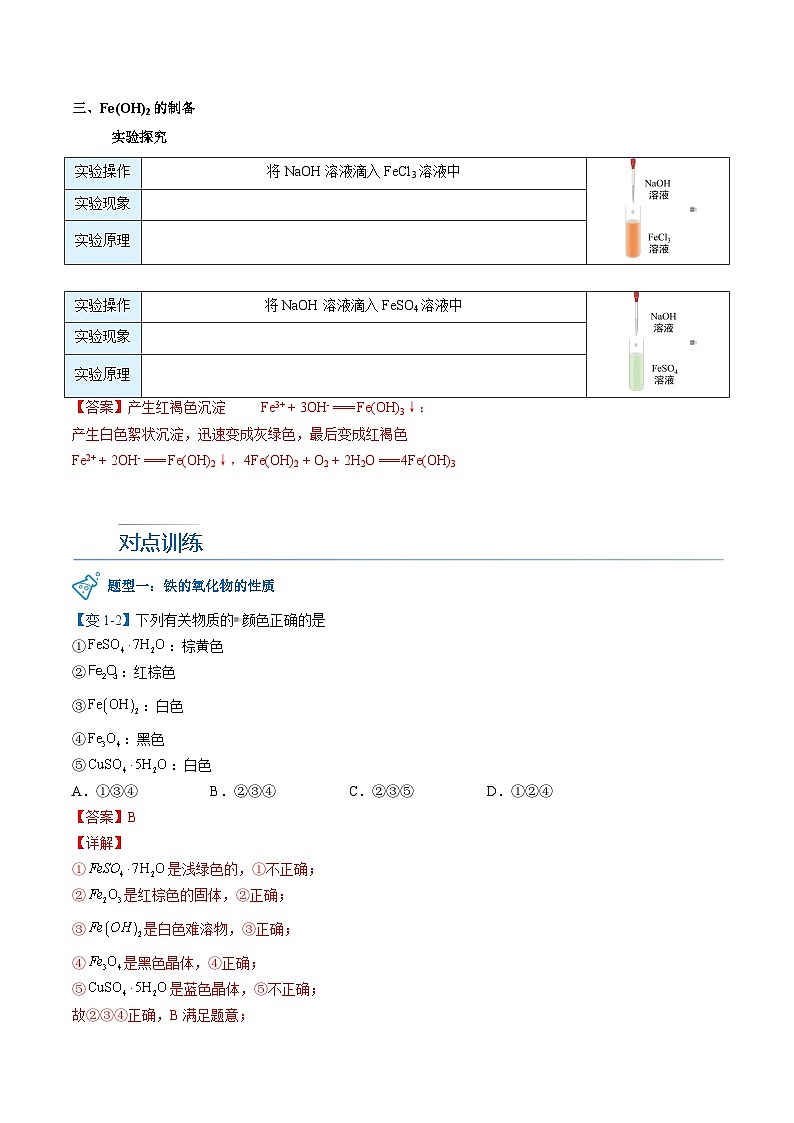
二、铁的氢氧化物2. 化学性质③转化Fe(OH)2具有强还原性,易被空气中的O2氧化生成Fe(OH)3现象:_____色絮状沉淀迅速变成_____色,最后变成_____色方程式:__________________________________
白
灰绿
红褐
4Fe(OH)2+O2+2H2O===4Fe(OH)3
产生红褐色沉淀
Fe3+ + 3OH- === Fe(OH)3↓
产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
Fe2+ + 2OH- === Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3
【例2】铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为A.FeO·3Fe2O3 B.FeO·2Fe2O3 C.2FeO·3Fe2O3 D.2FeO·Fe2O3
C
题型一:铁的氧化物的性质
【例6】某兴趣小组为认识铁及其化合物的性质、分散系的性质做了如图一组综合实验,根据实验流程回答相关问题。(1)请写出Fe2O3与①反应的离子方程式:___________。(2)物质②为___________(填名称)。(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3悬浊液,该过程的现象为___________,此过程中发生的氧化还原反应为___________(用化学方程式表示)。(4)将FeCl3饱和溶液滴入沸水中,并继续煮沸至液体呈红褐色,制得分散系③为___________,该反应化学方程式为:___________。它与FeCl3溶液、Fe(OH)3悬浊液的本质区别是___________
题型三:铁及其化合物杨
【答案】Fe2O3+6H+=2Fe3++3H2O 氢氧化钠溶液或氨水 生成白色沉淀,迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3胶体 FeCl3+3H2O = = = Fe(OH)3(胶体)+3HCl 分散质粒子的直径大小不同
人教版 (2019)必修 第一册第一节 铁及其化合物评优课ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物评优课ppt课件,共24页。PPT课件主要包含了铁的氧化物,铁的氢氧化物,本节重难点,红砖青砖知多少,FeO,Fe2O3,Fe3O4,黑色粉末,红棕色粉末,均不溶于水等内容,欢迎下载使用。
高中化学第一节 铁及其化合物一等奖课件ppt: 这是一份高中化学第一节 铁及其化合物一等奖课件ppt,共23页。PPT课件主要包含了金属单质,金属氧化物,Fe3+Fe2+,+3Fe,+2Fe,氧硅铝铁钙,A硫酸C硫酸锌,B硝酸锌D氯化铜等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量优秀ppt课件,文件包含第17讲物质的量浓度PPT课件pptx、第17讲物质的量浓度教师版docx、第17讲物质的量浓度学生版docx等3份课件配套教学资源,其中PPT共17页, 欢迎下载使用。













