
所属成套资源:2024届高三新高考化学大一轮专题练习(50份)
2024届高三新高考化学大一轮专题练习-卤素及其化合物
展开
这是一份2024届高三新高考化学大一轮专题练习-卤素及其化合物,共19页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习-卤素及其化合物
一、单选题
1.(2023·广东·广州市第二中学校联考三模)下列实验操作、现象和结论均正确的是
选项
实验操作和现象
结论
A
在溶液中通入气体,有沉淀生成
酸性:>HClO
B
向淀粉溶液中加适量20%溶液,加热,冷却后滴加少量碘水,溶液变蓝
淀粉有剩余
C
向体积为100mL、浓度均为的NaCl和混合液中滴加溶液,先产生白色沉淀,后产生砖红色沉淀
相同温度下,
D
相同温度下,用pH试纸测定相同浓度的与NaClO溶液的pH,前者pH更大
水解程度:>NaClO
A.A B.B C.C D.D
2.(2023·北京昌平·统考二模)下列解释实验现象或用途的离子方程式书写不正确的是
A.用硫化钠处理含汞废水:
B.将通入氢氧化钠溶液中制消毒液:
C.溶液腐蚀铜板:
D.溶于稀盐酸:
3.(2023春·上海浦东新·高三上海市进才中学校考期中)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液。经测定ClO-与离子的物质的量浓度之比是3:1,则Cl2与KOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
A. B. C. D.
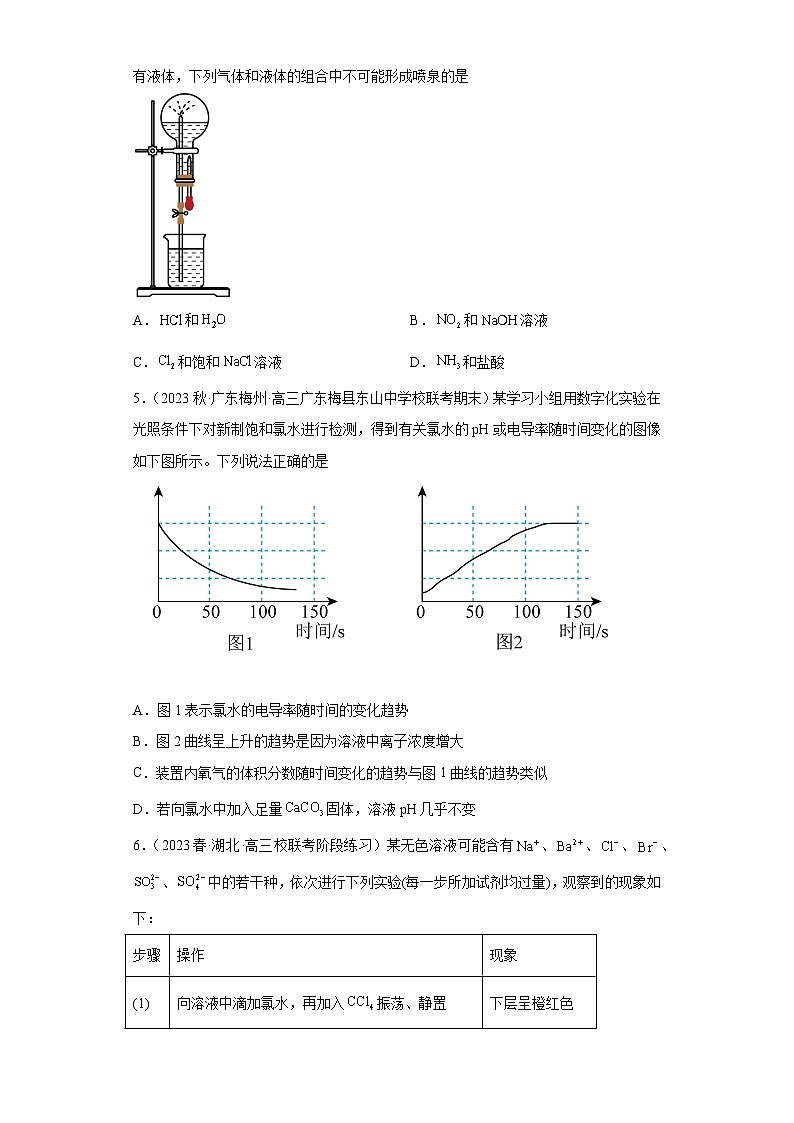
4.(2023春·安徽六安·高三六安二中校考期中)喷泉是一种常见的自然现象,如下图是化学教材中常用的喷泉实验装置,在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,下列气体和液体的组合中不可能形成喷泉的是
A.和 B.和溶液
C.和饱和溶液 D.和盐酸
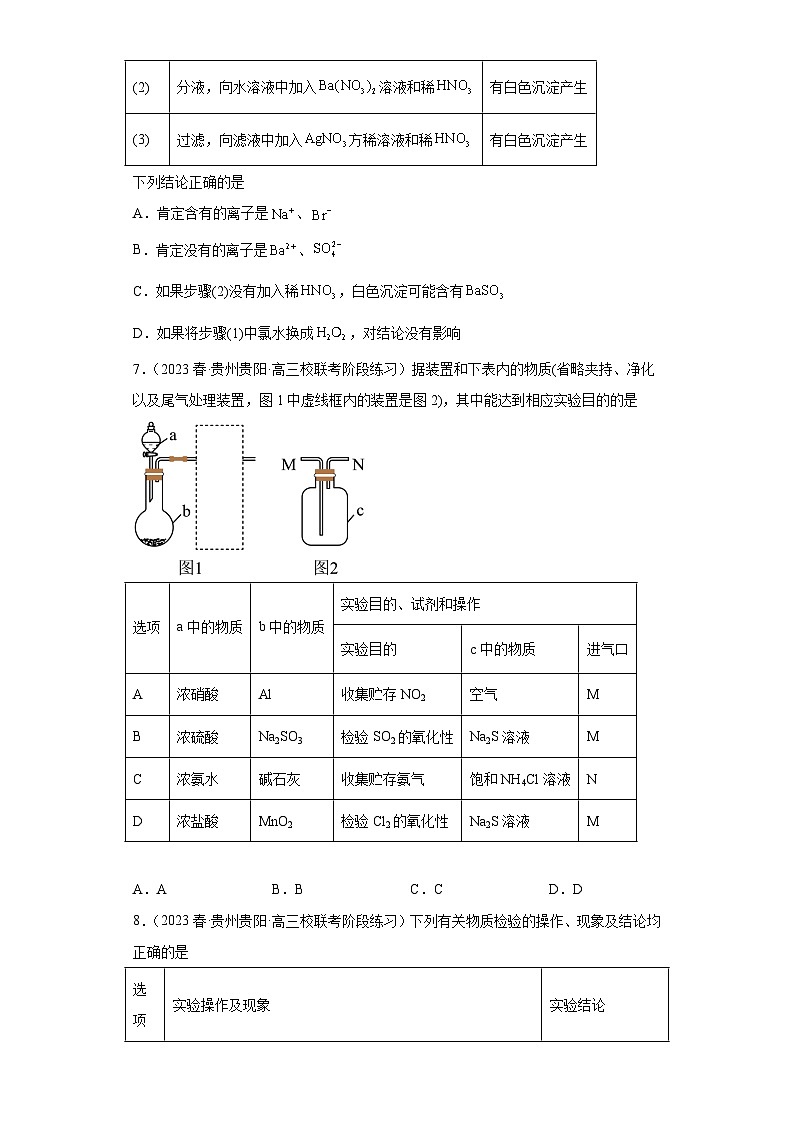
5.(2023秋·广东梅州·高三广东梅县东山中学校联考期末)某学习小组用数字化实验在光照条件下对新制饱和氯水进行检测,得到有关氯水的pH或电导率随时间变化的图像如下图所示。下列说法正确的是
A.图1表示氯水的电导率随时间的变化趋势
B.图2曲线呈上升的趋势是因为溶液中离子浓度增大
C.装置内氧气的体积分数随时间变化的趋势与图1曲线的趋势类似
D.若向氯水中加入足量固体,溶液pH几乎不变
6.(2023春·湖北·高三校联考阶段练习)某无色溶液可能含有、、、、、中的若干种,依次进行下列实验(每一步所加试剂均过量),观察到的现象如下:
步骤
操作
现象
(1)
向溶液中滴加氯水,再加入振荡、静置
下层呈橙红色
(2)
分液,向水溶液中加入溶液和稀
有白色沉淀产生
(3)
过滤,向滤液中加入方稀溶液和稀
有白色沉淀产生
下列结论正确的是
A.肯定含有的离子是、
B.肯定没有的离子是、
C.如果步骤(2)没有加入稀,白色沉淀可能含有
D.如果将步骤(1)中氯水换成,对结论没有影响
7.(2023春·贵州贵阳·高三校联考阶段练习)据装置和下表内的物质(省略夹持、净化以及尾气处理装置,图1中虚线框内的装置是图2),其中能达到相应实验目的的是
选项
a中的物质
b中的物质
实验目的、试剂和操作
实验目的
c中的物质
进气口
A
浓硝酸
Al
收集贮存NO2
空气
M
B
浓硫酸
Na2SO3
检验SO2的氧化性
Na2S溶液
M
C
浓氨水
碱石灰
收集贮存氨气
饱和NH4Cl溶液
N
D
浓盐酸
MnO2
检验Cl2的氧化性
Na2S溶液
M
A.A B.B C.C D.D
8.(2023春·贵州贵阳·高三校联考阶段练习)下列有关物质检验的操作、现象及结论均正确的是
选项
实验操作及现象
实验结论
A
用洁净铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色
该溶液含,不含
B
向某盐溶液中加入NaOH浓溶液,加热,用玻璃棒蘸浓硝酸靠近时产生白烟
该溶液中一定含有
C
向无色溶液中滴加氯水,再加振荡、静置、溶液分层,下层呈紫红色
该溶液中一定含有
D
将未打磨的薄铝片放在火焰上加热,晃动铝片,内部有液态物质流动,但没熔融下滴
金属铝的熔点高
A.A B.B C.C D.D
9.(2023春·安徽合肥·高三安徽省庐江汤池中学校联考期中)化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
C.汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一
D.明矾和氯气均可用于水的杀菌、消毒
10.(2023·北京东城·统考二模)下列说法正确的是
A.露置在空气中,最终转化为
B.向溶液中加入溶液,可得到S
C.放电条件下,和直接化合生成
D.把红热的铁丝伸入盛有的集气瓶中,可得到
11.(2023春·广东广州·高三广州市真光中学校考阶段练习)KMnO4受热分解常用于实验室制备O2.工业制备KMnO4中,首先以软锰矿(主要成分为MnO2)为原料生成K2MnO4,进而利用K2MnO4“酸性歧化法”生成KMnO4,流程如下图所示。
实验室中模拟以上工业流程制备KMnO4.下列说法错误的是
A.熔融过程温度较高,可以选用石英坩埚作反应容器
B.“酸化”时若改用盐酸,则反应为
C.“结晶”获取KMnO4晶体时采用蒸发结晶
D.该流程中涉及到的化学反应都是氧化还原反应
12.(2023·江苏镇江·江苏省镇江第一中学校考一模)氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO与ClO,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是
A.NaClO3具有氧化性,可用于制取ClO2
B.Cl2有还原性,可用于从海水中提取溴
C.HClO不稳定,可用于棉、麻漂白
D.FeCl3溶液呈酸性,可用于蚀刻印刷电路板
13.(2023·江苏镇江·江苏省镇江第一中学校考一模)氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO与ClO,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。实验室制取高浓度的HClO溶液,有关实验装置和原理能达到实验目的的是
A.制取氯气 B.制取氯水
C.提高HClO浓度 D.分离HClO
14.(2023春·山东枣庄·高三统考期中)下列过程的能量变化与图相符的是
A.碳酸氢钠溶液与柠檬酸反应 B.锌与稀硫酸反应
C.NaOH溶液与盐酸反应 D.氢气在氯气中燃烧
二、非选择题
15.(2022秋·陕西西安·高三高新一中校考期中)是一种重要的化工原料,可以制备许多含氧产品,从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。某化学兴趣小组为了探究的相关性质,设计了如图的一系列实验。以下是氧元素形成物质的二维图的部分信息及相关实验装置。
(1)根据二维图中信息,写出任意一种氯的氧化物的化学式_________。
(2)在钢瓶上应贴的标签为_________(填字母)。
a.腐蚀品 b.爆炸品 c.有毒品 d.易燃品
(3)既具有氧化性,又具有还原性,请结合二维图说明原因_________。
(4)既具有氧化性,又具有还原性,请任意写出一个体现HCl氧化性的离子方程式_________。
(5)图一中,通入后,从集气瓶A、B的现象可得出的结论是_________。
(6)图二中三组实验,不会产生气体的是_________,写出因发生氧化还原反应而产生气体的化学方程式_________。
16.(2022秋·新疆阿克苏·高三校考阶段练习)某消毒液的主要成分为 NaClO,回答下列问题:
(1)消毒液的有效成分为 NaClO,用来杀菌消毒的物质为_______,该物质属于_______(填“强电解质”“弱电解质”或“非电解质”),若属于电解质,写出其电离方程式_______(若属于非电解质,此空不填)。
(2)写出消毒液在空气中使用时发生反应的离子方程式:_______。
(3)消毒液中含有适量 NaOH 的作用。_______。
(4)常温下,该消毒液的 pH 约为 12,其中 c(NaOH)为_______。
(5)已知少量 CO2 与 NaClO 溶液反应的离子方程式为ClO-+CO2+H2O=HClO+HCO,由此可推知:HClO、H2CO3、HCO的酸性关系为_______;试写出将足量稀硫酸滴入 NaClO 溶液中发生反应的化学方程式:_______。
17.(2022·福建泉州·高三石狮市石光中学校考期中)回答下列问题:
I.利用价类二维图像,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:
(1)丙的化学式为_______;戊的化学式为_______,具有_______(任意写出一种戊具有的性质);
(2)根据氯元素的化合价判断,乙物质_______。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)若庚是源白粉的有效成分。漂白粉也是常用消毒剂之一、漂白粉溶于水后,受空气中的作用,产生有漂白、杀菌作用的次氯酸,其化学方程式为:_______。
II.某校化学课外小组为了鉴别和两种白色固体。用不同的方法做了以下实验,如图所示:
(4)方法I中逐滴加入溶液_______(填“能”或“不能”)鉴别和。
(5)方法II能鉴别和的现象是_______。
(6)方法III、IV均能鉴别这两种物质,其中加热试管发生反应的化学方程式为____,与方法Ⅲ相比,方法IV的优点是____ (填字母)。
A.IV比III复杂
B.IV比III安全
C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个实验,而III不行
(7)若用方法IV验证和的稳定性,则试管B中装入的固体是____(填化学式)
18.(2022秋·辽宁朝阳·高三建平县实验中学校考期中)化学小组同学设计如下实验验证氯气的部分性质,并探究氯水的成分和性质
回答下列问题:
(1)装置A中发生反应的化学方程式为_________。
(2)验证干燥的氯气没有漂白性的现象为_________。
(3)装置F的作用是_________。
(4)研究新制氯水成分和性质。以装置E的溶液进行下列实验
实验序号
实验1
实验2
实验3
实验操作
实验现象
溶液变蓝
石蕊溶液先变红,后褪色
有白色沉淀生成
资料:淀粉的特征反应——遇I2变蓝色;。
①根据实验1可知,氧化性:_________(填“>”或“HClO,故次氯酸钙能与空气中二氧化碳发生反应生成次氯酸,反应方程式为。
(4)和均能与溶液反应生成白色BaCO3沉淀,实验现象相同,无法鉴别,故答案为:不能。
(5)和均能与足量稀盐酸反应生成CO2气体,的含碳量高于,根据碳原子守恒可知,相同质量和分别与足量盐酸完全反应后,生成的CO2气体更多,气球体积更大,故答案为:加入的装置反应后气球更大。
(6)碳酸钠的热稳定性较好,受热不反应,碳酸氢钠的热稳定性较差,受热发生分解生成碳酸钠、二氧化碳、水,反应方程式为;相较于方法III,方法IV的优点是可以做到一套装置同时进行两个实验,可以进行对比,而III不行,故答案为:;D。
(7)IV中的试管B在试管A内部,不能直接接触到火焰,温度相对较低,故试管B中装入的固体是易分解的,试管A中装入的固体是,故答案为:。
18.(1)(浓)
(2)装置C中干燥的红色布条无明显变化,装置D中湿润的红色布条褪色
(3)吸收氯气,防止污染空气
(4) > 、HClO
(5) 避光
【详解】(1)实验室制取,用和浓加热,所得方程式:(浓);
(2)要验证干燥的氯气没有漂白性,就要将干燥的通入干燥的有色布条中,有色布条不褪色,对比湿润的有色布条褪色,得出结论,所以现象为:装置C中干燥的红色布条无明显变化,装置D中湿润的红色布条褪色;
(3)是有毒气体,要用溶液进行尾气处理,防止污染空气,故答案为:吸收氯气,防止污染空气;
(4)①根据反应:,氧化剂的氧化性强于氧化产物,故:氧化性>;
②石蕊溶液中滴加氯水,溶液先变红后褪色,证明溶液中先酸性和漂白性,溶液中含有和;
③证明氯水中含有氯离子,需要向氯水中滴加溶液,故反应的离子方程式为:;
(5)强光照射,发生反应,所以溶液中的浓度增大,如图,故氯水要避光保存。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习—卤素及其化合物,共18页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习--卤素及其化合物,共14页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习----卤素及其化合物,共18页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。








