

2024届新高考化学第一轮专项训练复习——电解质溶液(含解析)
展开
这是一份2024届新高考化学第一轮专项训练复习——电解质溶液(含解析),共29页。试卷主要包含了单选题,实验探究题,综合题等内容,欢迎下载使用。
2024届新高考化学第一轮专项训练复习——电解质溶液
一、单选题
1.(2023·虹口模拟)下列属于含有非极性键的强电解质的是
A.HBr B.Na2O2 C.KOH D.NH4Cl
2.(2023·黄浦模拟)下列固体属于非电解质的是( )
A.冰 B.干冰 C.可燃冰 D.冰醋酸
3.(2023·昆明模拟)2022年,在卡塔尔举办的世界杯备受全世界瞩目。下列说法错误的是
A.开幕式的绚丽烟花利用的“焰色试验”是物理变化
B.运动员需要补充的NaCl溶液是电解质
C.制作奖杯的材料之一18K 金是合金
D.足球赛服材料聚酯纤维属于有机高分子材料
4.(2023·普陀模拟)下列物质中,含有氢离子的是
A.氨水 B.碘酒 C.熔融NaHSO4 D.三氯甲烷
5.(2023·合肥模拟)下列化学概念或化学用语叙述正确的是
A.属于弱电解质
B.四氯化碳充填模型可表示为
C.和互为同素异形体
D.的结构式为
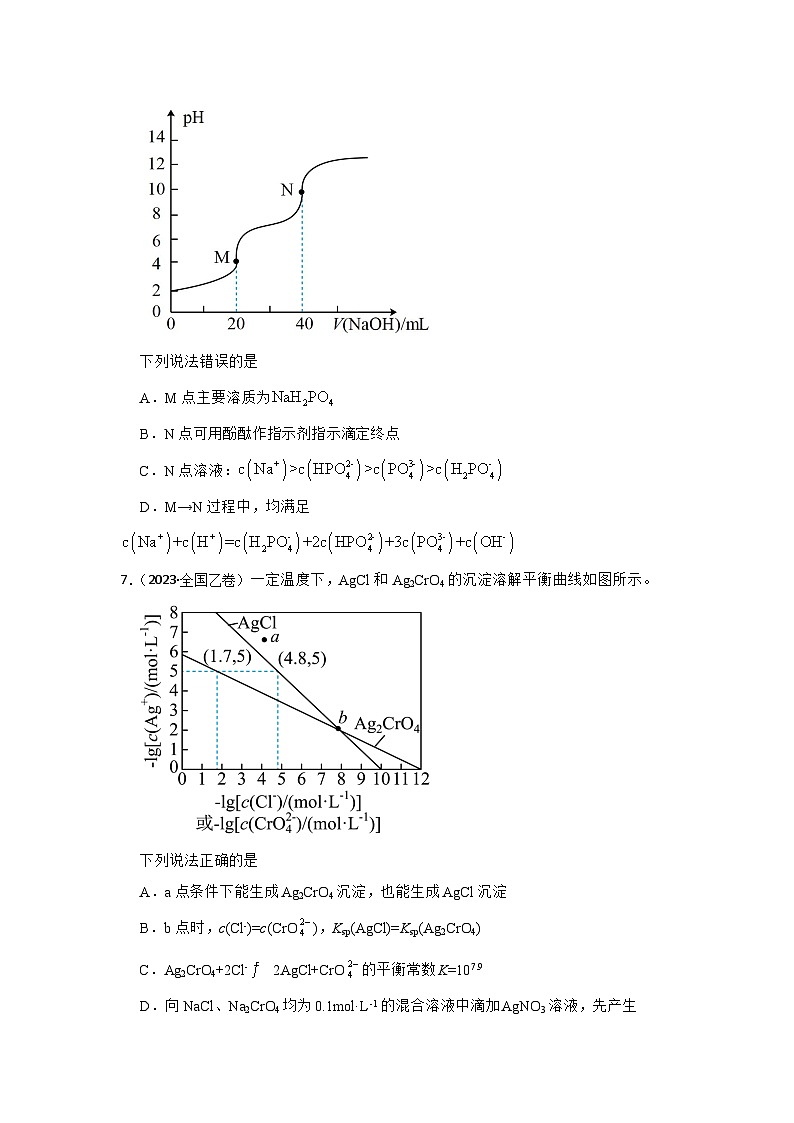
6.(2022高三上·西城期末)以0.1mol/L NaOH溶液滴定20.00mL 0.1mol/L溶液的滴定曲线如图。已知:酚酞的变色范围是pH8.2~10
下列说法错误的是
A.M点主要溶质为
B.N点可用酚酞作指示剂指示滴定终点
C.N点溶液:
D.M→N过程中,均满足
7.(2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
8.(2023·平谷模拟)常温下,某弱酸HA溶液中主要成分的物质的量浓度分数随pH的变化如图所示。下列有关叙述错误的是
A.常温下,HA的电离平衡常数
B.若温度升高,曲线交点M会向左移动
C.NaA的水解平衡常数
D.某的缓冲溶液,pH约为4
9.(2022高三上·大兴期末)常温下,以酚酞作指示剂,用的溶液滴定的二元酸溶液(变化关系如图所示)。下列说法错误的是( )
A.的电离方程式为:;
B.当时,
C.当时,
D.当时,
10.(2023·松江模拟)室温下,取溶液,逐滴加入溶液。已知:,。下列说法正确的是
A.溶液中有
B.当滴加至中性时,用去溶液的体积小于
C.当用去溶液时,此时溶液中有
D.当用去溶液时,此时溶液中有
11.向工业废水中加入硫化物可以获得CuS、FeS纳米粒子[已知,],下列说法正确的是
A.FeS固体不能用于去除工业废水中的
B.向和混合溶液中加入溶液,当两种沉淀共存时,
C.向CuS饱和溶液中加入固体,CuS的溶解平衡逆向移动,滤液中一定存在
D.已知溶液中,可判断CuS易溶于稀盐酸
12.(2022高三上·安徽月考)丙酸()是一种一元有机弱酸,可用作酯化剂和增塑剂。室温下,用0.10 mol·L-1 NaOH溶液滴定20 mL 0.10mol/L丙酸溶液,其混合液的pH随着加入NaOH溶液的体积变化曲线如图所示。下列说法正确的是( )
A.室温下,丙酸的电离常数的数量级为
B.a、b、c、d四点溶液中水的电离程度最大的是c点
C.a点溶液中存在
D.d点溶液中存在
13.(2022高三上·邯郸期末)下列各项实验操作和现象推出的结论正确的是
选项
实验操作
现象
结论
A
①向某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀②仍有白色沉淀
原溶液中有SO
B
取5mL0.1mol·L-1FeCl3溶液,滴加5~6滴0.1mol·L-1KI溶液,充分反应后,再滴加KSCN溶液
溶液变红
FeCl3和KI的反应是可逆反应
C
将足量SO2通入Na2CO3溶液中逸出的气体先通入足量的酸性KMnO4溶液,再通入澄清石灰水中
酸性高锰酸钾溶液颜色变浅,澄清石灰水变浑浊
Ka1(H2SO3)>Ka1(H2CO3)
D
向蔗糖溶液中加入适量稀硫酸,水浴加热,冷却后向溶液中滴加新制Cu(OH)2悬浊液,加热
未出现砖红色沉淀
蔗糖未水解
A.A B.B C.C D.D
14.(2023·淮北模拟)金与铯在真空中和下反应可得离子化合物金化铯(),金化铯溶于液氨形成黄色溶液,表现出较高的导电率。下列有关金化铯说法错误的是
A.金元素显价
B.在液氨中会发生电离
C.在空气中不易被氧化
D.与水反应的化学方程式:
15.(2022高三上·邯郸期末)酸碱质子理论认为,在反应过程中能给出质子(H+)的分子或离子都是酸,凡是能接受质子的分子或离子都是碱。例如:CH3COOH+HCl⇌CH3COOH+Cl-中,CH3COOH为碱,HCl为酸。已知某温度下,几种酸在液态醋酸中电离常数的负对数a(a=-lgKa)如下表所示:
酸
HClO4
H2SO4
HCl
HNO3
a
5.8
8.2
8.8
9.4
下列说法错误的是
A.部分元素的电负性:Cl>S>H
B.在液态醋酸中,酸性:HClO4>H2SO4>HCl>HNO3
C.在液态醋酸中,H2SO4给出质子
D.HNO3在液态醋酸中的电离方程式为HNO3=H++NO
16.(2023·河北模拟)草酸(H2C2O4)是一种常见的二元弱酸,0.010mol/L的H2C2O4溶液中H2C2O4、和的物质的量分数δ(X)随pH变化如图。下列说法正确的是
A.曲线①表示的物质的量分数δ(X)随pH变化关系
B.NaHC2O4溶液中c(OH-)>c(H+)
C.0.01mol/LNaHC2O4溶液中,c()+c(OH-)=c(H+)+c(H2C2O4)
D.反应H2C2O4+2的化学平衡常数为10-5.4
二、实验探究题
17.(2023·全国甲卷)钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:。
具体步骤如下:
Ⅰ.称取,用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
18.(2023·蚌埠模拟)[Co( NH3)6]Cl3(三氯六氨合钴)是一种重要的化工产品,实验室制备过程如下:
①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2,当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
(1)[ Co( NH3)6]Cl3中Co的化合价是 ,该配合物中心离子的核外电子排布式为 。
(2)“加热”应控温在60℃进行,控温方式可采取 ,温度不宜过高的原因是 。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[ Co(NH3)6]Cl3的化学方程式是 。
(4)加入浓盐酸的作用是 。
(5)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取mg的产品,配制成100mL溶液,移取20mL于锥形瓶中;.
ii.滴加几滴K2CrO4溶液为指示剂,用c mol· L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl 1.3×10-6mol · L-1,Ag2CrO4(砖红色)6.5×10-5mol ·L-1
①ii中,滴定至终点的现象是 。
②制备的晶体中Cl-的质量分数是 (列计算式即可)。
三、综合题
19.(2023·吴忠模拟)硫酸锰是一种重要的化工中间体。一种以高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿(主要成分为MnO2等锰的氧化物)为原料制备硫酸锰的工艺流程如下:
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中沉淀的pH范围如下表所示(25℃):
物质
Fe(OH)3
Fe(OH)2
Mn(OH)2
Al(OH)3
开始沉淀的pH
1.9
7.6
7.3
3.0
完全沉淀的pH
3.2
9.6
9.3
5.2
③离子浓度≦10-5mol·L-1时,离子沉淀完全。
(1)“混合焙烧”的主要目的是 。
(2)若试剂a为MnO2,则氧化步骤发生反应的离子方程式为 ,若省略“氧化”步骤,造成的影响是 。
(3)“中和除杂”时,应控制溶液的pH范围是 。
(4)“氟化除杂”后,若使溶液中Mg2+沉淀完全,需维持c(F-)不低于 。(已知:Ksp(MgF2)=6.4×10-10)
(5)“碳化结晶”时发生反应的离子方程式为 ,最后一步系列操作主要是 。
20.(2023·巴中模拟)某废铁铬催化剂(含Fe3O4、Cr2O3、MgO、Al2O3及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
已知:i.0.1mol·L-1金属离子形成氢氧化物沉淀与氢氧化物沉淀溶解的pH范围如下:
金属离子
Fe3+
Al3+
Cr3+
Fe2+
Mg2+
开始沉淀的pH
1.5
4.0
4.6
7.6
9.5
沉淀完全的pH
2.8
5.2
6.8
9.7
11.1
金属氢氧化物
Al(OH)3
Cr(OH)3
开始溶解的pH
7.8
12
溶解完全的pH
10.8
>14
ii.Cr(OH)3+OH-=+2H2O
iii.已知Cr的金属性强于Fe
(1)加入铁粉后,调节pH的范围为 。
(2)由滤渣1得到滤液3发生反应的离子方程式为 。
(3)滤渣3成分的化学式为 ;回收铬时,铬的存在形式为 (填化学式)。
(4)由滤液2得到结晶水合物的操作是 、 过滤、洗涤、干燥。
(5)滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为 ;该过程加入少量CaO的目的是 。
(6)酸浸过程中,在硫酸用量一定的情况下,随着酸浓度的增加,铁、铬的溶解度增大。实际生产中,硫酸的质量分数为50%,其原因是 。(已知,Fe2(SO4)3▪ 9H2O,Cr2(SO4)3·18H2O在20℃时的溶解度分别为400g和64g)
21.(2022高三上·安徽期末)利用软锰矿(主要成分是,其中还含有少量、、、等杂质)制取高纯硫酸锰的工艺流程如下图所示。
已知:常温下,一些金属氢氧化物沉淀时的如下表:
氢氧化物
开始沉淀
1.5
6.5
7.7
3.8
沉淀完全
3.7
9.7
9.8
5.2
常温下,一些难溶电解质的溶度积常数如下表:
难溶电解质
回答下列问题:
(1)“浸取”时,铁屑与反应生成的离子方程式为 ;“浸出液”需要鼓入一段时间空气后,再进行“沉铁”的原因是 。
(2)“沉铁、铝”时,加控制溶液范围是 ;完全沉淀时,金属离子浓度为,则常温下 。
(3)深度除杂中加入可以除去钙离子、镁离子的原因是 (用平衡移动原理解释,已知:可以认为反应几乎完全进行)。
(4)用石墨和金属作电极,电解硫酸锰溶液可以制取金属锰,其中金属应与电源 (填“正”或“负”)极相连;阳极产生标准状况下体积为气体时,理论上可以制取 。
22.(2023高三下·辽宁月考)五氧化二钒(V2O5)是一种重要的工业催化剂,可采用以下两种途径制备V2O5。
已知:① +2H+= +H2O。②NH4VO3微溶于冷水,易溶于热水,难溶于乙醇。回答下列问题:
(1) 的空间结构为 。
(2)途径Ⅰ“浸取”得到的浸出液中含钒物质的化学式是 ,滤渣①为 。(填化学式)。
(3)途径Ⅱ“浸取”时,可产生VO2+ ,写出V2O4发生反应的离子方程式:
(4)途径Ⅱ“氧化”时,除了Fe2+ 被氧化外,还有 离子被氧化,写出此离子被氧化的离子方程式: 。
(5)“沉钒”时温度需要控制在60℃左右,其原因是 ;已知:室温下,Kap (NH4 VO3)=1.6×10-3、Kap[Ca(VO3)2]=4×10-6,向偏钒酸铵(NH4VO3 )的悬浊液中加入CaCl2,当c(Ca2+)=1 mol·L-1时,溶液中的c()=
答案解析部分
1.B
A.HBr中H-Br键为极性共价键,故A不符合题意;
B.Na2O2属于强电解质,由钠离子和过氧根离子组成,过氧根离子中O-O之间存在非极性共价键,故B符合题意;
C.KOH为强碱,属于强电解质,氢氧根离子中存在极性共价键,不含非极性键,故C不符合题意;
D.氯化铵属于盐,是强电解质,铵根离子中N-H键为极性共价键,不含非极性键,故D不符合题意;
故B。
相同的非金属原子为非极性共价键结合,不同的非金属原子为极性共价键结合;
强电解质:常见的有强酸、强碱、盐、活泼金属氧化物。
2.B
A.冰是H2O,属于电解质,A不符合题意;
B.干冰是CO2,属于非电解质,B符合题意;
C.可燃冰是混合物,既不是电解质,也不是非电解质,C不符合题意;
D.冰醋酸是CH3COOH,属于电解质,D不符合题意;
故B。
非电解质是指在水溶液中和熔融状态下均不导电的化合物。
3.B
A.“焰色试验”过程中没有产生新物质,所以开幕式的绚丽烟花利用的“焰色试验”是物理变化,A不符合题意;
B.氯化钠是电解质,运动员需要补充的NaCl溶液属于混合物,不是电解质,也不是非电解质,B符合题意;
C.18k金是黄金含量至少达到75%的合金,因此制作奖杯的材料之一18K金是合金,C不符合题意;
D.聚酯纤维面料由有机二元酸和二元醇缩聚而成的聚酯经纺丝所得的合成纤维,因此足球赛服材料聚酯纤维属于有机高分子材料,D不符合题意;
故B。
A.焰色反应过程中没有产生新物质;
B.电解质是指在水溶液中或熔融状态下能导电的化合物;
C.合金是由金属元素跟其他金属或非金属元素熔合而成的、具有金属特性的物质;
D.聚酯纤维为有机合成高分子,属于有机高分子材料。
4.A
A.氨水即氨气的水溶液,由于H2OH++OH-,故存在H+,A符合题意;
B.碘酒即I2的酒精溶液,溶液中不发生电离,故不存在H+,B不合题意;
C.熔融NaHSO4发生电离,电离出Na+和,不存在H+,C不合题意;
D.三氯甲烷为非电解质,不能发生电离,不存在H+,D不合题意;
故A。
根据电解质是否能电离出氢离子分析。
5.C
A.强电解质是指在水溶液中能够完全电离的化合物,即溶于水的部分可以完全变成阴阳离子的化合物,一般是强酸、强碱和大部分盐类;硫酸钡为强电解质,A不符合题意;
B.CCl4的充填模型中,氯原子半径大于碳原子,B不符合题意;
C.同素异形体是同种元素组成的单质;和互为同素异形体,C符合题意;
D.HClO的结构式为H-O-Cl,D不符合题意;
故C。
A.强电解质是指在水溶液中能够完全电离的化合物,一般是强酸、强碱和大部分盐类;
B.氯原子半径大于碳原子;
C.同素异形体是同种元素组成的不同单质;
D.依据价键规律判断。
6.C
A.加入20.00mL等浓度的NaOH溶液时生成,因此M点主要溶质为,A不符合题意;
B.N点溶液中溶质为,溶液pH=10,酚酞的变色范围是pH8.2~10,因此N点可用酚酞作指示剂指示滴定终点,B不符合题意;
C.N点溶液中溶质为,溶液pH=10,溶液呈碱性,说明的水解程度大于电离程度,因此,C符合题意;
D.M→N过程中和的混合溶液,则混合溶液中电荷守恒式为:,D不符合题意;
故C。
A.M点酸碱的物质的量相等,二者恰好完全反应生成NaH2PO4;
B.N点溶质为,混合溶液pH=10;
D.根据电荷守恒分析。
7.C
A.根据计算可知,在直线上面的点,浓度熵均小于其对应的溶度积Ksp,不会生成沉淀,A错误;
B.根据溶度积表达式可知,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-),Ksp(AgCl)=c(Ag+)·c(Cl),代入数据计算可知,二者的溶度积不相等,B项错误;
C.该反应的平衡常数表达式为K=,分子分母同时乘以c2(Ag+),可得K=,C项正确;
D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8和10-5.35,说明此时沉淀Cl-需要的银离子浓度更低,所以,先出现AgCl沉淀;D项错误;
故C。
根据图像,由(1.7,5)可得到Ag2CrO4的溶度积Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(1×10-5)2×1×10-1.7=10-11.7,由(4.8,5)可得到AgCl的溶度积Ksp(AgCl)=c(Ag+)·c(Cl)=1×10-5×1×10-4.8=10-9.8,据此解答即可。
8.C
A.,M点,,,,A不符合题意;
B.温度升高,增大,减小,曲线交点M会向左移动,B不符合题意;
C.,,C符合题意;
D.,,,,,D不符合题意;
故C。
A.选择M点,利用计算;
B.依据影响电离平衡的因素分析;
C.依据水解方程式,利用变形法计算;
D.利用和计算。
9.C
A.由图 的二元酸 溶液中HA-占90%,A2-占10%,没有H2A分子,说明第一步全电离, 在水中电离的方程式为: , ,A不符合题意;
B.当V(NaOH)=0mL时,20.00mL0.1mol/L的二元酸H2A溶液中H2A的第一步电离为完全电离,溶液中不存在H2A,根据物料守恒c(HA-)+c(A2-)=0.1mol/L,B不符合题意;
C.当 时,得到的溶液是NaHA溶液,根据电荷守恒有c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),由pH曲线可知,此时溶液呈酸性,即c(H+)> c(OH-),则c(Na+) c(OH-),则 ,D不符合题意;
故C。
A.20.00mL0.1mol⋅L-1的二元酸H2A溶液pH=1,则H2A第一步完全电离;
B.根据物料守恒分析;
D.当V(NaOH)=30.00 mL时,溶质为NaHA和Na2A,且溶液呈酸性,结合电荷守恒分析。
10.C
A. 溶液中根据电荷守恒有c(H+)=c(OH−)+2c(A2−)+ c(HA−),则c(H+)-c(OH−)-c(A2−)= c(A2−)+c(HA−),故A不符合题意;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(OH−)+2c(A2−)+c(HA−),至中性时c(H+)=c(OH−),则c(Na+)=2c(A2−)+ c(HA−),若用去10mLNaOH,反应得到NaHA溶液,溶液显酸性,因而滴加至中性时,用去 溶液的体积大于 ,故B不符合题意;
C.当用去 溶液时,得到NaHA溶液,根据质子守恒有c(H+)-c(A2−)=c(OH−),则 ,故C符合题意;
D.当用去 溶液时,得到Na2A溶液,根据物料守恒有c(Na+)=2c(HA-)+2c(A2−),故D不符合题意;
故C。
A.H2A为弱酸,根据电荷守恒进行分析。
B.滴加至中性,则c(H+)=c(OH−),结合电荷守恒进行分析。
C.用去 溶液时,得到NaHA溶液,结合质子守恒进行分析。
D.用去 溶液时,得到Na2A溶液面结合物料守恒进行分析。
11.C
A.根据题干信息,Ksp(FeS)>Ksp(CuS),说明一定条件下FeS的溶解度较大,则FeS固体能用于去除工业废水中的Cu2+,A不符合题意;
B.当两种沉淀共存时,,B不符合题意;
C.CuS饱和溶液中存在溶解平衡:CuS(s)可逆Cu2+(aq)+S2-(aq),加入CuCl2固体,c(Cu2+)增大,利于平衡逆向移动,温度不变,则Ksp(CuS)不变,滤液中一定存在,C符合题意;
D.H2S溶液中Ka1·Ka2==1×10-21,CuS饱和溶液中有Ksp(CuS)=c(Cu2+)·c(S2-),若CuS易溶于稀盐酸,则其反应是CuS+2H+可逆Cu2++H2S,平衡常数K=,由此说明,CuS与稀盐酸的反应几乎不能发生,
D不符合题意;
故C。
A.相同条件下,物质的溶度积越大,则其溶解度越大。
B.当两种沉淀共存时,。
C.注意温度不变,物质的溶度积不变,结合化学平衡影响因素进行分析。
D.根据弱电解质电离平衡常数、化学平衡常数、物质溶度积公式进行分析。
12.B
A.室温下,0.10mol/L丙酸溶液的pH值为3.3,,则丙酸的电离常数约为≈2.5×,数量级为,故A不符合题意;
B.a、b、c、d四点溶液中c点丙酸和氢氧化钠恰好反应生成正盐乙酸钠,对水的电离促进作用最大,故四点溶液中水的电离程度最大的是c点,故B符合题意;
C.a点加入10mL0.10 mol·L-1 NaOH溶液,所得溶液为等量的丙酸和丙酸钠,此时溶液显酸性,丙酸电离大于丙酸钠水解,则溶液中存在,故C不符合题意;
D.d点加入30mL0.10 mol·L-1 NaOH溶液,所得溶液为丙酸钠和过量的氢氧化钠,且两者的物质的量之比为2:1,根据电荷守恒可知:,根据物理守恒可知:,两式联立可得:,故D不符合题意。
故B。
A.根据计算;
C.a点溶液为等量的丙酸和丙酸钠,显酸性;
D.d点为丙酸钠和氢氧化钠的混合溶液,结合电荷守恒和物料守恒分析。
13.C
A.溶液中的亚硫酸根离子也能与硝酸钡溶液反应生成亚硫酸钡白色沉淀,加入足量盐酸,酸性条件下硝酸根离子将亚硫酸钡沉淀氧化为硫酸钡沉淀,所以向某溶液中加入硝酸钡溶液产生白色沉淀,再加足量盐酸仍有白色沉淀不能说明原溶液中含有硫酸根离子,故A不符合题意;
B.过量的氯化铁溶液与碘化钾溶液反应后,溶液中含有铁离子,加入硫氰化钾溶液,溶液会变为红色,则溶液变红不能说明氯化铁溶液与碘化钾溶液的反应为可逆反应,故B不符合题意;
C.将足量二氧化硫通入碳酸钠溶液中逸出的气体先通入足量的酸性高锰酸钾溶液吸收二氧化硫,排出二氧化硫对二氧化碳检验的干扰,再通入澄清石灰水中变浑浊说明二氧化硫能与碳酸钠溶液反应生成二氧化碳气体,亚硫酸的一级电离程度大于碳酸,一级电离常数大于碳酸一级电离常数,故C符合题意;
D.酸性条件下葡萄糖不能与新制氢氧化铜悬浊液反应,则向蔗糖溶液中加入适量稀硫酸,水浴加热,冷却后未加入氢氧化钠溶液中和稀硫酸,直接向溶液中滴加新制氢氧化铜悬浊液,加热不可能产生砖红色沉淀,则未出现砖红色沉淀不能说明蔗糖未水解,故D不符合题意;
故C。
A.酸性条件下,硝酸根具有强氧化性,若溶液中含有亚硫酸根,也能产生相同的实验现象;
B.该实验中氯化铁过量,溶液中始终存在铁离子;
D.蔗糖水解后,应在碱性环境中检验葡萄糖。
14.C
A.铯为碱金属,其金属性强于金,则金化铯()中金元素显价,A不符合题意;
B.金化铯溶于液氨形成黄色溶液,表现出较高的导电率,说明在液氨中会发生电离,B不符合题意;
C.金化铯()中金为-1价,具有强还原性,遇氧化性物质会生成金单质和铯的化合物,在空气中易被氧化,C符合题意;
D.金化铯()与水发生氧化还原反应,生成氢氧化铯、金和氢气,其化学方程式为,D不符合题意;
故C。
A.化合物中,金属元素常显正价,各元素的正负化合价代数和为0。
B.可通过导电率验证物质能发生电离。
C.金化铯()中金为-1价,具有强还原性。
D.金化铯()与水反应生成氢氧化铯、金和氢气。
15.D
A.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;部分元素的电负性:Cl>S>H,A不符合题意;
B.a越大则Ka越小,对应酸性越弱;由图表可知,在液态醋酸中,酸性:HClO4>H2SO4>HCl>HNO3,B不不符合题意;
C.H2SO4酸性大于HCl,则在液态醋酸中,H2SO4更容易电离出氢离子,给出质子,故,C不符合题意;
D.HNO3在液态醋酸中的电离方程式为CH3COOH+ HNO3⇌CH3COOH+ NO,D符合题意;
故D。
A.元素的非金属性越强,电负性越大;
B.电离平衡常数越大,酸性越强;
C.在液态醋酸中,H2SO4更容易电离出氢离子。
16.C
A.由分析可知,曲线①表示H2C2O4的物质的量分数δ(X)随pH变化关系,A不符合题意;
B.在曲线的第一个交叉点,pH=1.2,c()=c(H2C2O4),Ka1=1.0×10-1.2,在曲线的第二个交叉点,pH=4.2,c()=c(),Ka2=1.0×10-4.2,NaHC2O4溶液中,Kh2==1.0×10-12.8<Ka2=1.0×10-4.2,则溶液显酸性,溶液中c(OH-)<c(H+),B不符合题意;
C.依据电荷守恒c(Na+)+c(H+)=c()+2c()+c(OH-),依据物料守恒,c(Na+)=c()+c()+c(H2C2O4),则c()+c(OH-)=c(H+)+c(H2C2O4),C符合题意;
D.反应H2C2O4+2的化学平衡常数K====103,D不符合题意;
故C。
pH越小,H2C2O4的浓度越大,随着pH增大, 的物质的量分数先增大后减小, 的物质的量分数增大,则曲线①表示H2C2O4的物质的量分数δ(X)随pH变化关系,曲线②表示的物质的量分数δ(X)随pH变化关系,曲线③表示的物质的量分数δ(X)随pH变化关系。
17.(1)锥形瓶;升温,搅拌等
(2)浓氨水分解和挥发;双氧水分解;冰水浴
(3)玻璃棒没有紧靠三层滤纸处,漏斗末端较长处(尖嘴部分)没有紧靠在“盛滤液”的烧杯内壁
(4)活性炭
(5)利用同离子效应,促进钴配合物[Co(NH3)6]Cl3尽可能完全析出,提高产率
(1)仪器a为锥形瓶,加速溶解的方法有:加热、搅拌等操作;
(2)步骤Ⅱ中使用了浓氨水和双氧水,他们高温下易挥发,易分解,所以控制在10℃以下;要控制温度在10℃以下,通常采用冰水浴降温;
(3)玻璃棒没有紧靠三层滤纸处,可能戳破滤纸,造成过滤效果不佳。还有漏斗末端较长处(尖嘴部分)没有紧靠在“盛滤液”的烧杯内壁,可能导致液滴飞溅;
(4)步骤中使用了活性炭,为难溶物,所以过滤的不溶物为活性炭;
(5)根据反应方程可知,由于钴配合物为[Co(NH3)6]Cl3中含有氯离子,加入4mL浓盐酸,可利用同离子效应,促进钴配合物[Co(NH3)6]Cl3尽可能完全析出;
称取2.0g氯化铵,用5mL水溶解后,分批加入3.0g CoCl2·6H2O后,降温,在加入1g活性炭,7mL浓氨水,搅拌下逐滴加入10mL 6%的双氧水,加热反应20min,反应完成后,冷却,过滤,钴配合物在冷水中会析出固体,过滤所得固体为钴配合物[Co(NH3)6]Cl3和活性炭的混合物,将所得固体转入有少量盐酸的沸水中,趁热过滤,除去活性炭,将滤液转入烧杯中,加入浓盐酸,可促进钴配合物[Co(NH3)6]Cl3析出,解答即可。
18.(1)+3价;1s22s22p63s23p63d6或[ Ar]3d6
(2)水浴加热;温度过高,会使加快H2O2的分解和浓盐酸的挥发
(3)2CoCl2 + 10NH3·H2O +2NH4Cl+ H2O2=2[ Co( NH3)6]Cl3 + 12H2O
(4)降低[ Co( NH3 )6]Cl3的溶解度,便于晶体的析出
(5)滴入最后半滴标准液,溶液中出现砖红色沉淀,半分钟内不消失;
(1)[Co(NH3)6]Cl3中NH3为配体,氯的化合价为-1价,则Co的化合价是+3价,Co的原子序数是27,基态Co原子核外电子排布式为[Ar]3d74s2,失去3个电子形成该配合物中心离子Co3+,核外电子排布式为1s22s22p63s23p63d6或[ Ar]3d6;
(2)“加热”应控温在60℃进行,控温方式可采取水浴加热;温度不宜过高的原因是温度过高,会使加快H2O2的分解和浓盐酸的挥发;
(3)溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[ Co(NH3)6]Cl3的化学方程式是:2CoCl2 + 10NH3·H2O +2NH4Cl+ H2O2=2[ Co( NH3)6]Cl3 + 12H2O;
(4)加入浓盐酸可增大氯离子浓度,作用是降低[ Co( NH3 )6]Cl3的溶解度,便于晶体的析出;
(5)①由题可知:AgCl的溶解度小于Ag2CrO4的溶液度,所以在滴加AgNO3时Ag+会与Cl-反应生成AgCl沉淀,当Cl-消耗完时再与结合,所以滴定终点时是Ag+与结合生成砖红色沉淀,故滴入最后半滴标准液,溶液中出现砖红色沉淀,半分钟内不消失;
②由AgCl沉淀的化学式可知:反应时Ag+与Cl-物质的量之比为1:1,滴定时消耗AgNO3的物质的量为cmol/L×V×10-3L=cV×10-3mol,则20mL溶液中Cl-物质的量为cV×10-3mol,100mL溶液中Cl-的质量为:m=n×M=cV×10-3mol×35.5g/mol×=5×35.5cV×10-3g,故质量分数为:。
(1)根据化合价的代数和为0;依据构造原理分析;
(2)依据反应条件确定控温方式;依据反应物和试剂的性质分析;
(3)根据反应物和生成物的化学式,利用原子守恒分析;
(4)依据影响溶解平衡的因素分析;
(5)①利用溶液颜色变化分析;
②通过关系式法计算。
19.(1)除去矿物中的硫元素(或将硫化物转变为金属氧化物)
(2)MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;Fe2+完全沉淀时Mn2+已经完全沉淀,造成Mn2+损失
(3)5.2≤pH
相关试卷
这是一份2024届新高考化学第一轮专项训练复习——元素或物质推断题(含解析),共32页。试卷主要包含了固体矿物X由三种元素组成等内容,欢迎下载使用。
这是一份2024届新高考化学第一轮专项训练复习——水的电离和溶液的pH(含解析),共15页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
这是一份高考化学二轮专题复习专题7 电解质溶液 (含解析),共38页。试卷主要包含了三大平衡影响因素,pH的计算思路,酸碱中和滴定,沉淀溶解平衡的三类应用等内容,欢迎下载使用。








