

高考化学易忘知识点常记忆
展开
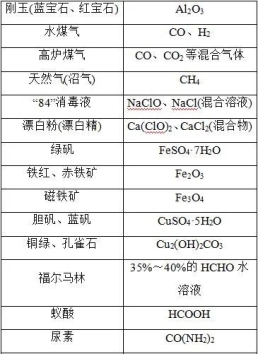
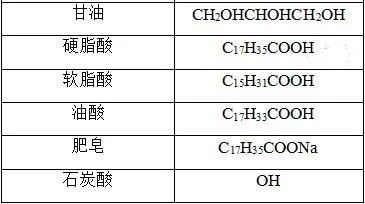
常见物质的俗名及成分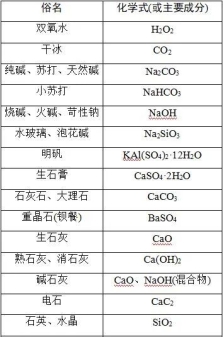
 特殊的物理性质(1)易液化的物质常压下SO2(-10 ℃)、NH3(-33.5 ℃)、Cl2(-34.6 ℃)(2)SO3熔点和沸点都很低,标准状况下是一种无色晶体。(3)单质溴易挥发,单质碘易升华(4)易潮解的物质NaOH、MgCl2、CaCl2。(5)气体溶解性归纳难溶于水:H2、N2、CO、NO、CH4、C2H4;微溶于水:O2、C2H2;较易溶于水:Cl2(1∶2)、H2S(1∶2.6)、CO2(1∶1)、SO2(1∶40);极易溶于水:HF、HCl、HBr、HI、NH3等。(6)物质的气味有刺激性气味的气体:HCl、NH3、Cl2、SO2(7)常温下,常见的固体单质:I2、S、P、C、Si、金属单质。图片特殊化学性质物质(1)具有毒性的物质①有毒的非金属单质:F2、Cl2、Br2、I2、白磷。②常见的有毒气体化合物:CO、NO、NO2、SO2、H2S。③能与血红蛋白结合的气体化合物:CO和NO。(2)具有漂白性的物质①氧化型:HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等。利用物质的强氧化性,漂白彻底,不可逆。②加合型:SO2与有机色素加成,不稳定,可逆。③吸附型:活性炭、胶体。活性炭疏松、多孔、表面积大,其漂白原理为物理吸附。(3)具有强吸水性的物质①浓硫酸吸收游离态的水,常用作干燥剂,但不能干燥NH3、H2S、HBr、HI等。②五氧化二磷(P2O5):磷酸或偏磷酸的酸酐,具有强烈的吸水性,可作酸性气体的干燥剂。③氯化钙:在空气中极易潮解,可作一般气体的干燥剂,但不能干燥氨气,因为会与氨气发生络合反应。④碱石灰:生石灰与氢氧化钠固体加热处理而得,具有吸水性,可作碱性气体的干燥剂。(4)强氧化性酸:主要是浓硫酸、硝酸。(5)碱性气体:氨气。(6)既能与强酸反应,又能与强碱反应的物质Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2S]、氨基酸、蛋白质等。 特殊反应条件(1)条件是“光照”的反应①次氯酸分解②氢气与氯气化合(也可以是点燃)③硝酸分解(受热也能分解)④AgCl、AgBr、AgI分解⑤甲烷与氯气发生取代反应(2)中学化学中常见的使用催化剂的无机反应
特殊的物理性质(1)易液化的物质常压下SO2(-10 ℃)、NH3(-33.5 ℃)、Cl2(-34.6 ℃)(2)SO3熔点和沸点都很低,标准状况下是一种无色晶体。(3)单质溴易挥发,单质碘易升华(4)易潮解的物质NaOH、MgCl2、CaCl2。(5)气体溶解性归纳难溶于水:H2、N2、CO、NO、CH4、C2H4;微溶于水:O2、C2H2;较易溶于水:Cl2(1∶2)、H2S(1∶2.6)、CO2(1∶1)、SO2(1∶40);极易溶于水:HF、HCl、HBr、HI、NH3等。(6)物质的气味有刺激性气味的气体:HCl、NH3、Cl2、SO2(7)常温下,常见的固体单质:I2、S、P、C、Si、金属单质。图片特殊化学性质物质(1)具有毒性的物质①有毒的非金属单质:F2、Cl2、Br2、I2、白磷。②常见的有毒气体化合物:CO、NO、NO2、SO2、H2S。③能与血红蛋白结合的气体化合物:CO和NO。(2)具有漂白性的物质①氧化型:HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等。利用物质的强氧化性,漂白彻底,不可逆。②加合型:SO2与有机色素加成,不稳定,可逆。③吸附型:活性炭、胶体。活性炭疏松、多孔、表面积大,其漂白原理为物理吸附。(3)具有强吸水性的物质①浓硫酸吸收游离态的水,常用作干燥剂,但不能干燥NH3、H2S、HBr、HI等。②五氧化二磷(P2O5):磷酸或偏磷酸的酸酐,具有强烈的吸水性,可作酸性气体的干燥剂。③氯化钙:在空气中极易潮解,可作一般气体的干燥剂,但不能干燥氨气,因为会与氨气发生络合反应。④碱石灰:生石灰与氢氧化钠固体加热处理而得,具有吸水性,可作碱性气体的干燥剂。(4)强氧化性酸:主要是浓硫酸、硝酸。(5)碱性气体:氨气。(6)既能与强酸反应,又能与强碱反应的物质Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2S]、氨基酸、蛋白质等。 特殊反应条件(1)条件是“光照”的反应①次氯酸分解②氢气与氯气化合(也可以是点燃)③硝酸分解(受热也能分解)④AgCl、AgBr、AgI分解⑤甲烷与氯气发生取代反应(2)中学化学中常见的使用催化剂的无机反应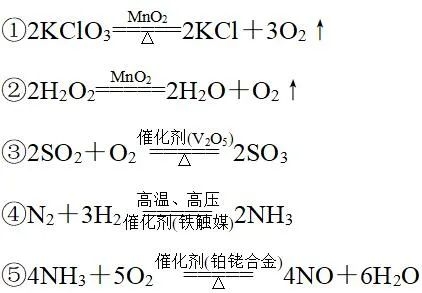 (3)条件是放电的反应:N2与O2化合生成NO。 特殊实验现象(1)燃烧时火焰的颜色①苍白色:H2在Cl2中燃烧。②蓝色:CO在空气中燃烧。③淡蓝色:H2S、CH4、H2在空气中燃烧。④黄色:含钠元素的物质在灯焰上灼烧。⑤浅紫色(透过蓝色钴玻璃):含钾元素的物质在灯焰上灼烧。(2)沉淀现象①在溶液中反应有黄色沉淀生成的有Ag+与Br-(浅黄色)、I-,S2O32-与H+,H2S或Na2S溶液与一些氧化性物质(Cl2、O2、SO2等),Ag+与PO43-。②向某溶液中滴入碱液,先生成白色沉淀,后迅速变为灰绿色,最后变为红褐色,则溶液中一定含有Fe2+。③与碱产生红褐色沉淀的必是Fe3+。④产生黑色沉淀的是Fe2+、Cu2+、Pb2+与S2-。⑤与碱反应生成白色沉淀的一般是Mg2+和Al3+,若加过量NaOH溶液沉淀不溶解,则是Mg2+,沉淀溶解则是Al3+。⑥加过量酸产生白色胶状沉淀的是SiO32-。(3)放气现象①与稀盐酸反应生成刺激性气味的气体,且该气体可使品红溶液褪色,该气体一般是SO2,则原溶液中含有SO32-或HSO3-。②与稀盐酸反应生成无色气体,且该气体可使澄清石灰水变浑浊,该气体可能是CO2或SO2。③与碱溶液反应且加热时产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝,该气体是NH3,原溶液中一定含有NH4+。(4)变色现象①Fe3+与SCN-、Fe、Cu反应时颜色的变化。②遇空气迅速由无色变为红棕色的气体必为NO。③Fe2+与Cl2、Br2等氧化性物质反应时颜色的变化。④酸碱性溶液遇指示剂的变化。⑤品红溶液与Cl2、SO2等漂白剂的作用。⑥淀粉溶液遇碘变蓝。⑦Fe(OH)2在空气中被氧化:由白色迅速变为灰绿色最后变为红褐色。⑧蛋白质(含苯环)遇浓硝酸变黄,被灼烧时有烧焦羽毛的气味。
(3)条件是放电的反应:N2与O2化合生成NO。 特殊实验现象(1)燃烧时火焰的颜色①苍白色:H2在Cl2中燃烧。②蓝色:CO在空气中燃烧。③淡蓝色:H2S、CH4、H2在空气中燃烧。④黄色:含钠元素的物质在灯焰上灼烧。⑤浅紫色(透过蓝色钴玻璃):含钾元素的物质在灯焰上灼烧。(2)沉淀现象①在溶液中反应有黄色沉淀生成的有Ag+与Br-(浅黄色)、I-,S2O32-与H+,H2S或Na2S溶液与一些氧化性物质(Cl2、O2、SO2等),Ag+与PO43-。②向某溶液中滴入碱液,先生成白色沉淀,后迅速变为灰绿色,最后变为红褐色,则溶液中一定含有Fe2+。③与碱产生红褐色沉淀的必是Fe3+。④产生黑色沉淀的是Fe2+、Cu2+、Pb2+与S2-。⑤与碱反应生成白色沉淀的一般是Mg2+和Al3+,若加过量NaOH溶液沉淀不溶解,则是Mg2+,沉淀溶解则是Al3+。⑥加过量酸产生白色胶状沉淀的是SiO32-。(3)放气现象①与稀盐酸反应生成刺激性气味的气体,且该气体可使品红溶液褪色,该气体一般是SO2,则原溶液中含有SO32-或HSO3-。②与稀盐酸反应生成无色气体,且该气体可使澄清石灰水变浑浊,该气体可能是CO2或SO2。③与碱溶液反应且加热时产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝,该气体是NH3,原溶液中一定含有NH4+。(4)变色现象①Fe3+与SCN-、Fe、Cu反应时颜色的变化。②遇空气迅速由无色变为红棕色的气体必为NO。③Fe2+与Cl2、Br2等氧化性物质反应时颜色的变化。④酸碱性溶液遇指示剂的变化。⑤品红溶液与Cl2、SO2等漂白剂的作用。⑥淀粉溶液遇碘变蓝。⑦Fe(OH)2在空气中被氧化:由白色迅速变为灰绿色最后变为红褐色。⑧蛋白质(含苯环)遇浓硝酸变黄,被灼烧时有烧焦羽毛的气味。





