

高中化学专题之混合物的化学分离和提纯方法归纳
展开
物质的分离是指将混合物中的不同物质分开,而且各物质还要保持原来的化学成分和物理状态;物质的提纯是指将混合物净化除去其杂质,得到混合物中的主体物质,提纯后的杂质不必考虑其化学成分和物理状态。
混合物的分离方法有许多种,但根据其分离的本质可分为两大类,一类是化学分离法,另一类就是物理法,下面就混合物的化学分离和提纯方法归纳如下: 一、分离和提纯的原则: 1.引入的试剂一般只跟杂质反应。 2.后续的试剂应除去过量的前加的试剂。 3.不能引进新物质。 4.杂质与试剂反应生成的物质易与被提纯物质分离。 5.过程简单,现象明显,纯度要高。 6.尽可能将杂质转化为所需物质。 7.除去多种杂质时要考虑加入试剂的合理顺序。 8.如遇到极易溶于水的气体时,要防止倒吸现象的发生。 二、分离和提纯常用的化学方法: 1.加热法:当混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去。如NaCl中混有NH4Cl,Na2CO3中混有NaHCO3等均可直接加热除去杂质。 2.沉淀法:在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。使用该方法一定要注意不能引入新的杂质。若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂的过量部分除去,最后加的试剂不引入新的杂质。如加适量的BaCl2溶液可除去NaCl中混有的Na2SO4。 3.酸碱法:被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。如用盐酸除去SiO2中的CaCO3,用氢氧化钠溶液除去铁粉中的铝粉等。 4.氧化还原反应法:如果混合物中混有还原性杂质,可加入适当的氧化剂使其被氧化为被提纯物质。如将氯水滴入混有FeCl2的FeCl3溶液中,以除去FeCl2杂质;同样如果混合物中混有氧化性杂质,可加入适当的还原剂使其被还原为被提纯物质。如将过量的铁粉加入混有FeCl3的FeCl2溶液中,以除去FeCl3杂质。 5.转化法:不能通过一次达到分离目的的,需要经过多次转化,将其转化成其它物质才能分离,然后再将转化的物质恢复为原物质。如分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,再加入盐酸重新生成 Fe3+和Al3+。在转化的过程中尽量减少被分离物质的损失,而且转化物质要易恢复为原物质。 6.调节pH法:通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般是加入相应的难溶或微溶物来调节。如在CuCl2溶液中含有FeCl3杂质,由于FeCl3的水解,溶液是酸性溶液,就可采用调节pH的方法将Fe3+沉淀出去,为此,可向溶液中加入CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。 7.电解法:利用电解原理来分离提纯物质,如电解精炼铜,就是将粗铜作阳极,精铜作阴极,用含铜离子的溶液作电解液,在直流电的作用下,粗铜中比铜活泼的杂质金属失去电子,在阴极只有铜离子得到电子析出,从而提纯了铜。 【例题1】下列实验设计和结论相符的是( )。 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 解析:乙醇不可以作为萃取剂,A项错;石蕊变蓝,则肯定为碱性,B项正确。若原溶液中含有SO32-,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,C项错;加热时,FeCl3会水解,D项错。 答案:B 【例题2】下列除去杂质的方法正确的是( )。 A.除去CO2中混有的CO:用澄清石灰水洗气 B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤 C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 解析:CO2可以被澄清石灰水吸收,而CO不可以,故A项错。盐酸可以将BaCO3反应除去,而不能溶解BaSO4,故B项错;C项,2FeCl3 + Fe = 3FeCl2,过量的铁过滤,即可除去,正确;Cu和CuO均可以被HNO3溶解,故D项错。 答案:C 【例题3】下列说法正确的是( )。 A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 C.乙酸与乙醇的混合溶液可用分液漏斗进行分离 D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准润洗,则测定结果偏低 解析:A项,还需要用稀HNO3,看沉淀是否溶解,故错;B项,冷却速度慢,则易析出晶体,越慢晶体析出越大,正确。C项,乙醇和乙酸是互溶的,不分层,所以无法用分液法分离,故错;D项,未润洗酸式滴定管,相当稀释了盐酸,所用标准HCl体积增大,则计算出的NaOH浓度偏大,故错。 答案:B 【例题5】下列化学实验事实及其解释都正确的是( )。 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 C.向0.1 mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 D. 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 解析:A项,是高中化学必修1中的一个很重要的实验——萃取实验;B项的叙述是错误的,在该实验中根本得不到白色沉淀,因为亚硫酸不可能制取盐酸;C项只能说明Fe2+具有还原性,因为KMnO4具有强氧化性,常做氧化剂。D项,沉淀呈黄色,说明沉淀是AgI,也就意味着AgCl的Ksp比AgI的大。 答案:A、D 【例题6】工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是( )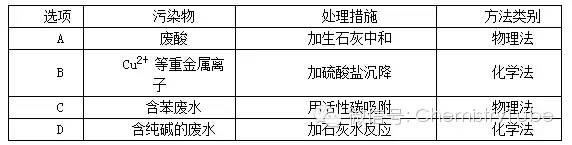 解析:废酸与碱中和属于化学法,A项错;Cu2+不可能用SO42 -沉降,B项错;活性碳无法吸收苯,C项错; Na2CO3 + Ca(OH)2 ====CaCO3↓+ 2NaOH,是复分解法,属于化学法,D项正确· 答案:D
解析:废酸与碱中和属于化学法,A项错;Cu2+不可能用SO42 -沉降,B项错;活性碳无法吸收苯,C项错; Na2CO3 + Ca(OH)2 ====CaCO3↓+ 2NaOH,是复分解法,属于化学法,D项正确· 答案:D





