所属成套资源:新教材2023版高中化学新人教版必修第二册全一册学案打包36套
高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案
展开
这是一份高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案,共3页。
实验活动7 化学反应速率的影响因素实验目的1.体验浓度、温度和催化剂对化学反应速率的影响。2.理解改变反应条件可以调控化学反应的速率。实验原理1.硫代硫酸钠与硫酸的反应硫代硫酸钠与硫酸反应会生成不溶于水的硫:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O比较黄色浑浊(S)现象出现所需时间的长短,可以判断该反应进行的快慢。2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。实验用品器材:烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。试剂:0.1 mol·L-1 Na2S2O3溶液、0.1 mol·L-1H2SO4溶液、10% H2O2溶液、1 mol·L-1 FeCl3溶液、MnO2粉末、蒸馏水。实验过程和结论1.浓度对化学反应速率的影响实验操作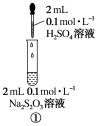
 同时向上述两支试管中加入2 mL 0.1 mol·L-1H2SO4溶液,振荡实验现象产生浑浊现象出现所需时间①______②实验结论反应物的浓度越大反应速率________ 2.温度对化学反应速率的影响实验操作
同时向上述两支试管中加入2 mL 0.1 mol·L-1H2SO4溶液,振荡实验现象产生浑浊现象出现所需时间①______②实验结论反应物的浓度越大反应速率________ 2.温度对化学反应速率的影响实验操作
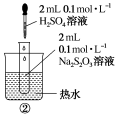 同时向上述两支试管中加入2 mL 0.1 mol·L-1H2SO4溶液,振荡实验现象产生浑浊现象出现所需时间①______②实验结论温度越高反应速率________ 3.催化剂对化学反应速率的影响实验操作
同时向上述两支试管中加入2 mL 0.1 mol·L-1H2SO4溶液,振荡实验现象产生浑浊现象出现所需时间①______②实验结论温度越高反应速率________ 3.催化剂对化学反应速率的影响实验操作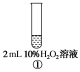
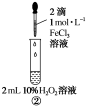
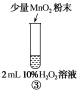 实验现象②③出现气泡明显比①____实验结论____________________________ 问题和讨论1.以锌与稀硫酸反应制取氢气的实验中,为加快生成氢气的速率,通常用锌粉代替锌粒,其原因是什么? 2.请从化学反应快慢的角度解释为什么使用电冰箱保存食物? 强化练习草酸与高锰酸钾在酸性条件下能够发生如下反应:Mn
实验现象②③出现气泡明显比①____实验结论____________________________ 问题和讨论1.以锌与稀硫酸反应制取氢气的实验中,为加快生成氢气的速率,通常用锌粉代替锌粒,其原因是什么? 2.请从化学反应快慢的角度解释为什么使用电冰箱保存食物? 强化练习草酸与高锰酸钾在酸性条件下能够发生如下反应:Mn![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:组别10%硫酸体积/mL温度/℃其他物质Ⅰ220\Ⅱ22010滴饱和MnSO4溶液Ⅲ230\Ⅳ1201 mL蒸馏水(1)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);(2)如果研究温度对化学反应速率的影响,使用实验________和________。(3)对比实验Ⅰ和Ⅳ,可以研究________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是________________________________________________________________________________________________________________________________________________________________________________________________________________。 实验活动7 化学反应速率的影响因素实验过程和结论1.< 越快2.> 越快3.快 催化剂可以加快反应速率问题和讨论1.提示:反应物的接触面积越大,反应速率越快,锌粉的表面积远大于锌粒,用锌粉代替锌粒时,增大了锌与硫酸的接触面积,使生成氢气的速率加快。2.提示:食物腐败是因为发生了化学反应,在其他条件相同时,温度越低,化学反应越慢,人们用电冰箱把食物放置在低温下保存,以减缓食物的腐败。强化练习解析:(1)(2)研究某一因素对化学反应速率的影响时,要保证其他各条件完全相同。(3)对比Ⅰ和Ⅳ,反应的温度、溶液的体积等都相同,仅有c(H+)不同,故可研究c(H+)对反应速率的影响。加1 mL水的目的是确保c(KMnO4)、c(H2C2O3)不变和溶液总体积不变。答案:(1)Ⅰ Ⅱ (2)Ⅰ Ⅲ(3)c(H+)或c(H2SO4)确保所有实验中c(KMnO4)、c(H2C2O4)不变和溶液总体积不变
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:组别10%硫酸体积/mL温度/℃其他物质Ⅰ220\Ⅱ22010滴饱和MnSO4溶液Ⅲ230\Ⅳ1201 mL蒸馏水(1)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);(2)如果研究温度对化学反应速率的影响,使用实验________和________。(3)对比实验Ⅰ和Ⅳ,可以研究________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是________________________________________________________________________________________________________________________________________________________________________________________________________________。 实验活动7 化学反应速率的影响因素实验过程和结论1.< 越快2.> 越快3.快 催化剂可以加快反应速率问题和讨论1.提示:反应物的接触面积越大,反应速率越快,锌粉的表面积远大于锌粒,用锌粉代替锌粒时,增大了锌与硫酸的接触面积,使生成氢气的速率加快。2.提示:食物腐败是因为发生了化学反应,在其他条件相同时,温度越低,化学反应越慢,人们用电冰箱把食物放置在低温下保存,以减缓食物的腐败。强化练习解析:(1)(2)研究某一因素对化学反应速率的影响时,要保证其他各条件完全相同。(3)对比Ⅰ和Ⅳ,反应的温度、溶液的体积等都相同,仅有c(H+)不同,故可研究c(H+)对反应速率的影响。加1 mL水的目的是确保c(KMnO4)、c(H2C2O3)不变和溶液总体积不变。答案:(1)Ⅰ Ⅱ (2)Ⅰ Ⅲ(3)c(H+)或c(H2SO4)确保所有实验中c(KMnO4)、c(H2C2O4)不变和溶液总体积不变
相关学案
这是一份高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素学案设计,共8页。
这是一份人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案,共2页。
这是一份化学必修 第二册实验活动7 化学反应速率的影响因素学案,共3页。学案主要包含了化学反应速率的影响因素等内容,欢迎下载使用。