
新教材2023版高中化学章末小结6第六章化学反应与能量学案新人教版必修第二册
展开章末小结
(一)从宏观和微观结合的角度认识化学能与热能
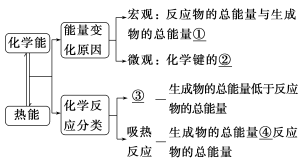
1.请填写出图中序号所示的内容
①____________ ②____________
③____________ ④____________
2.放热反应和吸热反应判断方法
(1)依据能量变化图像判断。反应物的总能量________生成物的总能量,则反应为吸热反应;反之,则为放热反应。
(2)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂吸收的能量________新键形成释放的能量,则为吸热反应;反之,为放热反应。
(二)从氧化还原反应的角度认识化学能与电能
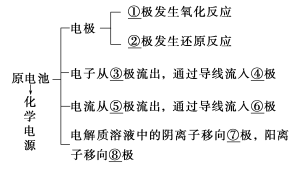
1.请填写出图中序号所示的内容
①______ ②______ ③______ ④______
⑤______ ⑥______ ⑦______ ⑧______
2.原电池正、负极的判断方法
首先准确判断元素化合价的变化,然后根据原电池工作原理判断。
(1)化合价______―→______电子―→发生______反应―→负极。
(2)化合价______―→______电子―→发生______反应―→正极。
(三)从化学反应速率和限度的角度理解化学反应
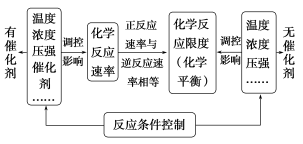
1.化学反应速率及其影响因素
(1)化学反应速率之比等于化学方程式中相应物质的____________之比。
(2)____________、____________、____________、增大固体反应物的表面积均可增大反应速率。
(3)改变压强来影响化学反应速率是通过改变气体反应物浓度而实现的,若压强改变而反应物浓度不变,则化学反应速率________。
2.可逆反应与化学平衡状态
(1)可逆反应必须同时满足两个条件:
①________________________________________________________________________;
②________________________________________________________________________。
(2)判断可逆反应处于化学平衡状态的根本标志:
①________________________相等;
②________________________保持不变。
(四)化学反应速率与化学平衡图像
一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
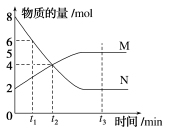
(1)该反应的化学方程式是________________________________________________________________________。
(2)在图上所示的三个时刻中,________(填“t1”“t2”或“t3”)min时刻处于平衡状态,此时v正________v逆(填“>”“<”或“=”);0~t2 min时间段内v(N)________________。
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再改变”________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(填字母)。
A.升高温度
B.降低压强
C.减小N的浓度
D.将反应容器体积缩小
章末小结
(一)
1.①不同 ②断裂和形成 ③放热反应 ④高于
2.(1)小于 (2)大于
(二)
1.①负 ②正 ③负 ④正 ⑤正 ⑥负 ⑦负 ⑧正
2.(1)升高 失去 氧化 (2)降低 得到 还原
(三)
1.(1)化学计量数 (2)升高温度 使用催化剂 增大反应物浓度 (3)不变
2.(1)①相同反应条件 ②正、逆两方向同时进行
(2)①正、逆反应速率 ②各组分的质量或浓度
(四)
解析:(1)由题图知,N不断减少,M不断增加,N是反应物,M是生成物,当反应进行到t3 min时,各种物质都存在,物质的量不变,反应达到平衡状态。在相同的时间内,N减少6 mol,M增加3 mol,二者的物质的量的变化量之比是6∶3=2∶1,故反应的化学方程式是2N⇌M。
(2)t3时刻处于平衡状态,此时v正=v逆。0~t2 min时间段内,v(N)=(8-4) mol÷2 L÷t2 min=![]() mol·L-1·min-1。
mol·L-1·min-1。
(3)已知M、N均为气体,若反应容器的容积不变,由于该反应是反应前后气体体积改变的反应,则“压强不再改变”能作为该反应已达到平衡状态的判断依据。
(4)A项,升高温度,化学反应速率加快;B项,降低压强,物质的浓度减小,反应速率减慢;C项,减小N的浓度,反应速率减慢;D项,将反应容器体积缩小,物质的浓度增大,反应速率加快。
答案:(1)2N⇌M (2)t3 = ![]() mol·L-1·min-1 (3)能 (4)AD
mol·L-1·min-1 (3)能 (4)AD









