
人教版 (2019)必修 第一册第二节 离子反应教学设计
展开![]()
第一节 离子反应
第1课时 教学设计
【教学目标】
1.理解电解质的概念。
2.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
3.能结合实例书写离子方程式。
【教学重难点】
电解质的概念、电解质的电离
【教学过程】
1.新课导入
[师]在日常生活中,用湿手摸开关是很危险的,容易造成触电事故!这是为什么呢?
[学生活动]讨论湿手易触电的原因。
[过渡]这里说的“触电",是指电流流过人体产生的反应。小于30毫安的电流对人体是安全的,大于30毫安的电流流过人体,就会造成伤害了。人体汗腺会分泌大量的汗水,汗水中含有许多容易导电的盐分,这些盐分在潮湿状态下增大了人体的导电性。当大于30毫安的电流流过人体时,往往会触发“电昏”,甚至“电死”,这是强大的电流流过人体造成的伤害。
[设计意图]将生活中的问题转化为化学问题,使学生进入问题情境。
2.新课讲授
第二节 离子反应
[板书]1.电解质的电离
[师]在我们学过的化学反应中,有许多是在水溶液中进行的,如酸、碱、盐之间的反应。那么酸、碱、盐溶于水后发生了什么变化?我们一起来探究吧!
[教师活动]进行实验1-2,探究不同物质的导电性,请学生观察现象。
[学生活动]学生观察,并描述现象,得出结论。
[强调]严格地说,蒸馏水也能导电,只是导电弱,看不到灯泡发光。
[思考讨论]为什么NaCl、KNO3等物质,在干燥时不导电,而溶于水或熔化后导电?
[投影]展示干燥的NaCl固体不导电的微观示意图、NaCl固体在水中溶解和形成水合离子的示意图、熔融NaCl导电示意图
[学生活动]学生思考,并解释上述问题。
[设计意图]引起学生对离子存在形式(是否自由)的关注,从而将其注意力从宏观转向微观。
[师]我们把能在水溶液中或熔融状态下能够导电的化合物称为电解质;在水溶液中和熔融 状态下均不能导电的化合物称为弱电解质。
[获取概念]电解质:在水溶液里或熔融状态下能够导电的化合物。如KNO3、H2SO4、KOH等。
非电解质:在水溶液中和熔融 状态下均不能导电的化合物。如蔗糖、酒精等。
[设疑]哪些物质是电解质?哪些物质是非电解质?
[学生活动]学生回答。
[强调]注意:氨气、二氧化硫、二氧化碳的水溶液能导电,是因为它们与水反应生成电解质NH3·H2O、H2SO3、H2CO3,而氨气、二氧化硫、二氧化碳都是非电解质。氨水是混合物不是电解质。
[学生活动]练习题训练。
[总结]电解质与非电解质的判断。
[过渡]电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。电解质的电离可以用电离方程式表示。
[学生活动]写出酸、碱、盐的电离方程式。
[师]电解质在水溶液中(或熔融状态下)电离产生自由移动的离子,在电场的作用下定向移动,便产生了电流,这就是电解质导电的原因。有自由移动的离子即能电离,那么从电离的角度看,我们认识的酸碱盐在电离时都生成了何种离子?
[学生活动]学生讨论并归纳。
[强调]理解酸和碱的概念时注意“全部”两个字,即酸电离出的阳离子只有一种,碱电离出的阴离子只有一种。但H2O部分电离,阳离子全部是H+,但H2O不是酸。
[设计意图]落实常见酸、碱、盐电离方程式的书写,形成酸、碱、盐的定义,在应用中进一步巩固电离的概念。
[教师活动]以硫酸、碳酸电离讲解强电解质、弱电解质。延伸强酸酸式盐和弱酸酸式的电离方程式的书写。
【课堂小结】
通过本节课的学习,我们对电解质的知识有了一个初步的认识,下面我们来总结一下电解质的一些规律性的知识。
【板书设计】
2.1电解质的电离
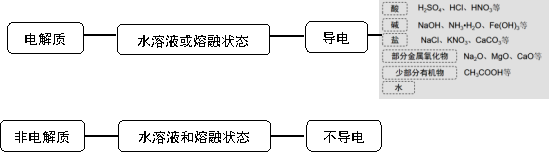 一、电解质与非电解质
一、电解质与非电解质

![]()
二、电离
电离方程式的书写
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应教学设计: 这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应教学设计,共3页。教案主要包含了课堂小结等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应教案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教案,共3页。教案主要包含了教学目标,教学重难点,教学过程,课堂小结,板书设计等内容,欢迎下载使用。
高中化学必修一 专题1.2.1 电解质的电离解析版): 这是一份高中化学必修一 专题1.2.1 电解质的电离解析版),共4页。













