高中化学第一章 物质及其变化第二节 离子反应教学设计
展开![]()
第二节 离子反应
第2课时 教学设计
【教学目标】
1.通过实验探究认识离子反应发生的条件。
2.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
3.能结合实例书写离子方程式。
【教学重难点】
离子方程式书写及判断、离子共存
【教学过程】
1.新课导入
【科学•模型微课堂】化学中的模型有实物模型、理论模型等,其中,理论模型应用范围最广。例如,十九世纪后期,瑞典化学家阿伦尼乌斯(S.Arthenius, 1859- 1927) 在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动地解离成离子,而不是当时流行的说法离子是通电后才产生的,并对电解质的电离进行了定量计算。电离模型很好地解释了酸、碱、盐溶液的某些性质,如酸、碱的强度等,因此发展成为近代的电离理论。阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
[师]正如阿伦尼乌斯提出的电解质溶于水后,电离成为自由移动的离子,那么电解质在溶液中的反应是否与离子有关?
[设计意图]与化学家提出的理论为依据,进一步提出问题,激发学生的兴趣。
2.新课讲授
第二节 离子反应
[板书]2.离子反应及反生条件
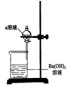
[实验探究]探究离子反应的本质
装置 | 所加a溶液 | 现象 | 结论 |
| NaCl溶液 | 无明显现象 | Na+、Cl-、Ba2+、OH-之间不能发生化学反应 |
Na2SO4溶液 | 产生白色沉淀 | SO42-与Ba2+发生反应,生成BaSO4 | |
H2SO4溶液 | 产生白色沉淀 | SO42-与Ba2+发生反应,生成BaSO4 |
[教师活动]展示氢氧化钡溶液、氯化钠溶液、硫酸钠溶液、硫酸溶液,按照表格进行实验,通过学生书写它们的电离方程式得出溶液中它们之间的反应。
[学生活动]学生从离子变化的角度分析上述现象,得出结论。
[总结]NaCl溶液与Ba(OH)2溶液并没有发生化学反应,只是NaCl电离出Na+、Cl-与Ba(OH)2电离出Ba2+、OH-的混合;而Na2SO4溶液、H2SO4溶液与Ba(OH)2溶液都发生了反应,生成了BaSO4沉淀。实质上是Ba2+和SO42-反应生成BaSO4。
[投影] 微观实质:![]()
[思考讨论]反应中除Ba2+和SO42-结合生成可见的白色沉淀BaSO4外,还有其他离子吗?它们是否也能结合?可以通过实验来结合吗?怎么证明?
[实验探究]
装置 | 所加a溶液 | 现象 |
| Na2SO4溶液 |
灯泡亮度变化不大 |
H2SO4溶液 |
灯泡亮度先变小至熄灭,再变大 |
[生]Na2SO4溶液与Ba(OH)2溶液反应后还有自由移动的离子Na+、OH-。
H2SO4溶液与Ba(OH)2溶液恰好完全反应无自由移动的离子。H+和OH-反应生成水分子。
[设计意图]让学生更深入地理解离子反应的概念,提出挑战性的问题,引发科学探究过程,实现深度学习。
[获取概念]离子反应:在反应中有离子参加或有离子生成的反应。
[师]Ba(OH)2溶液中电离出Ba2+、OH-,Na2SO4溶液中电离出Na+、SO42-,两种溶液混合后,Ba2+与SO42-发生反应,生成BaSO4。由原来的4种离子变为2种离子。所以离子反应的实质是使溶液中某些离子浓度减小。
[获取概念]离子反应:在反应中有离子参加或有离子生成的反应。
[过渡]离子反应方程式的书写是一个很复杂的问题,要正确书写离子方程式,还要掌握离子方程式的书写原则及步骤。
[教师活动]讲解离子方程式书写的原则,以NH4Cl与NaOH反应为例讲解书写步骤。
[强调]有气体或沉淀生成的离子反应,要检查离子方程式中是否注明“↑”“↓”。
[总结]写是基础,拆是关键,删是途径,查是保证。
[教师活动]重点讲解哪些物质能拆,哪些物质不能拆,并强调拆这一步骤同学们不能准确判断,需要同学们慢慢去掌握,不能急于求成,随着知识的积累,会越来越好。
[过渡]电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。电解质的电离可以用电离方程式表示。
[学生活动]完成P17思考讨论。
[师]上面的4个反应都是中和反应,虽然4个反应的化学方程式不同,但它们的离子方程式却是相同的。这表明:强酸与强碱发生中和反应的实质是,强酸电离出来的H+与强碱电离出来的OH-结合生成H2O。离子方程式揭示了化学反应的本质,不仅可以表示一个具体的化学反应,而且还可以表示同一类型的离子反应。
[板书]离子反应方程式的意义:不仅可以表示具体的化学反应,又可以表示同一类离子反应。
[设疑]哪些离子之间可以发生反应?
[师]从微观角度看,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中相互交换离子的反应。这类离子反应发生的条件就是复分解反应发生的条件,即生成沉淀、放出气体或生成水。只要具备上述条件之一,反应就能发生。
[投影]离子反应发生的条件:产生沉淀、放出气体、生成水。
[师]学习离子反应有很大的用途:可以检验离子的存在、用于混合物的提纯、解决离子共存问题、有关物质除杂的问题、消除水中的污染物等。
[师]首先我们一起来学习离子共存问题,离子共存即离子之间不能发生反应,判断离子是否大量共存,及判断离子之间能否发生反应。若反应,则不共存;若不共存,则能大量共存。哪些离子之间能发生反应?
[学生活动]以离子发生反应的条件为依据,举例。
[强调]判断离子共存时还需注意题目中所给说的限定条件——溶液无色透明,指的是不存在有色离子。还有隐含条件——酸性溶液、碱性溶液的描述。
[师]在物质提纯方面,我们以粗盐提纯为例,粗盐中含有Mg2+、SO42-、Ca2+,如何提纯?
[学生活动]学生设计实验。
[教师活动]讲解物质提纯的思路及原则。
[师]通过学习粗盐提纯,我们大致掌握了离子检验所加试剂,我们具体讲解常见离子的检验方法。
[教师活动]重点讲解SO42- 、CO32-、Cl-的检验方法。
【课堂小结】
通过本节课的学习,我们探究了认识离子反应的本质是反应的离子浓度减少;知道了电解质溶液发生离子反应的条件是产生沉淀、气体或水);学会了简单的离子方程式的书写,还了解了离子反应的应用。
【板书设计】
2.2离子反应及应用
一、离子反应
实质:离子反应使溶液中某些离子浓度减小。
书写步骤:一写、二拆、三删、四查
二、离子反应的应用
离子共存
粗盐提纯
离子检验
化学必修 第一册第二节 离子反应教学设计: 这是一份化学必修 第一册第二节 离子反应教学设计,共3页。
化学人教版 (2019)第二节 离子反应教学设计及反思: 这是一份化学人教版 (2019)第二节 离子反应教学设计及反思,共7页。教案主要包含了实验1-3等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应教案及反思: 这是一份人教版 (2019)必修 第一册第二节 离子反应教案及反思,共4页。教案主要包含了教学目标,教学重难点,教学过程,科学•模型微课堂,课堂小结,板书设计等内容,欢迎下载使用。