


人教版 (2019)选择性必修3第一节 有机化合物的结构特点第二课时教学设计
展开![]() 第一章 有机化合物的结构特点与研究方法
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第二课时 有机化合物中的共价键
教学目标:
1. 认识有机物中的两种基本化学键:σ键和π键。
2. 理解有机分子中碳原子的三种杂化分方式sp3、sp2、sp杂化以及它们与σ键和π键的关系。
3. 理解共价键的极性强弱与化学反应的关系。
4.会书写有机物的分子式、结构式,实验式、结构简式、电子式及键线式。
素养目标:
1.宏观辨识和微观探析:能从名称或结构视角探析有机物分子中碳原子的杂化方式及σ键和π键;能从共价键极性的强弱探析反应进行的快慢程度。
2.证据推理与模型认知:能熟练地运用结构简式、键线式等模型表征有机物。
教学重、难点:
重点:理解有机分子中碳原子的三种杂化分方式sp3、sp2、sp杂化以及它们与σ键和π键的关系。
难点:理解共价键的极性强弱与化学反应的关系。
教学过程:
学习任务二:有机物中的共价键有哪些
在有机物分子中,碳原子通过____________与其他原子形成不同类型的共价键,共价键的______和______对有机物的性质有很大的影响。
1.共价键的类型
(1)σ键

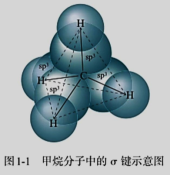
播放可视化视频后再总结。
CH4中的C—H键是碳原子sp3杂化轨道与氢原子1s轨道通过 “头碰头”形成的σ键,键角109°28′,分子空间结构为正四面体。
CH3CH3中碳原子以一个sp3杂化轨道形成C—Cσ键,另外三个sp3杂化轨道与氢原子1s轨道形成C—Hσ键。
(2)π键

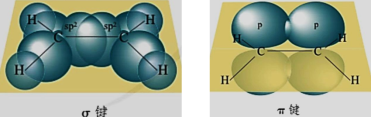
播放可视化视频后总结。
①在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的杂化轨道进行重叠,形成4个C—Hσ键与一个C—Cσ键;两个碳原子未参与杂化的轨道以 “肩并肩”的形式从侧面重叠,形成1个π键。
π键的重叠程度比σ键小,所以不如σ键牢固,比较容易断裂而发生化学反应。因为π键是镜面对称的,所以通过π键连接的原子或原子团不能绕键轴旋转。

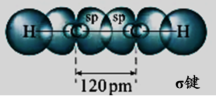
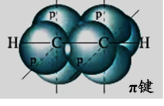
播放可视化视频后总结。
②在乙炔分子中,两个碳原子均以sp杂化轨道与氢原子的1s轨道及另一个碳原子的杂化轨道进行重叠,形成1个C—Hσ键与一个C—Cσ键;两个碳原子未参与杂化的轨道以 “肩并肩”的形式从侧面重叠,形成了两个π键。
一般情况下,有机物中的单键是σ键,双键中含一个σ键和一个π键,三键中含有一个σ键和两个π键。一般的有机反应就是有机物分子中旧共价键断裂和新共价键形成的过程,共价键的类型与有机反应的类型密切相关。如,乙烷分子中含有σ键,能发生取代反应;乙烯和乙炔分子的双键和三键中含有π键,它们都能发生加成反应。
2.共价键的极性与有机反应
由于不同的成键原子间______的差异,___________会发生偏移。偏移的程度越大,共价键极性_____,在反应中越容易发生_____。因此,有机物的______及其邻近______的往往是发生化学反应的活性部位。
[实验1-1]
现象:
钠与水 | 钠与乙醇 |
钠浮在水面上,迅速熔成闪亮的小球,并四处游动,发出“嘶嘶”的声音,反应剧烈。 | 钠先沉入液面下,随反应一段时间后上浮,钠仍为块状,生成少量气体,反应较剧烈。 |
问题与探讨
1.进一步实验证明1mol乙醇与足量的钠反应生成0.5molH2,那么乙醇与钠反应时断裂的是氧氢键还是碳氢键(即钠置换出的氢是碳上的氢或是羟基氢)?你能不能从理论上加以解释?
![]()
是断裂的氧氢键(即置换出羟基氢)。原因:C的电负性(2.5) < O电负性(3.5),氧氢键的极性大于碳氢键,氧氢键更容易断裂。
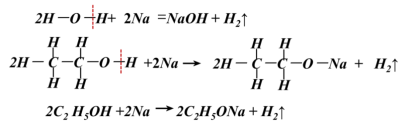
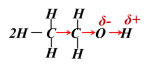
2.乙醇与钠反应为什么没有水与钠反应剧烈?
烷基(-R)是推电子基团, 由于乙醇分子中乙基的推电子效应,氧氢键极性降低,使乙醇分子中的氧氢键极性小于水分子中的氧氢键,水分子中的氧氢键更容易断裂,所以钠与水反应更剧烈。
3.通过以上分析,你还得出什么结论?
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响着官能团和物质的性质。
另外,由于羟基中的氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,如乙醇与氢溴酸能发生反应,碳氧键发生断裂。

![]()
共价键的断裂需要吸收能量,而且有机物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
思考与讨论
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
① CH4 + Cl 2![]() CH3Cl + HCl CH4分子中含有C-Hσ键,易发生取代反应。
CH3Cl + HCl CH4分子中含有C-Hσ键,易发生取代反应。
② CH2 =CH2 + Br2 → CH2Br - CH2Br CH2 =CH2分子中碳碳双键含有π键,易发生加成反应。
3.有机物组成结构有哪些表征方法——“六式”(以丙烯为例)
(1)分子式:用元素符号和数字表示分子的原子构成的式子。C3H6
(2)最简式(实验式):表示分子式最简整数比的式子。CH2
(3)电子式:用·或×表示原子最外层电子的式子。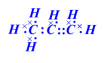
(4)结构式:用“-” 表示一对共用电子对的式子。
(5)结构简式:省略部分或全部“-”的结构式。CH3 CH = CH2
![]() (6)键线式:省略碳和氢,只表示分子中键的连接方式和官能团,每个拐点和终点表示一个碳原子的式子。
(6)键线式:省略碳和氢,只表示分子中键的连接方式和官能团,每个拐点和终点表示一个碳原子的式子。
CH3CH2CH2OH→ ![]()
学习评价:将下列有机物结构简式改写成键线式。
![]()
![]()
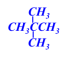
![]()
![]()
![]()
![]()
![]()
![]()
![]()
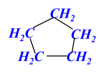
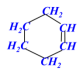
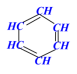
![]()
![]()
![]()
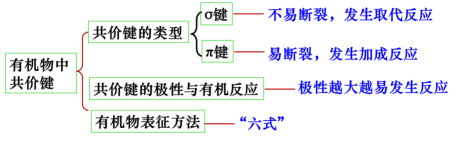
板书设计:
作业设计:
教学反思:
高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物第二课时教案: 这是一份高中化学人教版 (2019)选择性必修3第四节 羧酸 羧酸衍生物第二课时教案,共7页。教案主要包含了设计与实验等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修3第二节 醇酚第二课时教案: 这是一份高中化学人教版 (2019)选择性必修3第二节 醇酚第二课时教案,共5页。
人教版 (2019)选择性必修2第一节 共价键第二课时教学设计: 这是一份人教版 (2019)选择性必修2第一节 共价键第二课时教学设计,共2页。













