




化学选择性必修1第一节 化学反应速率教学演示ppt课件
展开相同条件下,由于反应物的组成、结构和性质等因素,不同的化学反应会有不同的速率,而外界条件(浓度、压强、温度及催化剂等因素)也会影响反应速率。
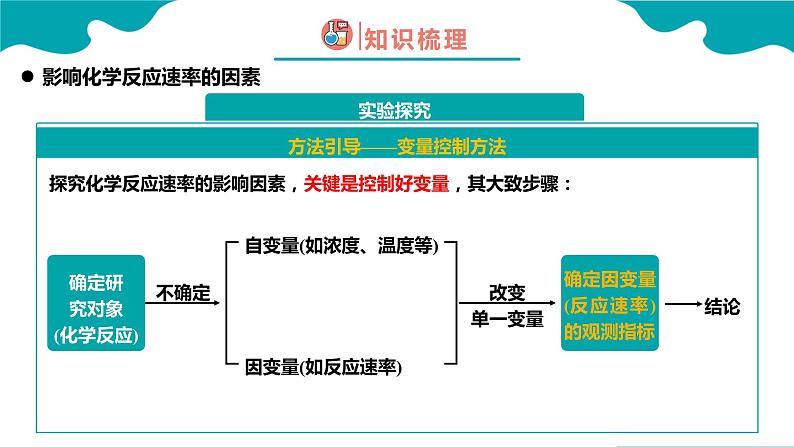
方法引导——变量控制方法
探究化学反应速率的影响因素,关键是控制好变量,其大致步骤:
影响化学反应速率的因素
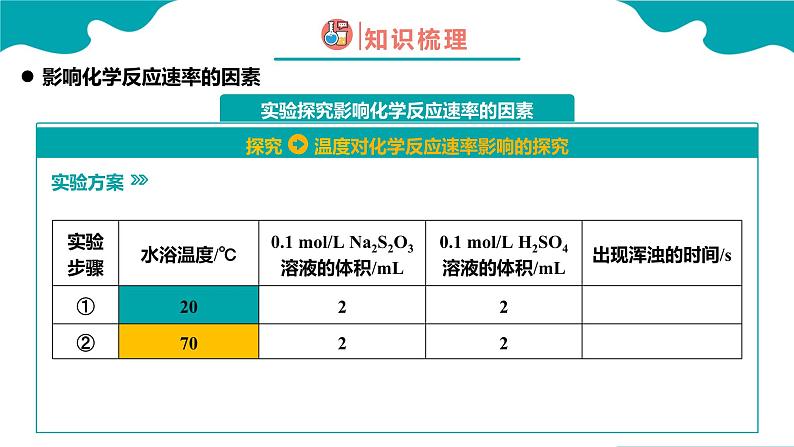
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。0.1 ml/L Na2S2O3溶液、 0.1 ml/L H2SO4溶液、 0.5 ml/L H2SO4溶液、 5% H2O2溶液、 1 ml/L FeCl3溶液、蒸馏水、热水
Na2S2O3(硫代硫酸钠)溶液与 H2SO4 溶液反应如下:
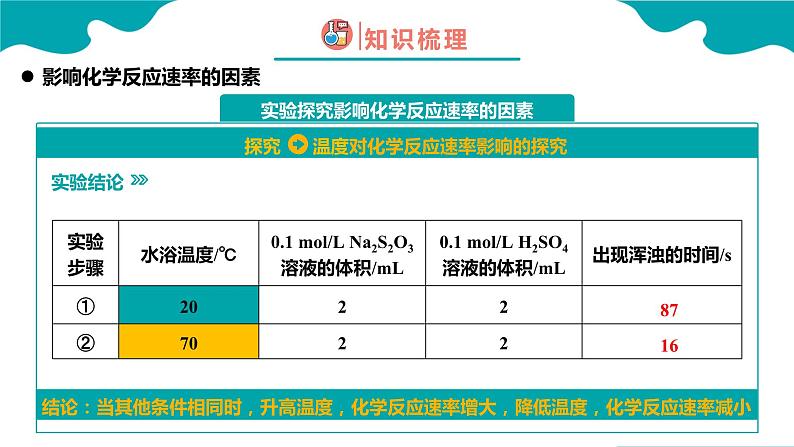
结论:当其他条件相同时,升高温度,化学反应速率增大,降低温度,化学反应速率减小
大量实验证明,温度每升高 10 ℃,化学反应速率通常增大为原来的 2~4 倍。这表明温度对反应速率的影响非常显著。催化剂也可以改变化学反应速率。对于有气体参加的化学反应,改变压强同样可以改变化学反应速率。
从微观上看,反应物分子一般总是经过若干个简单的反应步骤才最终转化为产物分子的。每一个简单的反应都称为一个基元反应。
反应历程是化学中用来描述某一化学变化所经由的全部基元反应,反应历程又称反应机理。
任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为 1 ml/L 时,在每立方厘米、每秒内反应物分子间的碰撞可达到 1028 次。如果反应物分子间的任何一次碰撞都能发生反应的话,任何气体的反应均可以瞬间完成。但实际并非如此。
其它条件不变时,升高温度,单位体积内活化分子的数目增大,单位体积内活化分子百分数增多,单位时间内有效碰撞次数增多,化学反应速率加快;反之则慢
在其它条件不变时,增大反应物浓度,单位体积内活化分子的数目增大,单位时间内有效碰撞次数增多,化学反应速率加快;反之则慢
【例1】在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),分析改变下列条件化学反应速率如何改变(填“变大”“变小”或“不变”),阐述理由。(1)增加铁片的质量(不考虑表面积的变化)_____,理由___________________________________________________。(2)保持容器的容积不变,增加水蒸气的通入量_____,理由________________________________。
数,改变用量不影响化学反应速率
(3)保持容器内压强不变,充入一定量的氩气_____,理由_____________________________________________________________________________。(4)保持容器的容积不变,充入一定量的氩气_____,理由_____________________________________________________________________________。
在其它条件不变时,增大气体反应体系压强,相当于压缩体积,反应物的浓度增大,单位体积内活化分子数目增大,化学反应速率加快;反之则慢。(有气体反应)
在其它条件不变时,充入非反应气体,压强不变,体积增大,各物质浓度减小,反应速率减慢
入氩气,容器体积增大,水蒸气的浓度变小,因而化学反应速率变小
在其它条件不变时,充入非反应气体,压强增大,但各物质浓度不变,反应速率不变
充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变
观察下图,思考:为什么催化剂对化学反应速率有显著影响?
其他因素对化学反应速率的影响
飞秒化学是物理化学的一支,研究在极小的时间内化学反应的过程和机理。这一领域涉及的时间间隔短至约千万亿分之一秒,即1飞秒(fs, 1 fs=10-15 s) 。在这个极小的时间段里,产生的飞秒激光可以用于检测分子、原子、离子的结构、组成、运动等形成飞秒检测范畴。
1.控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是( ) A.浓度 B.温度 C.催化剂 D.固体质量
2.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )A.大小、形状相同的镁片、铁片,前者与盐酸反应放出H2的速率比后者大B.Cu与浓硝酸反应比与稀硝酸反应快C. N2与O2在常温、常压下不反应,放电时可反应D.Cu与浓硫酸能反应,而不与稀硫酸反应
3.在一密闭容器中充入1 ml H2和1 ml I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是( )A.保持容器容积不变,向其中加入1 ml H2(g),反应速率加快B.保持容器容积不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快C.保持容器内气体压强不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快D.保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g),再次平衡时反应速率一定加快
4.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是( ) A.该反应为吸热反应B.产物的稳定性:P1>P2C.该历程中最大正反应的活化能E正=186.19 kJ·ml-1D.相同条件下,由中间产物Z转化为产物的速率:v(P1)
0.12 ml·L-1·s-1
高中人教版 (2019)第一节 反应热课前预习ppt课件: 这是一份高中人教版 (2019)第一节 反应热课前预习ppt课件,共29页。PPT课件主要包含了热化学方程式,燃烧热,火箭推进剂燃料的选择,7258KJ等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率评课ppt课件: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率评课ppt课件,共44页。PPT课件主要包含了物质的量,反应时间,min,反应速率,molL·s,-01,-03,∶3∶2,不同反应时刻,导电能力等内容,欢迎下载使用。
选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率说课ppt课件: 这是一份选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率说课ppt课件,共41页。PPT课件主要包含了压强温度,要点二活化能,I·―→I2,每一步,反应机理,有效碰撞等内容,欢迎下载使用。













