





高中化学人教版 (2019)选择性必修1第一节 反应热优质ppt课件
展开自热食品,是指不依赖电、火等方式加热,而用自带发热包加热的预包装食品。 如自热米饭,自热火锅等。使用时,只需将特制的发热包放在食盒底部,再加入一杯凉水,即可制作出热气腾腾食物。你知道其中的原理吗?请写出方程式。
自热火锅里面的加热包主要成分是焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰、碳酸钠等,不同的商家可能存在成分上的差别,但是自热火锅加热的原理都是生石灰遇水变成熟石灰,从而释放热能并产生水蒸气,达到煮熟食物的作用。CaO + H2O === Ca(OH)2
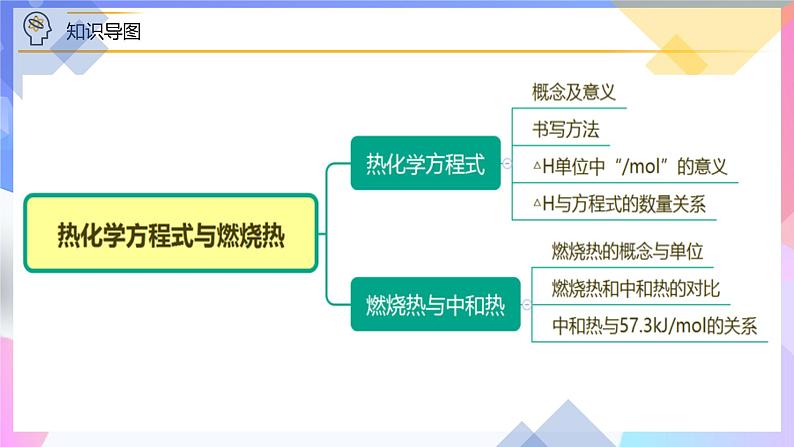
模块一 热化学方程式
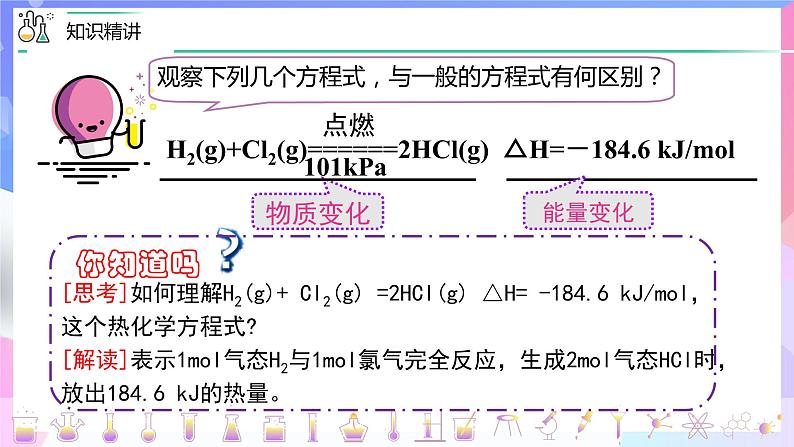
[思考]如何理解H2(g)+ Cl2(g) =2HCI(g) △H= -184.6 kJ/ml,这个热化学方程式?[解读]表示1ml气态H2与1ml氯气完全反应,生成2ml气态HCl时, 放出184.6 kJ的热量。
任务一 热化学方程式的概念及意义
2.书写热化学方程式时应注意:(1)热化学方程式需注明反应时的温度和压强。因为反应时的温度和压强不同,其△H也不同。但中学所用△H的数据,一般都是 25℃和 101kPa时的数据,因此可不特别注明。
1.定义:表明反应所释放或吸收热量的化学方程式,叫做热化学方程式。
意义:既表明了物质变化,又表明了能量变化。
2.书写热化学方程式时应注意:(1)不写反应条件,热化学方程式需注明反应时的温度和压强。因为反应时的温度和压强不同,其△H也不同。但中学所用△H的数据,一般都是 25℃和 101kPa时的数据,因此可不特别注明。
标注状态:固体(s)、液体(l)、气体(g)、溶液(aq)
等质量水的焓(能量):H2O(s)< H2O(l)< H2O(g)
H2O(g)==H2O(l) △H=-44kJ/ml
H2O(l)==H2O(g) △H=+44kJ/ml
任务二 热化学方程式的书写
等质量水的焓:H2O(s)< H2O(l)< H2O(g)
H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/ml ①
1/2H2(g)+1/2Cl2(g)=HCl(g) △H=-92.3kJ/ml ②
任务三 ΔH 的单位中“ml-1”的含义
对于任意一个化学反应: aA+bB=cC+dD, ∆H单位中的ml-1,既不是“每摩尔A”,也不是每摩尔B(或C、D)”,而是“每摩尔反应”。1 ml H2(g)和 1 ml Cl2(g) 反应生成2 ml HCl(g),“每摩尔反应” 放出184.6kJ的热量。例如,对于反应:
这就是AH必须与化学方程式一一对应的原因。
H2(g)+Cl2(g)=2HCl(g) ∆H =-184.6kJ/ml
1 ml H2(g)和 1 ml Cl2(g) 反应生成2 ml HCl(g),“每摩尔反应” 放出184.6kJ的热量。
1/2H2(g)+1/2Cl2(g)=HCl(g) ∆H=-92.3kJ/ml
0.5 ml H2 (g)和 0.5 ml Cl2 (g)反应生成1 ml HCl(g)表示“每摩尔反应”,“每摩尔反应”放出92.3kJ的热量
(5)ΔH 的单位中“ml-1”的含义
有人说,下列两个反应的△H相同,这种说法是否正确?为什么?
2CO(g)+O2(g)=2CO2(g) ①CO(g)+1/2O2(g)=CO2(g) ②
【提示】不正确。 同一化学反应,热化学方程式中同一物质的化学计量数和△H成正比。这两个化学方程式中的同一物质的化学计量数不同,因此△H不同,方程式①的△H是方程式②的2倍。
(1)注明反应的温度和压强,因反应的温度和压强不同时,其△H也不同。但中学所用的△H数据,一般都是在101kPa和25℃时的数据,可不特别注明。(2)注明反应物和生成物的聚集状态:气态(g)、液态(l)、固态(s)、溶液(aq)反应条件可以不写。(3)△H的“+”与“-”,“+”代表吸热,“-”代表放热。(4)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的物质的量,因此,它可以是整数,也可以是简单分数,但不可以是小数。(5)相同的反应,化学计量数不同时,△H的数值就不同。 △H的数值一定要与物质前的化学计量数相对应。体现定量计算。
书写热化学方程式注意事项
题型二:热化学方程式的正误判断
【练习1】 由氢气与氧气反应生成1 ml水蒸气放出241.8 kJ的热量,1 g水蒸气转化为液态水放出2.45 kJ的热量,则下列热化学方程式书写正确的是( )
【解析】放热反应的ΔH为“-”,C、D错误;1 ml水蒸气转化为相同条件下的1 ml液态水时要放出44.1 kJ的热量,可求出ΔH为-285.9 kJ·ml-1,B错误,故选A项。【答案】A
1.在25 ℃、101 kPa下,1ml气态H2与0.5ml气态O2反应生成1ml气态H2O,放出241.8kJ的热量:_______________________2.在25 ℃、101 kPa下,1ml气态H2与足量气态O2反应生成1ml液态H2O,放出285.8kJ的热量:______________________
H2(g) + O2(g) ==== H2O(g) ΔH =﹣241.8 kJ/ml
H2(g) + O2(g) ==== H2O(l) ΔH =﹣285.8 kJ/ml
若A (g) + B(g) === C(g) + D(g) ΔH = a kJ/ml 则:① x A (g) + x B(g) === x C(g) + x D(g) ΔH = _____ kJ/ml ② x C(g) + x D(g) === x A (g) + x B(g) ΔH = _____ kJ/ml
已知,H2(g)+Cl2(g)=2HCl(g)ΔH=−184.6kJ⋅ml−1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g) ΔH为__________________
+92.3 kJ⋅ml−1
题型三:热化学方程式的书写
【练习2】依据事实,写出下列反应的热化学方程式。(1)1ml Cu(s)与适量O2(g)反应生成CuO(s),放出157.3kJ的热量。(2)1ml C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411.0kJ的热量。(3)1mlC(s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.5kJ的热量。
【答案】(1)Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/ml(2)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=-1411.0kJ/ml(3)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ/ml
【练习3】已知:(1)1 ml N2(g)中的化学键断裂时需要吸收946kJ的能量。(2)1 ml O2(g)中的化学键断裂时需要吸收498kJ的能量。(3)1 ml NO(g)中的化学键形成时要释放632kJ的能量。请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
【答案】N2(g)+O2(g)=2NO(g) △H=+180kJ/ml
【解析】N2(g)+O2(g)=2NO(g) △H=(946kJ/ml+498kJ/ml-632kJ/ml×2)=+180kJ/ml
★热化学方程式所表示的意义★热化学方程式的书写注意事项
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) ∆H=−890 kJ/ml
(1)25 ℃、101 kPa下,8 g CH4完全燃烧,放出 445.0 kJ热量;
1.写出下列反应的热化学方程式
(2)煤气的主要成分为CO和H2,常温下14 g CO完全燃烧,放出141.5 kJ热量
2.(2021·河北唐山市·)下列热化学方程式正确的是
【例4】(2020·宁乡市第七高级中学高二月考)写出下列反应的热化学方程式:(1)NH3(气态)在高温高压催化剂下分解生成1ml N2(气态)与H2(气态),吸收92.2kJ的热量__________________________________________。(2)1ml H2(气态)与适量O2(气态)起反应,生成H2O(液态)能放出285.8kJ的热量________________________________________________。(3)32g Cu(固态)与适量O2(气态)起反应,生成CuO(固态)放出78.5kJ的热量_______________________________________________________________________。
【变4】(2021·全国高三专题练习)根据信息书写热化学方程式(1)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 ml AX5,放出热量123.8 kJ。该反应的热化学方程式为___________。(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为___________。(3)在一定条件下,将1 ml N2和3 ml H2充入一密闭容器中发生反应生成氨气,达到平衡时N2的转化率为25%,放出Q kJ的热量,写出N2与H2反应的热化学方程式为___________。
(4)化学反应N2+3H2 2NH3的能量变化如图所示试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式_______________。(5)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_______________________。
题型一:热化学方程式的概念与意义
【例1】(2020·确山县第二高级中学)下列说法不正确的是A.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数B.物质发生化学反应的反应热仅指反应放出的热量C.所有的燃烧反应都是放热的D.热化学方程式中,化学式前面的化学计量数可以是分数
【变1】(2020·正阳县高级中学高二月考)下列说法错误的是( )A.热化学方程式各物质前的化学计量数不表示分子个数只代表物质的量B.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同D.同一化学反应,化学计量数不同,ΔH不同,化学计量数相同而状态不同,ΔH也不相同
【例2】(2021·青海海东市·平安一中高二月考)热化学方程式:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ/ml和H(g)+H(g)=H2(g) ΔH=-435.7 kJ/ml表示 A.氢原子的能量比氢分子的能量低B.一个氢原子与一个氢原子结合生成1个氢分子且放出435.7 kJ的能量C.1 ml固态碳和1 ml水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJD.固态碳和液态水反应生成一氧化碳气体和氢气吸收131.3 kJ能量
【变2】(2020·全国高二课时练习)以NA代表阿伏加德罗常数,则关于热化学方程式 :C2H2 ( g ) +5/2O2 ( g ) →2CO2 ( g )+H2O ( l ) △H = —1300kJ / ml 的说法中,正确的是( )A.当10 NA个电子转移时,该反应放出1300kJ的能量B.当1 NA个水分子生成且为液体时,吸收1300kJ的能量C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量D.当10 NA个碳氧共用电子对生成时,放出1300kJ的能量
人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件: 这是一份人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件,共27页。PPT课件主要包含了学习目标,课前导入,只表示物质变化,热化学方程式,化学方程式,知识点一,书写步骤,①写方程式,②标状态,③标条件等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热评课课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热评课课件ppt,共1页。
高中化学人教版 (2019)选择性必修1第一节 反应热获奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热获奖ppt课件,共22页。PPT课件主要包含了知识回顾,方法归纳,感谢您的观看等内容,欢迎下载使用。













