



所属成套资源:新人教版化学选择性必修1课件PPT全套
高中化学人教版 (2019)选择性必修1第二节 化学平衡试讲课ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡试讲课ppt课件,共17页。PPT课件主要包含了学习目标,解题思路,ct图像,nt图像,各类图象的归纳小结,浓度-时间图,先拐先平数值大,T2>T1,升温左移,ΔH<0等内容,欢迎下载使用。
1.化学反应速率及化学平衡图像的分析。2.接受、吸收、整合化学信息的能力。3.分析和解决(解答)化学问题的能力。
学习任务速率 平衡图像的类型和分析
你认为解图像题的基本思路是什么?
(1)、 看懂图像面:图像形状,横、纵坐标的含义 线:走向,变化趋势点:起点、终点、交点、拐点是否需作辅助线(等温线、等压线)定量图像中有关量的多少
(2)、联想规律,作出判断增大浓度增大压强 速率增大升高温度加催化剂
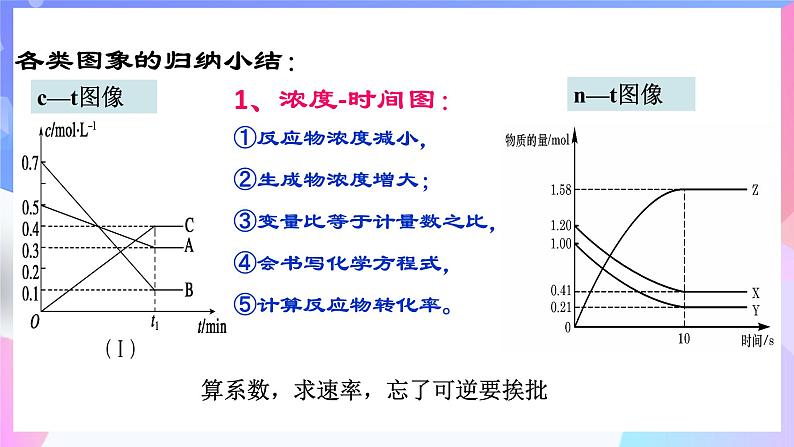
算系数,求速率,忘了可逆要挨批
①反应物浓度减小,②生成物浓度增大;③变量比等于计量数之比,④会书写化学方程式,⑤计算反应物转化率。
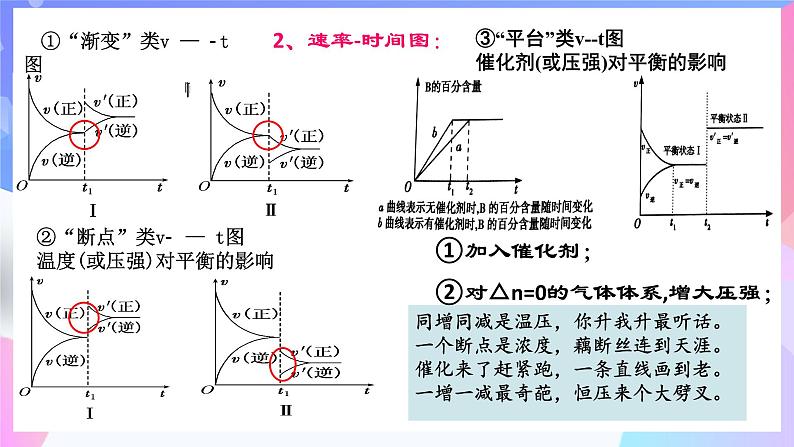
①“渐变”类v — t图浓度对平衡的影响
②“断点”类v — t图温度(或压强)对平衡的影响
同增同减是温压,你升我升最听话。一个断点是浓度,藕断丝连到天涯。催化来了赶紧跑,一条直线画到老。一增一减最奇葩,恒压来个大劈叉。
2、速率-时间图:
③“平台”类v-t图催化剂(或压强)对平衡的影响
①加入催化剂; ②对△n=0的气体体系,增大压强;
④全程速率时间图:表示某个反应全程的速率随时间的变化
OC段:反应放热,使温度升高,速率加快
C以后:反应物浓度降低,速率减慢
例1,合成氨反应:N2(g)+3H2(g) ⇌ 2NH3(g) ΔH=-92.4 kJ·ml-1,在反应过程中,正反应速率的变化如图。下列说法正确的是( )A.t1时升高了温度 B.t2时使用了催化剂C.t3时增大了压强 D.t4时降低了温度
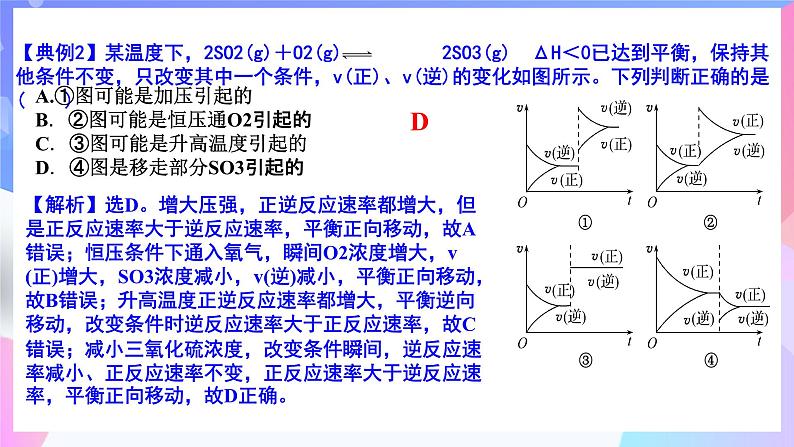
【典例2】某温度下,2SO2(g)+O2(g) 2SO3(g) ΔH<0已达到平衡,保持其他条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是( )
A.①图可能是加压引起的B.②图可能是恒压通O2引起的C.③图可能是升高温度引起的D.④图是移走部分SO3引起的
【解析】选D。增大压强,正逆反应速率都增大,但是正反应速率大于逆反应速率,平衡正向移动,故A错误;恒压条件下通入氧气,瞬间O2浓度增大,v(正)增大,SO3浓度减小,v(逆)减小,平衡正向移动,故B错误;升高温度正逆反应速率都增大,平衡逆向移动,改变条件时逆反应速率大于正反应速率,故C错误;减小三氧化硫浓度,改变条件瞬间,逆反应速率减小、正反应速率不变,正反应速率大于逆反应速率,平衡正向移动,故D正确。
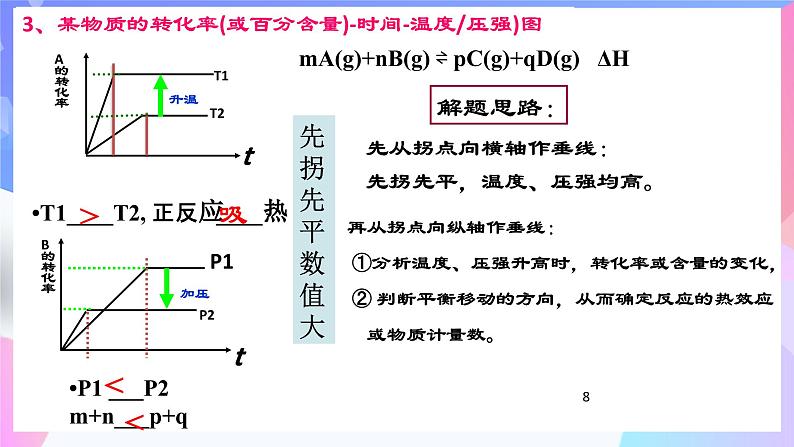
3、某物质的转化率(或百分含量)-时间-温度/压强)图
•T1____T2, 正反应____热
mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
先从拐点向横轴作垂线:先拐先平,温度、压强均高。
再从拐点向纵轴作垂线: ①分析温度、压强升高时,转化率或含量的变化, ② 判断平衡移动的方向,从而确定反应的热效应 或物质计量数。
先找出谁先拐,谁的温度就高,然后看平衡向哪移动进而判断ΔH
B的含量越来越高,这个反应是向左进行的。
③同时确定ΔH和左右气体系数
mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
•正反应 热m+n p+q
4、某物质的转化率(或百分含量)-温度(或压强)图:
① 直接看横轴:温度升高,图象的变化趋势,得知温度对平衡的影响。
② 再向横轴作垂线:(即在等温时),得知压强对平衡的影响。
•正反应 热m+n p+q
交点为平衡状态,交点左侧为达平衡过程,右侧为平衡移动过程
•m+n p+q
L线上所有的点都是平衡点。左上方(E点),A%大于此压强时平衡体系中的A%,E点必须朝正反应方向移动才能达到平衡状态,所以,E点v正>v逆;则右下方(F点)v正
相关课件
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控评课课件ppt,共29页。PPT课件主要包含了空气变面包的反应,化学反应的调控等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共16页。PPT课件主要包含了有效碰撞,随堂练习,答案C等内容,欢迎下载使用。
这是一份化学选择性必修1第一节 化学反应速率试讲课课件ppt,共9页。PPT课件主要包含了情境导入,知识回顾,化学反应的快慢,外界条件,接触面积,催化剂,浓度大速率快,温度高速率快,接触面积大速率快,典例分析等内容,欢迎下载使用。









