




高中化学第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡优秀ppt课件
展开1.了解难溶电解质的沉淀溶解平衡及其影响因素。 (重点)2.了解溶度积的含义及其表达式。3.学会运用溶度积与离子积的关系判断反应进行的方向。
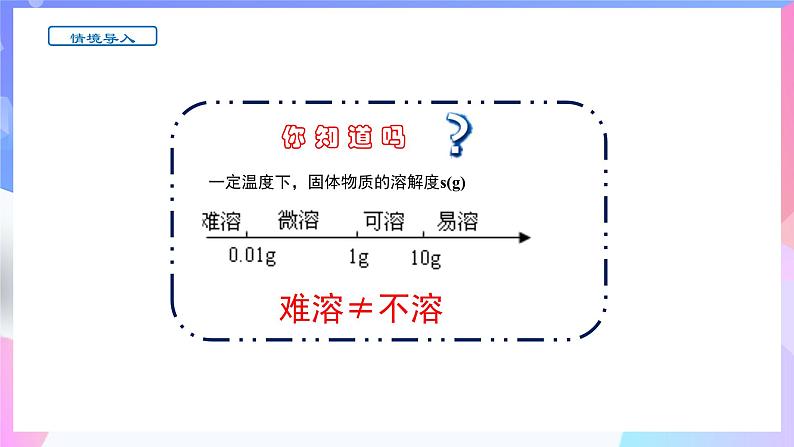
一定温度下,固体物质的溶解度s(g)
写出饱和CaCO3溶液中的溶解平衡表达式
难溶物在水中一点都不溶吗?
在一定的温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量。
大部分固体随温度升高溶解度增大
2.溶解度与溶解性的关系:
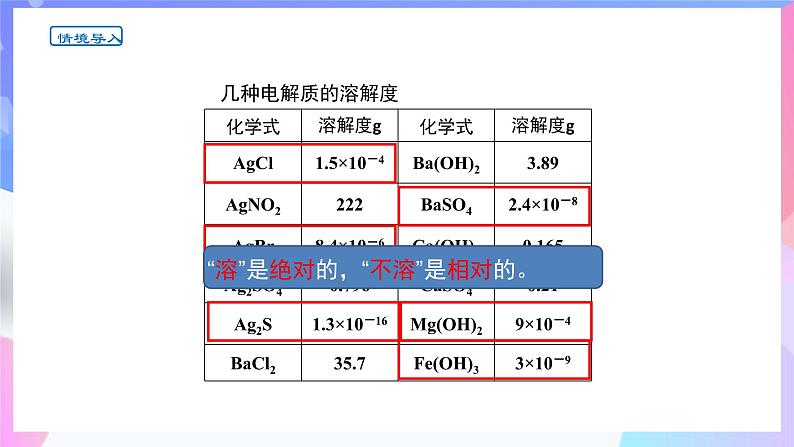
注:物质在水中“溶”与“不溶”是相对的, “不溶”是指难溶,没有绝对不溶的物质。
学习任务一 难溶电解质的沉淀溶解平衡
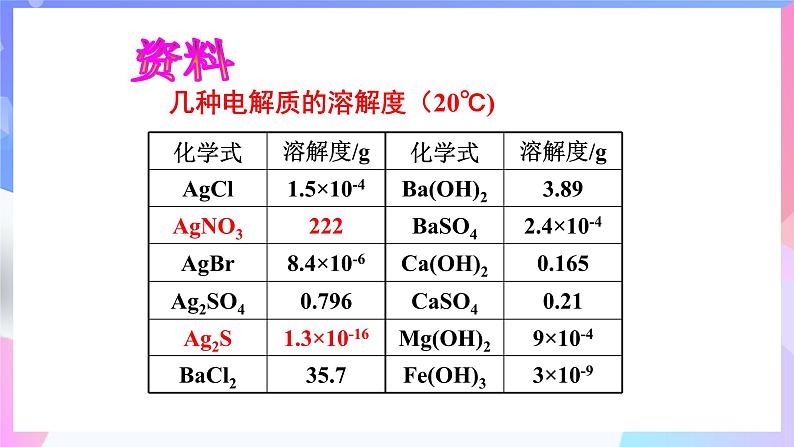
几种电解质的溶解度(20℃)
在饱和NaCl溶液中加入浓盐酸
解释: 在NaCl的饱和溶液中,存在溶解平衡
NaCl饱和溶液中有固体析出
加浓盐酸会使c(Cl- )增加,平衡向左移动,因而有NaCl晶体析出。
可溶的电解质溶液中存在溶解平衡,那么难溶的电解质在水中是否也存在溶解平衡呢?
2.要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加入浓盐酸(同离子效应)
1.NaCl在水溶液里达到饱和状态时有何特征?
NaCl的溶解速率与结晶速率相等;并且只要条件不变,该溶液中溶解的NaCl的量就是一个恒定值。
1.当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?
有 溶解度:1.5×10-4
3.难溶电解质(如AgCl)是否存在溶解平衡?如何表示?
2.有沉淀生成的离子反应能不能完全进行到底呢?
化学上通常认为残留在溶液中的离子浓度小于10-5ml/L时,沉淀达到完全。
当v溶解= v沉淀时,得到饱和AgCl溶液,建立溶解平衡
注:a.标明聚集状态 b.不等同于电离平衡
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态(饱和状态)。
(2)溶解平衡的特征:
(1)当v溶解= v沉淀时,得到饱和AgCl溶液,建立溶解平衡
①绝对不溶的电解质是没有的②同是难溶电解质,溶解度差别也很大③易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡
⑴内因:电解质本身的性质
→ ↑ ↑
→ 不变 不变
不移动 不变 不变
← ↑ ↓
← ↓ ↑
→ ↑ ↓
影响溶解平衡的因素:
平衡右移,向溶解方向移动
平衡左移,向生成沉淀的方向移动
减小离子浓度,平衡向溶解方向移动
温度升高,多数溶解平衡向溶解方向移动。
将AgCl分别投入下列溶液中:①40 mL 0.03 ml·L-1的HCl溶液②50 mL 0.03 ml·L-1的AgNO3溶液③30 mL 0.02 ml·L-1的CaCl2溶液④10 mL蒸馏水 AgCl的溶解度由大到小的顺序是 。
1.定义:在一定温度下,难溶物达到沉淀溶解平衡状态时,饱和溶液中各离子浓度化学计量数次方的乘积。
对于反应MmAn(s) mMn+(aq)+nAm-(aq),
Ksp =[c(Mn+)]m · [c(Am-)]n
算一算:已知25℃Ksp[Fe(OH)3]≈2.7×10-39,氢氧化铁饱和溶液中c(OH-)≈_______________,pH ≈ 。
3×10-10 ml/L
学习任务二 溶度积常数及溶度积规则
常见难溶电解质的溶度积与溶解度(25°C)
比较AgCl AgBr AgI在水中的溶解能力:____________比较BaSO4、CaCO3在水中的溶解能力:__________比较AgCl、 Fe(OH)3在水中的溶解能力:______ ______
AgCl > AgBr > AgI
CaCO3〉 BaSO4
AgCl>Fe(OH)3
一定温度下, Ksp的大小反映了物质在水中的溶解能力。
对于同类型(阴阳离子数目比值相同)的难溶电解质,Ksp越大,其溶解能力越强。
4、影响Ksp的因素:
Ksp的大小只与难溶电解质本身的性质和温度有关
相同类型的难溶电解质,在同温度下,Ksp越大,溶解度越大;不同类型的难溶电解质,应通过计算才能进行比较。
5. 溶度积与溶解度之间的换算
例1:298 K时硫酸钡的溶解度为1.04×10-5 ml·L-1,如果在0.010 ml·L-1的硫酸钠溶液中,BaSO4的溶解度是多少?解:①先求Ksp BaSO4 Ba2+ + SO42- 1.04×10-5 1.04×10-5 Ksp= c(Ba2+) · c(SO42-) =1.04×10-5×1.04×10-5 =1.08×10-10
②求S Na2SO4 === 2Na+ + SO42- BaSO4 Ba2+ + SO42- 0.01 0.01 初 0 .01 平衡 S S+0.01≈0.01 Ksp= c(Ba2+) · c(SO42-)=S×0.01 S=Ksp/0.01=1.08×10-10/0.01 =1.08×10-8 ml·L-1 S<<0.01,即前面的近似是合理的。答:溶解度是1.08×10-8 ml·L-1。
例2:已知Ksp,AgCl=1.810-10, Ksp, Ag2CrO4 =9.010-12,试求AgCl和Ag2CrO4的溶解度(用g/L表示)
在水中:AgCl溶解度小于Ag2CrO4的溶解度
溶度积规则——判断有无沉淀生成
对AaBb aAb++bBa-来说,(1)Qc=ca(Ab+)cb(Ba-)<Ksp,溶液未饱和,还可溶解;(2)Qc=ca(Ab+)cb(Ba-)=Ksp, 恰好饱和,达到平衡;(3)Qc=ca(Ab+)cb(Ba-)>Ksp, 过饱和,有沉淀析出。
例1:AgCl的Ksp=1.80×10-10,将0.001 ml/L NaCl和0.001 ml/L AgNO3 溶液等体积混合,是否有AgCl 沉淀生成?
解:两溶液等体积混合后, Ag+ 和Cl-浓度都减小到原浓度的1/2。c(Ag+)=c(Cl-)=1/2×0.001=0.000 5(ml/L)在混合溶液中,则Qc =c(Ag+) · c(Cl-)=(0.000 5)2=2.5 ×10-7因为Qc>Ksp,所以有AgCl 沉淀生成。
例2: 在1L含1.0×10-3ml·L-1 的SO42-溶液中,注入0.01ml BaCl2溶液(假设溶液体积不变)能否有效除去SO42-?已知:Ksp(BaSO4)= 1.1×10-10
解:c(Ba2+)=0.01ml/L, c(SO42-)=0.001ml/L,生成BaSO4沉淀后,Ba2+过量,过量的c[Ba2+]=0.01-0.001=0.009(ml/L). 溶液中残留的c[SO42-]=Ksp/c[Ba2+] = 1.1×10-10/9.0×10-3=1.2×10-8(ml/L) 因为,残留的c[SO42-]=1.2×10-8ml/L<1.0×10-5ml/L 所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度﹤10-5ml/L时,认为离子已沉淀完全或离子已有效除去。
例3:已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42- ,浓度均为0.010 ml·L-1,向该溶液中逐滴加入0.010 ml·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )A.Cl-、Br-、 CrO42- B. CrO42- 、Br-、Cl-C.Br-、Cl-、 CrO42- D.Br-、 CrO42- 、Cl-
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡授课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡授课课件ppt,共27页。PPT课件主要包含了镁与水的反应,探究活动,溶液显碱性,难溶并非不溶,有气泡产生溶液变红,溶解度,nAgCl,V溶液,≈1×10-6mol,100mL等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡试讲课ppt课件: 这是一份苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡试讲课ppt课件,共26页。PPT课件主要包含了课前导入,沉淀溶解平衡,溶度积的应用,溶度积的计算,课堂小结等内容,欢迎下载使用。
人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖ppt课件: 这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖ppt课件,文件包含341难溶电解质的沉淀溶解平衡练习解析版docx、341难溶电解质的沉淀溶解平衡练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













